第五节 蛋白质的性质
一、蛋白质的相对分子质量
蛋白质是高分子化合物,相对分子质量一般在1万~100万,甚至更大一些。这是蛋白质分子最突出的特性,并且不同种类的蛋白质分子的大小有一定差别。
蛋白质的相对分子质量很大,因此用测定小分子物质的相对分子质量的方法(如冰点降低,沸点升高等方法)都不适用。测定蛋白质相对分子质量的方法很多,除了根据蛋白质的化学成分来测定外,主要还是利用蛋白质的物理化学性质来测定。这些方法是渗透压法、超离心法、凝胶过滤法、聚丙烯酰胺凝胶电泳等,其中渗透压法较简单,对仪器设备要求不高,但灵敏度较差。用凝胶过滤法和聚丙烯酰胺电泳所测定的蛋白质相对分子质量也是近似值,最准确而可靠的方法是超离心法,但需要超速离心机。此法基本原理是将蛋白质溶液放在超速离心机中以60000~80000r/min的速度旋转,产生强大的离心力。由于蛋白质分子的密度大于溶液的密度,使蛋白质颗粒从溶液中沉降下来。又可用光学方法观察旋离过程中蛋白质颗粒的沉降行为,从而判断出蛋白质的沉降速度,根据沉降速度再计算出蛋白质的相对分子量。
超速离心机最初是Svedberg于1940年设计制造的。一般把单位(厘米)离心场力的沉降速度称为沉降系数,用S表示。其度量单位以秒计。1个S单位,为1×10-13s,因此,8×10-13s的沉降系数用8S表示。可用S值表示蛋白质分子的大小,S越大,蛋白质的相对分子质量越大;S越小,相对分子质量越小。蛋白质的相对分子质量可直接用沉降系数表示,也同样可用S值表示其他生物大分子的大小。
二、蛋白质的两性解离和等电点
蛋白质分子和氨基酸类似,也是一种两性电解质,具有两性离解和等电点的性质。蛋白质在溶液中被鳃离成正离子或负离子,主要受溶液的pH值的影响。
蛋白质在溶液中的带电状态主要取决于溶液的pH值。当蛋白质所带的正、负电荷数相等时,净电荷为零,此时溶液的pH值称为蛋白质的等电点,用pI表示。不同的蛋白质各具有特定的等电点。
在等电点时,因蛋白质所带净电荷为零,不存在电荷相互排斥作用,蛋白质颗粒易聚积而沉淀析出,此时蛋白质的溶解度、黏度、渗透压、膨胀性及导电能力等都最小。若蛋白质溶液的pH值小于等电点,则蛋白质主要以阳离子形式存在,在电场中向负极泳动;反之,若蛋白质溶液的pH值大于等电点,则蛋白质主要以阴离子形式存在,在电场中向正极泳动,这种现象称为电泳。不同的蛋白质其颗粒大小、形状不同,在溶液中带电荷的性质和数量也不同,因此它们在电场中泳动的速率必然不同,常利用这种性质来分离提纯蛋白质。人体内各种蛋白质的等电点不同,大多数均偏弱酸性,pI为5左右,所以在人体体液pH=7.4的环境中,体内蛋白质解离成带负电荷的负离子。
三、蛋白质的胶体性质
蛋白质分子的相对分子量大,分子颗粒的直径一般在1~100nm之间,属于胶体分散系,因此蛋白质具有胶体溶液的特性,如布朗运动、丁达尔效应以及不能透过半透膜、具有吸附性质等。当蛋白质分子在水溶液中时,暴露在分子表面的许多亲水基团(如氨基、羧基、羟基、巯基以及酰胺基等)可结合水,使水分子在其表面定向排列形成一层水化膜,将蛋白质分子互相隔开,从而使蛋白质颗粒均匀的分散在水中难以聚集沉淀。同时,蛋白质溶液在非等电点时,其分子表面总带有一定的同性电荷,同性电荷相斥而阻止蛋白质分子凝聚,相同的电荷还与其周围电荷相反的离子形成稳定的双电层,这些是蛋白质溶液作为稳定的胶体系统的主要原因。
人体的细胞膜、线粒体膜、血管壁、肾小球基底膜、腹膜等都是具有半透膜性质的生物膜,蛋白质分子有规律地分布在膜内,能使蛋白质和小分子物质分开,对维持细胞内外的水和电解质平衡具有重要的生理意义。临床上使用的腹膜透析、血液透析就是利用了蛋白质不透过半透膜的原理。
四、蛋白质的沉淀作用
维持蛋白质溶液稳定的主要因素是蛋白质分子表面的水化膜和所带的电荷,如果用物理或化学的方法破坏稳定蛋白质溶液的这两种因素,则蛋白质分子发生凝聚,并从溶液中沉淀析出,这种现象称为蛋白质的沉淀。使蛋白质发生沉淀的方法有多种,例如,在蛋白质溶液中加入适当的脱水剂去除蛋白质分子表面的水化膜,或改变蛋白质溶液的pH值达到其等电点,而使蛋白质呈等电状态,蛋白质就会相互凝聚,沉淀析出。
对于不同的蛋白质胶体溶液所采用的沉淀方法不同,有些蛋白质(如白明胶)两种稳定因素的作用都很强,只有两种因素都被消除后才会产生沉淀;有些蛋白质只有一种因素起主要作用,此时只要去除这种主要的稳定因素,蛋白质就可以发生沉淀。如酪蛋白溶液,将其pH值调至等电点时即产生沉淀,这表明酪蛋白胶体溶液的主要稳定因索是电荷的影响。沉淀蛋白质的方法有下列几种:
1.盐析法
向蛋白质溶液中加入高浓度的中性盐,而使蛋白质沉淀析出的现象称为盐析。常用的盐有硫酸铵、硫酸钠、氯化钠和硫酸镁等。盐析作用的实质是破坏蛋白质分子表面的水化膜并中和其所带的电荷,从而使蛋白质产生沉淀。不同的蛋白质其水化程度和所带电荷也不相同,因而所需的各种中性盐的浓度各异,可以利用此种特性,调节盐的浓度使不同的蛋白质分段沉淀析出,达到分离蛋白质的目的,这种蛋白质分离的方法称为分段盐析。如在血清中加入硫酸铵至浓度为2.0mol/L时,球蛋白首先析出;滤去球蛋白,再加入硫酸铵至浓度为3.3~3.5mol/L则清蛋白析出。
在低温下,短时间内应用盐析法所沉淀的蛋白质,仍保持原有的生物活性并不变性,经过透析法或凝胶色谱法除掉盐后的蛋白质又能溶于水。盐析法是一种有效的分离提纯蛋白质的方法。
2.有机溶剂沉淀蛋白质
在蛋白质溶液中加入乙醇、丙酮和甲醇等一些极性较大的有机溶剂时,由于这些有机溶剂与水的亲和力较大,能破坏蛋白质颗粒的水化膜而使蛋白质沉淀。在等电点时加人这类溶剂更易使蛋白质沉淀析出。如果操作在冰冷的条件下进行,可保持蛋白质不变性。有机溶剂沉淀蛋白质也是常用的分离蛋白质的方法之一,但使用有机溶剂时,如不注意用量,容易使蛋白质的生物活性丧失,一般常用浓度较稀的有机溶剂在低温下操作,使蛋白质沉淀析出。产生的沉淀不宜在有机溶剂中放置过久,以防止蛋白质变性而失去活性。医用消毒酒精就是利用变性的原理杀灭病菌的。
3.重金属盐沉淀蛋白质
蛋白质在pH值高于等电点的溶液中以阴离子的形式存在,当加入重金属离子,如Ag2+、Hg2+、Cu2+、Ph2+等(用M+表示)能与带负电荷的羧基阴离子结合,生成不溶性盐而沉淀。
2蛋白质化学
这些沉淀剂容易使蛋白质变性。临床上利用生蛋清和牛奶作为重金属中毒的解毒剂,就是根据这个原理。
4.生物碱试剂或酸类沉淀蛋白质
蛋白质在pH值低于等电点的溶液中以阳离子的形式存在,当加入某些生物碱试剂(如苦味酸、鞣酸、钨酸等)或某些酸类(如三氯乙酸、磺基水杨酸等)(用X表示)时,较为复杂的酸根离子能与带正电荷的蛋白质氨基结合,生成沉淀析出。
使用这类试剂往往会引起蛋白质变性,因而不适宜用于制备具有生物活性的蛋白质。在临床检验和生化实验中,常用这类试剂去除血液中有干扰的蛋白质,还可用于尿中蛋白质的检验。
五、蛋白质的变性作用
蛋白质分子在受到某些物理因素(如热、高压、紫外线及X射线照射等)或化学因素(如强酸、强碱、尿素、重金属盐及三氯乙酸等)的作用时,可改变或破坏蛋白质分子空间结构,致使蛋白质生物活性丧失以及理化性质改变,这种现象统称为蛋白质的变性。性质改变后的蛋白质称为变性蛋白。
蛋白质具有严密的立体结构,主要靠分子中的次级键和二硫键等在空间将肽链或链中的某些肽段连接在一起。在外界理化因素的作用下,这些键受到破坏,多肽链在空间的伸展从有规律的结构转变为松散紊乱的结构。变性后的蛋白质分子形状发生改变,原来包藏在分子结构内部的疏水基团大量暴露在分子表面,而原来分子表面的亲水基团则被遮掩,使蛋白质水化作用减弱,蛋白质溶解度也减小。同时,由于结构松散而使分子表面积增大,流动阻滞,黏度也增大,不对称性增加,导致失去结晶性;并且由于多肽链展开而使酶与肽键接触机会增多,因而变性蛋白质比天然蛋白质更易被酶水解消化。变性作用使蛋白质分子的空间结构遭受破坏,从而使酶、抗体、激素等失去活性。
蛋白质变性的实质是外界因素破坏了维持和稳定其空间构象的各种次级键,使其特定的空间结构发生了改变或破坏,一般并不涉及一级结构,肽键未断裂,化学组成没有改变。如果去除变性因素,有些蛋白质仍可恢复或部分恢复其原有的构象和功能,这一过程称为蛋白质的复性。大多数蛋白质变性时其空间结构破坏严重,不能恢复,称为不可逆变性,但有些蛋白质在变性后,除去变性因素仍可恢复其活性,称为可逆变性。例如,核糖核酸酶用尿素和β-巯基乙醇处理后.其分子内部的次级键被破坏.变成变性蛋白质,从而失去催化功能;然而经过透析法去除尿素和β-巯基乙醇后,分子内部的次级键能主动再形成,肽链又恢复到原来的折叠状态,酶的活性也随之恢复。
蛋白质变性后的特征为:
(1)物理性质的改变 变性后的蛋白质溶解度降低易发生沉淀,旋光值改变,黏度上升,结晶能力丧失。
(2)化学性质的改变 变性后的蛋白质易被蛋白酶水解,所以蛋白质变性后较易消化,蛋白质变性后,使原来位于分子内部的基团。如酚基、巯基等转向分子表面,从而表现或增强对某些试剂的反应。
(3)生物学性质的改变 蛋白质变性后即失去原有的生物学活性。例如酶失去其催化活性、激素失去其调节活性、细菌失去其致病性、抗体失去其生物活性。
蛋白质的变性具有重要的实际意义,如常用高温、紫外线和酒精等进行消毒,就是促使细菌或病毒的蛋白质变性而失去致病和繁殖能力。临床上急救重金属盐中毒病人,常先服用大量牛奶和蛋清,使蛋白质在消化道中与重金属盐结合成变性蛋白,从而阻止有毒重金属离子被人体吸收。同样,在制备或保存酶、疫苗、激素和抗血清等蛋白质制剂时,必须考虑选择合适的条件,防止其生物活性的降低或丧失。
六、蛋白质的颜色反应
蛋白质是一种结构复杂的高分子化合物,分子内存在许多肽键和某些带有特殊基团的氨基酸残基,因此可以与不同的试剂产生各种特有的颜色反应。这些颜色反应常用于蛋白质的定性和定量分析。
1.茚三酮反应
在pH=5~7的溶液中,蛋白质与茚三酮可产生蓝紫色反应,此反应可用于蛋白质的定量和定性。
2.双缩脲反应
蛋白质溶液中加入NaOH或KOH及少量的硫酸铜溶液,会显现从浅红色到紫红色的一系列颜色反应。这是由于蛋白质分子中肽键结构的反应,肽键越多产生的颜色越红。所谓双缩脲是指二分子尿素加热到180℃脱氨缩合的产物,此化合物也具有同样的颜色反应,蛋白质分子中含有许多和双缩脲结构相似的肽键,所以称蛋白质的这个反应为双缩脲反应。凡含两个和两个以上肽键的化合物都具有这个反应。双缩脲生成的反应为:
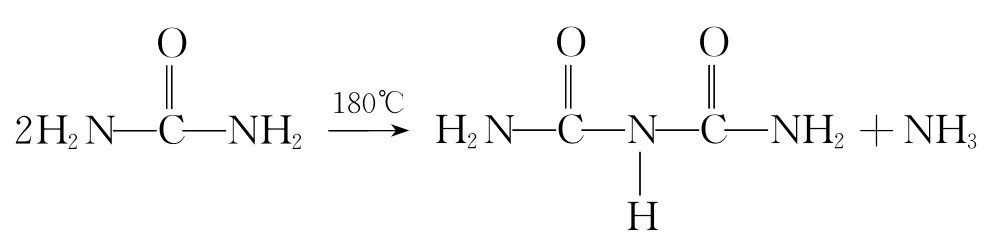
双缩脎
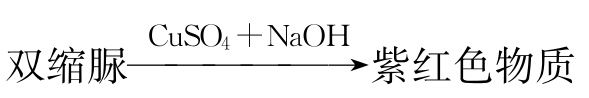
通常可用此反应来定性鉴定蛋白质,也可根据反应产生的颜色在540nm处进行比色分析,定量测定蛋白质的含量。
3.黄色反应
加浓硝酸于蛋白质溶液即有白色沉淀生成,再加热则变黄,遇碱则使颜色加深而呈橙黄,这是由于蛋白质中含有酪氨酸、苯丙氨酸及色氨酸,这些氨基酸具有苯基,而苯基与浓硝酸起硝化作用,产生黄色的硝基取代物,遇到碱又形成盐,后者呈橙黄色的缘故。皮肤接触到硝酸变成黄色,也是这个道理。
4.乙醛酸反应
蛋白质溶液中加入乙醛酸,混合后,缓慢地加入浓硫酸,硫酸沉在底部,液体分为两层,在两层界面处出现紫色环,这是蛋白质中的色氨酸与乙醛酸反应引起的颜色反应,故此法可用于检查蛋白质中是否含有色氨酸。
5.米伦反应
含有酪氨酸的蛋白质溶液,加入米伦试剂(硝酸汞、亚硝酸汞、硝酸及亚硝酸的混合液)后加热即显砖红色,此系米伦试剂与蛋白质的酪氨酸的酚基发生反应之故。
6.酚试剂(福林试剂)反应
蛋白质分子中酪氨酸的酚基在碱性条件下与酚试剂(磷钼酸磷钨酸化合物)作用,生成蓝色化合物。用比色法可用于蛋白质的定性、定量测定。该反应的灵敏度比双缩脲反应高100倍。
上述的颜色反应都是由蛋白质中氨基酸的某种特殊基团所引起的,故可用来检查蛋白质的氨基酸组成,有些非蛋白质物质也含这些特殊基团,也会出现颜色反应。为区别非蛋白质物质,可在做颜色反应后,再利用蛋白质的胶体性质,用沉淀反应加以证明,非蛋白质物质无蛋白质的沉淀反应。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。












