5.2 地下水的物理性质与化学成分
地下水的水质包括地下水的物理性质和化学成分,它们明显地受周围自然地理环境、地质条件和水文地质条件所控制。因此,在空间上和时间上皆表现出较大差异,即地下水物理性质及化学成分随空间和时间的变化而变化。
无论是利用地下水或是防治地下水的危害,都需要研究地下水的性质。例如:利用地下水作供水水源时,不同部门对水质有不同的要求;对各种工程建筑进行工程勘察评价时,需要了解水质对建筑物是否具有腐蚀性;通过对水质的了解,有助于查清地下水的分布、形成和运动规律等。
5.2.1 地下水的物理性质
地下水的物理性质通常是指地下水的温度、颜色、透明度、气味、味道等。
1)温度
地下水的温度变化主要是受气温和地温的影响,尤其是地温。
地壳按热力状态从上而下分为变温带、常温带、增温带。变温带的地温受气温的控制呈周期性的昼夜变化和年变化,随着深度的增加,变化幅度很快变小。气温的影响趋于零的深度叫常温带,常温带的地温一般略高于所在地区的年平均气温1~2℃,在概略计算时可用所在地区的年平均气温来代表常温带的温度。常温带的深度在低纬度地区为5~10m,中纬度地区在10~20m,有些地区可达30m左右。常温带以下的地温,主要受地球内部热力影响,随着深度的增加而有规律地升高,称为增温带。
由于气温和地温差异使各地区的地下水温度相差很大,在寒带和终年积雪的高山地带(冻土地区),浅层地下水的温度最低可达-5℃左右。而在新火山活动的局部地区地下水温度则很高,甚至可超过100℃。地下水按水温分类,如表5-3所示。
表5-3 地下水按水温的分类 单位:℃
![]()
2)颜色
通常地下水是无色的,但含有某些化学成分也会带有各种颜色。例如:当水中含氧化铁较高时,常呈褐红色;含亚铁较高时,常呈浅蓝绿色;含硫化氢较高时,常呈翠绿色;含腐殖质较高时,常呈淡黄色等。显然水颜色的深浅与上述化学成分有关。
3)透明度
地下水一般是无色透明的,但当地下水含有一定数量的固体颗粒、胶体成分或其他悬浮物质时,就会出现浑浊现象。通常将地下水的透明度划分为四级,即透明的、微浑浊的、浑浊的和极浑浊的。
4)味道
通常低矿化度水是淡而无味的,但当水中含某些盐分或某种气体、有机质等成分时,也会使地下水带有某种特殊味道。例如:含钠、镁的硫酸盐较高的水带有苦涩味;含氯化钠较高的水带有咸味;含二氧化碳气体较高的水具有清凉爽口的感觉;含有机质较高的水带有甜味(不宜饮用)等。
5)气味
一般地下水是无臭的,但当水中含有某种特殊气体或有机质成分时,地下水会带有某种气味。例如:含硫化氢气体的水,常带有臭鸡蛋气味;含亚铁成分较高的水,常有铁腥气味等。
6)相对密度
地下水的相对密度取决于所含化学成分的含量。纯净地下水的相对密度为1,当水中溶解的化学成分较多时,相对密度可达1.2~1.3。
综上所述,地下水的物理性质与其所含化学成分及其所存在的环境条件密切相关。实际工作中,常常通过物理性质来推断其所含化学成分和形成与存在的环境条件。
5.2.2 地下水的化学成分和主要化学性质
1)地下水的化学成分
地下水在循环和储存的过程中,不断与周围岩土发生化学作用,形成了地下水的化学成分,同时其化学成分也在不断演化。地下水与周围岩土发生的化学作用称为地下水化学成分的形成作用,这些作用包括溶滤作用、浓缩作用、脱硫酸作用、脱碳酸作用、阳离子的交替吸附作用、混合作用以及人类活动在地下水化学成分形成中的作用。因此地下水并非纯水,而是化学成分十分复杂的天然溶液,其中含有各种气体、离子、胶体物质、有机质以及微生物等。
(1)地下水中主要气体成分
地下水中的主要气体有氧气、氮气、硫化氢和二氧化碳等。一般每升水中含几毫克至几十毫克。这些气体的存在,在一定程度上,可用以指示地下水所处的水文地球化学环境。此外有些气体的含量直接影响到某些盐类的溶解度等,因而这些气体是不可忽视的。
①氧气(O2)与氮气(N2):地下水中的O2和N2主要来源于大气。它们随同大气降水及地表水补给地下水。因此,通过渗入补给的地下水,其O2和N2的含量较大。
地下水中氧的含量多,表明地下水所处的地球化学环境是氧化环境,有利于氧化反应的进行。O2的化学性质远比N2活泼,因此在较封闭的环境里,O2将被耗尽而只留下N2。因此N2的单独存在,则说明地下水处于还原环境。
②硫化氢(H2S):H2S气体通常存在于还原环境中。在封闭缺氧的条件下,当存在有机质时,由于微生物作用,SO2—4将被还原生成H2S,多见于深层地下水中。
③二氧化碳(CO2):CO2在地下水中的分布极其广泛,几乎所有中、酸性地下水均含有数量不等的CO2。地下水中CO2的来源很复杂,主要有两个来源:在地壳浅处可来自大气,也可以来自土壤中的生物化学作用;在地壳深处或火山活动地区多为碳酸盐类岩石,经高温分解作用(变质作用)生成后进入。
(2)地下水中主要的离子成分
地下水中含有数十种离子成分,其中分布最广、含量较多的离子共7种:氯离子(Cl-)、硫酸根离子(SO2-4)、重碳酸根离子(HCO—3)、钠离子(Na+)、钾离子(K+)、钙离子(Ca2+)及镁离子(Mg2+)。这些离子之所以在地下水中占主要成分,其原因是O2、Ca、Mg、Na、K等元素在地壳中的含量高,且较易溶于水,有些元素如Cl-与以SO2-4形式出现的S虽然在地壳中含量并不高,但极易溶于水。而其他元素如Si、Al、Fe等,虽然在地壳中含量很大,但由于其难溶于水,因而地下水中含量通常不大。
一般情况下,随着总矿化度(总溶解固体)的变化,地下水中占主要地位的离子成分也随之发生变化。低矿化水中常以HCO-3及Ca2+、Mg2+为主;高矿化水则以Cl-及Na+为主;中等矿化的地下水中,阴离子常以SO2—4为主,阳离子以Na+或Ca2+为主。形成此规律的主要原因在于水中盐类的溶解度不同(见表5-4)。
表5-4 地下水中常见盐类的溶解度(0℃)单位:g/L
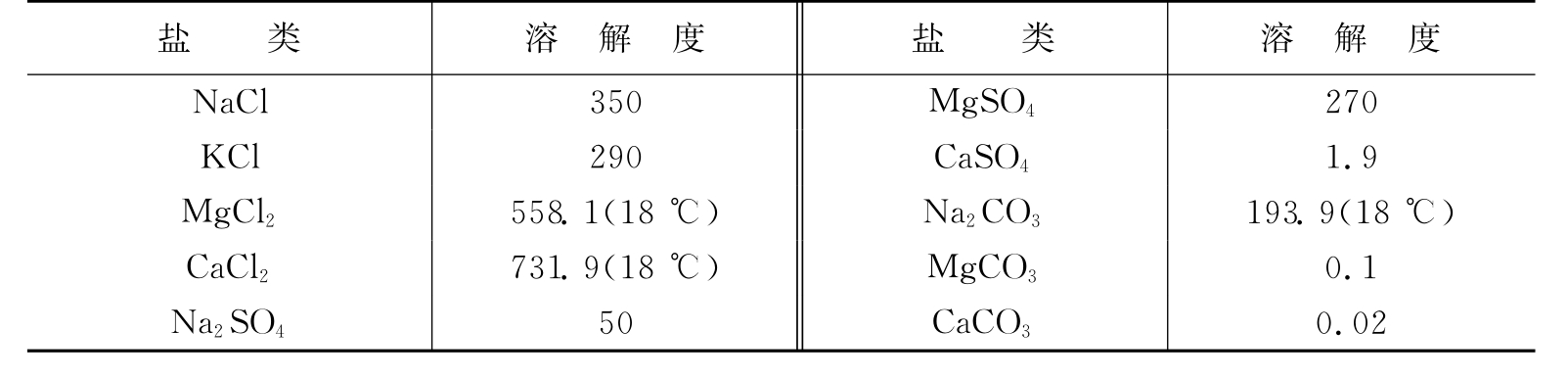
由表5-4可知,氯盐的溶解度最大,其次是硫酸盐,碳酸盐较小。钙的硫酸盐、钙和镁的碳酸盐溶解度最小。当水的矿化度由小变大时,钙、镁的碳酸盐极易达到饱和而从水中析出,继续增大时,钙的硫酸盐也饱和析出。因此,高矿化水中只有氯离子和钠离子占优势。
①氯离子(Cl—):氯离子(Cl—)在地下水中普遍存在,且含量一般较高。地下水中Cl—主要来源于沉积岩中盐岩或其他氯化物的溶解、岩浆岩中含氯矿物的风化溶解、沿海地区海水的渗入等。此外,人为的污染(工业废水和生活污水)也会使污染区地下水Cl—含量增高。由于Cl—不能被植物及细菌摄取,不能被土粒表面吸附,以及氯盐溶解度大,不易沉淀析出等缘故,因而是地下水中最稳定的离子。
②硫酸根离子(SO2—4):在高矿化水中SO2—4的含量仅次于Cl—,每升可达数克,个别每升可高达数十克;低矿化水中每升为数毫克至数百毫克。地下水中SO2—4主要来源于石膏或其他含硫酸盐的沉积岩的溶解。其次来自天然硫或硫化物。另外,人为污染也会使污染区地下水SO2—4含量增高。在城镇中烧煤使大气中增加大量SO2,形成腐蚀性很强的“酸雨”,补给地下水后也会使地下水中SO2—4明显增加。由于CaSO4的溶解度较小,限制了SO2—4在水中的含量,所以,地下水中的SO2—4远不及Cl—稳定。
③重碳酸根离子(HCO—3):重碳酸根离子(HCO—3)也是地下水中广泛分布的离子,含量一般不超过1g/L,通常在低矿化水中占据阴离子首位。地下水中HCO—3的来源,首先是含碳酸盐的沉积岩与变质岩(如大理岩)的水解,其次是岩浆岩与变质岩地区铝硅酸盐矿物的风化溶解。
由于CaCO3和MgCO3是难溶于水的,仅当水中有CO2存在时,才会有一定数量溶解于水,水中HCO3—的含量取决于与CO2含量的平衡关系。
④钠离子(Na+):钠离子(Na+)是地下水中居主要地位的阳离子。通常,在低矿化水中Na+的含量很低,一般每升仅数毫克至数十毫克;高矿化水中,每升可以达到数十克,甚至到百克。其来源与Cl—相同,也有的来自于铝硅酸盐矿物的风化溶解。
⑤钾离子(K+):钾离子(K+)在地下水中的含量比Na+低得多,其原因是K+易形成难溶于水的水云母、蒙脱石等次生矿物,另外其可被植物吸收,也常被黏土颗粒吸附。K+的来源和分布基本上与Na+相近。
⑥钙离子(Ca2+):钙离子(Ca2+)是低矿化地下水中的主要阳离子,一般含量每升不超过数百毫克。在高矿化水中,由于阴离子主要是Cl—,而CaCl2的溶解度相当大,故Ca2+的绝对含量显著增大,但通常仍远低于Na+。Ca2+的来源与HCO—3和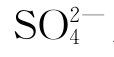 来源相同。
来源相同。
⑦镁离子(Mg2+):镁离子(Mg2+)在低矿化地下水中含量通常比Ca2+少,并不是地下水中的主要离子成分,部分原因是由于地壳组成中Mg比Ca少,而且也易于被植物吸收。镁离子(Mg2+)的来源及其在地下水中的分布与Ca2+相近,来源于含镁的碳酸盐类沉积岩。此外,还来自岩浆岩、变质岩中含镁矿物的风化溶解。
(3)地下水中的其他成分
①次要离子:地下水的次要离子包括H+、Fe2+、Fe3+、Mn2+、OH—等。
②微量成分:地下水含有一定的微量组分,如Br、I、Sr等。
③胶体成分:地下水中以未离解的化合物构成其胶体成分,主要有Fe(OH)3、Al(OH)3及H2SiO3等,有时可占到相当比例。
④有机成分与微生物:地下水的有机成分主要由生物遗体分解产生,常以胶体形式存在。有机质的存在,可使地下水酸度增加。
另外,地下水中还存在各种微生物。如,在氧化环境中存在硫细菌、铁细菌等,在还原环境中存在脱硫酸细菌等。此外,在污染水中,还有各种致病细菌。
2)地下水的主要化学性质
地下水的化学成分及其组合关系,决定了地下水具有一定的化学性质,其中主要是酸碱度、硬度、矿化度、腐蚀性等。地下水的化学成分是通过对水进行化学分析测定的,一般称为水质分析,水质分析可分为简分析、全分析和专项分析。地下水的化学成分与其化学分类、水质评价等均有十分密切的关系。
(1)地下水的酸碱度
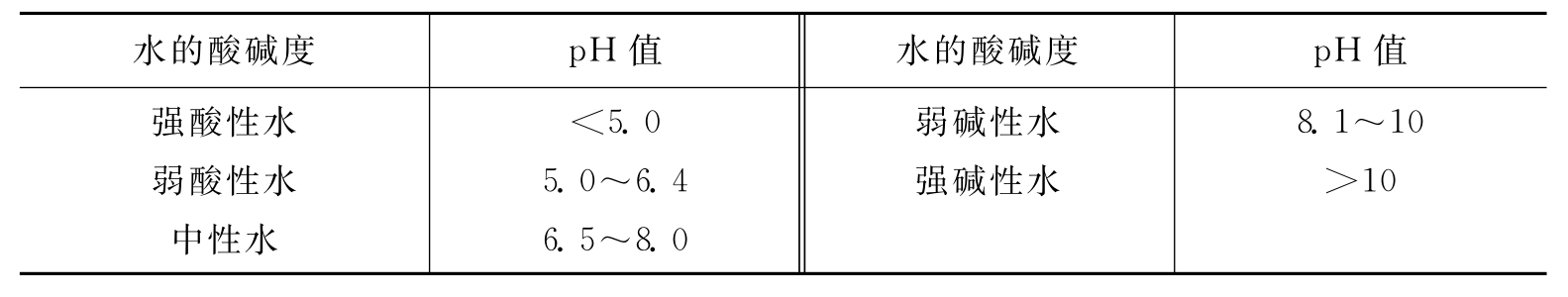
地下水的酸碱度指的是水中氢离子(H+)的浓度,以pH值表示。多用pH仪测定。自然界中地下水的pH值一般在6.5~8.0之间,其中酸性地下水对金属和混凝土有腐蚀性。地下水按pH值分类,如表5-5所示。
表5-5 地下水按pH值分类
(2)地下水的硬度
地下水的硬度是指水中Ca2+、Mg2+的含量。硬度可进一步区分为总硬度、暂时硬度和永久硬度。水中所含Ca2+、Mg2+的总量是总硬度;总硬度包括暂时硬度与永久硬度。其中若把水加热至沸腾,将导致部分碳酸盐沉淀,水中由此失去的那部分Ca2+、Mg2+称为暂时硬度;水沸腾后仍留在水中的Ca2+、Mg2+含量称为永久硬度。
硬度的表示方法很多,我国目前常用方法有两种:一种为德国度(H°),一个德国度相当于每升水中含有10mgCaO的量;另一种为每升水中Ca2+和Mg2+的毫克当量(meq)数,1meq/L=2.8H°。地下水按硬度分类见表5-6。
表5-6 地下水按硬度的分类

水的硬度是评价生活用水和工业用水水质是否合乎标准的一项重要指标。许多工业用水不宜硬度过大,同时生活用水的硬度也有一定要求。
(3)地下水的矿化度
地下水中所含离子、分子、化合物的总量(气体成分除外)称为地下水的矿化度,它表示地下水中含可溶盐的多少,一般以g/L为单位。确定地下水矿化度一般采用以下两种方法。
①将一定体积的地下水置于105~110℃条件下蒸干,水中矿物质因沉淀而残留下来,称量干涸残余物,将其折算为每升水的含量,通常以此量表示地下水矿化度。
②在没有干涸残余物时,也可利用阴、阳离子和其他化合物含量之总和概略表示矿化度。但应注意,在蒸干时有将近一半的重碳酸根离子分解生成CO2及H2O而逸失。所以相加时,HCO—3只取重量的半数。
按地下水矿化度的大小,将地下水进行分类如表5-7所示。
表5-7 地下水按矿化度的分类 单位:g/L

矿化度低的淡水可作生活用水、工业用水与农业用水,而盐水、卤水常用来作提炼某些盐类的原料。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。














