第四章 免疫分子
学 习 目 标
1.抗体和免疫球蛋白有何不同?
2.抗体有哪些功能?
3.为什么IgM对细胞性抗原的凝集作用大于IgG?
4.试比较补体激活途径的异同。
5.举例说明补体和疾病的关系。
6.细胞因子的分类及生物学作用有哪些?
7.细胞因子有哪些临床应用?
8.HLA分子有何生物学作用?
9.HLA与临床医学有什么关系?
免疫分子是指参与免疫应答的蛋白质分子,它包括:分泌型蛋白质分子,如抗体、补体、细胞因子等;细胞膜上的蛋白质分子,如主要组织相容性抗原等。
第一节 抗体与免疫球蛋白
一、免疫球蛋白与抗体的概念
抗体(antibody,Ab)是机体B细胞在抗原刺激下增殖分化成浆细胞产生的,并能和相应抗原发生特异性结合的球蛋白。每一种浆细胞克隆可以产生一种特异的抗体分子,其分布于体液(血液、淋巴液、组织液及黏膜的外分泌液)中,主要存在于血清内。
多发性骨髓瘤是由浆细胞无限增殖形成的细胞克隆,其合成和分泌的蛋白质分子和抗体的化学结构是一样的,但没有抗体活性。1964年世界卫生组织召开会议,将具有抗体活性及化学结构与抗体相似的球蛋白统称为免疫球蛋白(immunoglobulin,Ig)。免疫球蛋白除分布于体液中外,还可存在于B细胞膜上。
二、免疫球蛋白分子的结构与水解片段
(一)免疫球蛋白分子的基本结构
Ig分子的基本结构是由两条相同的长链和两条相同的短链通过二硫键连接在一起的单体分子(见图4-1)。Ig单体中四条肽链两端游离的氨基或羧基的方向是一致的,分别命名为氨基端(N端)和羧基端(C端)。

图4-1 免疫球蛋白分子的基本结构及功能区示意图
1.轻链和重链
(1)轻链(light chain,L链) Ig的两条短链称轻链,大约由214个氨基酸残基组成,通常不含碳水化合物,分子量约为24 k。每条轻链含有2个链内二硫键所组成的环肽。L链共有两型:kappa(κ)与lambda(λ),同一个天然Ig分子上L链的型总是相同的。正常人血清中的κ∶λ约为2∶1。
(2)重链(heavy chain,H链) Ig的两条长链称重链,含450~550个氨基酸残基,分子量约为55 k或75 k。每条H链含有4~5个链内二硫键所组成的环肽。不同的H链由于氨基酸组成的排列顺序、二硫键的数目和位置、含的种类和数量不同,可将其分为5类:γ链、μ链、α链、δ链和ε链,不同H链与L链(κ或λ链)组成完整Ig的分子分别称之为IgG、IgM、IgA、IgD和IgE。γ、α和δ链上含有4个环肽,μ和ε链含有5个环肽。
2.可变区和恒定区
(1)可变区(variable region,V区)位于L链靠近N端的1/2(约含108~111个氨基酸残基)和H链靠近N端的1/5或1/4区域(约含118个氨基酸残基)。每个V区中均有一个由链内二硫键连接形成的肽环,每个肽环约含67~75个氨基酸残基。V区氨基酸的组成和排列随抗体结合抗原的特异性不同有较大的变异。由于V区中氨基酸的排列顺序千变万化,故可形成许多种具有不同结合抗原特异性的抗体。
L链和H链的V区分别称为VL和VH。在VL和VH中有三个部位的氨基酸组成和排列顺序具有更高的变易程度,这些区域称为高变区(hypervariable region,HVR),分别称为HVR1、HVR2和HVR3。经X线结晶衍射的研究分析证明,高变区确实为抗体与抗原结合的位置,因而称为决定簇互补区(complementarity-determining region,CDR)。VL和VH的HVR1、HVR2和HVR3又可分别称为CDR1、CDR2和CDR3。在V区中非HVR部位的氨基酸组成和排列相对比较保守,称为骨架区。高变区也是Ig分子独特型决定簇主要存在的部位。在大多数情况下H链在与抗原结合中起更重要的作用。

图4-2 与表位结合高变区示意图(G表示相对保守的甘氨酸)
(2)恒定区(constant region,C区) 位于L链靠近C端的1/2(约含105个氨基酸残基)和H链靠近C端的3/4区域或4/5区域(约从119位氨基酸至C末端)。H链每个功能区约含110多个氨基酸残基,含有一个由二锍键连接的50~60个氨基酸残基组成的肽环。这个区域氨基酸的组成和排列在同一种属动物Ig同型L链和同一类H链中都比较恒定,如人抗白喉外毒素IgG与人抗破伤风外毒素的抗毒素IgG,它们的V区不相同,只能与相应的抗原发生特异性的结合,但其C区的结构是相同的,即具有相同的抗原性,应用马抗人IgG第二抗体(或称抗抗体)均能与这两种抗不同外毒素的抗体(IgG)发生结合反应。这是制备第二抗体,应用荧光、酶、同位素等标记抗体的重要基础。
3.功能区 Ig分子的H链与L链可通过链内二硫键折叠成若干球形功能区,每一功能区约由110个氨基酸组成。在功能区中氨基酸序列有高度同源性。
(1)L链功能区 分为L链可变区(VL)和L链恒定区(CL)两功能区。
(2)H链功能区 IgG、IgA和IgD的H链各有一个可变区(VH)和三个恒定区(CH1、CH2和CH3),共四个功能区。IgM和IgE的H链各有一个可变区(VH)和四个恒定区(CH1、CH2、CH3和CH4)共五个功能区。
(3)功能区的作用
1)VL和VH是与抗原结合的部位,其中HVR(CDR)是V区中与抗原决定簇(或表位)互补结合的部位。
2)CL和CH上具有部分同种异型的遗传标记。
3)CH2:IgG CH2具有补体结合位点,能活化补体。母体IgG借助CH2部分可通过胎盘主动传递到胎体内。
4)CH3:IgG CH3具有结合单核细胞、巨噬细胞、粒细胞、B细胞和NK细胞Fc段受体的功能。IgM CH3(或CH3因部分CH4)具有补体结合位点。IgE的CH2和CH3功能区与结合肥大细胞和嗜碱性粒细胞Fc段受体有关。
(4)铰链区 铰链区不是一个独立的功能区,位于CH1和CH2之间。该区包括H链间二硫键,富含脯氨酸,易发生伸展及一定程度的转动。当VL、VH与抗原结合时此部位发生扭曲,使抗体分子上两个抗原结合点更好地与两个抗原决定簇发生互补。铰链区对木瓜蛋白酶、胃蛋白酶敏感,当用这些蛋白酶水解免疫球蛋白分子时此区发生裂解。IgM 和IgE缺乏铰链区。
4.J链和分泌成分
(1)J链(joining chain) 存在于二聚体分泌型IgA(图4-3)和五聚体IgM(图4-4)中。J链分子量约为15 k,由124个氨基酸组成,是由浆细胞合成的多肽链。

图4-3 分泌型IgA结构示意图

图4-4 IgM结构示意图
(2)分泌成分(secretory component,SC) 又称分泌片(secretory piece),是分泌型IgA上的一个辅助成分,分子量约为75 k,是上皮细胞合成的糖蛋白,以共价形式结合到Ig分子,并一起被分泌到黏膜表面(图4-5)。SC的存在对于抵抗外分泌液中蛋白水解酶的降解具有重要作用。

图4-5 SIgA的合成与分泌示意图
(二)免疫球蛋白的酶解片段
1.木瓜蛋白酶的水解片段(图4-6)最早用木瓜蛋白酶水解兔IgG,从而划区获知了Ig四肽链的基本结构和功能。
(1)裂解部位 IgG铰链区H链链间二硫键近N端侧切断。
(2)裂解片段 共裂解为三个片段:①两个Fab段(抗原结合段),每个Fab段由一条完整的L链和一条约为1/2的H链组成,一个完整的Fab段可与抗原结合,表现为单价,但不能形成凝集或沉淀反应;②一个Fc段(可结晶段),由连接H链二硫键和近羧基端两条约1/2的H链所组成,Ig在异种间免疫所具有的抗原性主要存在于Fc段。
2.胃蛋白酶的水解片段 最早用胃蛋白酶裂解免疫球蛋白。
(1)裂解部位 铰链区H链链间二硫键近C端切断。
(2)裂解片段 ①F(ab’)2包括一对完整的L链和由链间二硫键相连的一对略大于Fab的H链,F(ab’)2具有双价抗体活性,与抗原结合可发生凝集和沉淀反应。双价的F (ab’)2与抗原结合的亲合力要大于单价的Fab。由于应用F(ab’)2时保持了结合相应抗原的生物学活性,又减少或避免了Fc段抗原性可能引起的副作用,因而在生物制品中有较大的实际应用价值。②Fc’可继续被胃蛋白酶水解成更小的片段,失去其生物学活性。

图4-6 Ig酶水解片段示意图
(二)免疫球蛋白分子的功能
1.特异性结合抗原 Ig的这种特异性结合抗原特性是由其V区(尤其是V区中的高变区)的空间构成所决定的。Ig的抗原结合点由L链和H链超变区组成,与相应抗原上的表位互补,借助静电力、氢键以及范德华力等次级键相结合,这种结合是可逆的,并受到pH、温度和电解质浓度的影响。
抗体分子可有单体、双体和五聚体,因此结合抗原决定簇的数目(结合价)也不相同。单体Ig(如IgG、IgD、IgE)为双价。双体分泌型IgA有4价。五聚体IgM理论上应为10价,但实际上由于立体构型的空间位阻,一般只有5个结合点可结合抗原。
2.活化补体
(1)IgM、IgG与相应抗原结合后,IgG的CH2和IgM的CH3暴露出补体结合点,开始活化补体。
(2)凝聚的IgA、IgG4和IgE等可通过替代途径活化补体。
3.结合Fc受体 不同细胞表面具有不同Ig的Fc受体,分别用FcγR、FcεR、FcαR等来表示。当Ig与相应抗原结合后,由于构型的改变,其Fc段可与具有相应受体的细胞结合。IgE抗体由于其Fc段结构特点,可在游离情况下与有相应受体的细胞(如嗜碱性粒细胞、肥大细胞)结合,称为亲细胞抗体。抗体与Fc受体结合可发挥不同的生物学作用。
(1)调理吞噬作用(图4-7)调理作用是指抗体、补体C3b、C4b等调理素促进吞噬细胞(中性粒细胞、单核细胞和巨噬细胞等)吞噬颗粒性抗原。

图4-7 抗体的调理吞噬作用
(2)发挥抗体依赖的细胞介导的细胞毒作用(图4-8)当IgG抗体与带有相应抗原的靶细胞结合后,可与有FcγR的中性粒细胞、单核细胞、巨噬细胞、NK细胞等效应细胞结合,发挥抗体依赖的细胞介导的细胞毒ADCC作用(antibody dependent cell-mediated cytotoxicity)。

图4-8 抗体依赖的细胞介导的细胞毒作用(ADCC)
此外,人IgGFc段能非特异地与葡萄球菌A蛋白(SPA)结合,应用SPA可纯化IgG等抗体,或代替第二抗体用于标记技术。
(3)介导I型变态反应 变应原与通过Fc段固定在嗜碱性粒细胞、肥大细胞膜上的IgE结合,刺激细胞脱颗粒,引起Ⅰ型变态反应。
4.通过胎盘 在人类,IgG是唯一可通过胎盘从母体转移给胎儿的Ig。IgG能选择性地与胎盘母体一侧的滋养层细胞结合,转移到滋养层细胞的吞饮泡内,并主动外排到胎儿血循环中。IgG的这种功能与IgGFc片段结构有关,如切除Fc段后所剩余的Fab并不能通过胎盘。IgG通过胎盘的作用是一种重要的自然被动免疫,对于新生儿抗感染有重要作用。
三、各类免疫球蛋白的生物学活性
不同Ig其合成部位、合成时间、血清含量、分布、半衰期以及生物学活性有所差别。
(一)IgG
IgG主要由脾、淋巴结中的浆细胞合成和分泌,以单体形式存在。在个体发育过程中机体合成IgG的年龄要晚于IgM,在出生后第3个月开始合成,3~5岁接近成年人水平。IgG是血清中主要的抗体成分,约占血清总Ig的75%。IgG的半衰期相对较长,约为20~30 d。IgG可通过经典途径活化补体。IgG是唯一能通过胎盘的Ig,在自然被动免疫中起重要作用。此外IgG还具有调理吞噬、ADCC和结合SPA等作用。由于IgG的上述特点,IgG在机体免疫防护中起着主要的作用,大多数抗菌、抗病毒、抗毒素抗体都属于IgG类抗体。应用对麻疹、甲型肝炎等有免疫力的产妇或正常人丙种或胎盘球蛋白可进行人工被动免疫,能有效地预防相应的传染性疾病。不少自身抗体如抗甲状腺球蛋白抗体、系统性红斑狼疮的LE因子(抗核抗体)以及引起Ⅲ型变态反应免疫复合物中的抗体大都也属于IgG。
(二)IgA
IgA主要由黏膜相关淋巴样组织产生,其中大部分是由胃肠淋巴样组织所合成,少部分由呼吸道、唾液腺和生殖道黏膜组织合成。哺乳期产妇腺组织含有大量IgA产生细胞,这些细胞主要来自胃肠。在人类,还有少量的IgA来自骨髓。人出生后4~6月开始合成IgA,4~12岁血清中含量达成人水平,血清型IgA占总Ig的10%左右,半衰期约5~6 d。血清中的IgA除单体形式外还有由J链共价相连的二聚体或三聚体等形式。分泌型IgA (SIgA)是由J链连接的双体和分泌成分所组成,主要存在于初乳、唾液、泪液、胃肠液、支气管分泌等外分泌液中,是黏膜局部免疫的最重要因素,SIgA通过与相应的病原微生物(如脊髓灰质炎病毒)结合,阻抑其吸附到易感细胞上,SIgA还可中和毒素如霍乱弧菌毒素和大肠杆菌毒素等。新生儿易患呼吸道、胃肠道感染可能与IgA合成不足有关。慢性支气管炎发作与SIgA的减少也有一定关系。产妇可通过初乳将SIgA传递给婴儿,这也是一种重要的自然被动免疫。嗜酸性粒细胞、中性粒细胞和巨噬细胞表达FcαR,血清型单体IgA可介导调理吞噬和ADCC作用。此外,SIgA具有免疫排除功能,即SIgA结合饮食中大量的可溶性抗原以及肠道正常菌群或病原微生物所释放的热原物质,防止它们进入血液。
(三)IgM
血清中IgM是由5个单体通过一个J链和二硫键连接成五聚体,分子量最大,称为巨球蛋白。在分子结构上IgM无铰链区,在生物进化过程中IgM是最早出现的免疫球蛋白,在个体发育过程中,无论是B细胞膜表面Ig(Sm Ig),还是合成分泌到血清中的Ig,IgM都是最早出现的Ig,在胚胎发育晚期的胎儿即有能力产生IgM。在抗原刺激诱导体液免疫应答过程中,一般IgM也最先产生。IgM占血清总Ig的5%~10%。由于IgM在免疫应答早期产生,并在补体参与下的溶血作用比IgG强500倍以上,而且活化补体后通过C3b、C4b等片段发挥调理作用,因此IgM在机体的早期免疫防护中占有重要地位。天然的血型抗体(凝集素)为IgM。IgM不能过胎盘,脐血中如出现针对某种病原微生物的IgM,表示胚胎期有相应病原微生物如梅毒螺旋体、风疹或巨细胞病毒等感染,称为胚胎感染或垂直感染。
膜表面IgM是B细胞识别抗原受体中一种主要的Sm Ig。成熟B细胞有Sm IgD,在正常人B细胞库中Sm IgM+ B细胞约占80%。
(四)IgD
IgD于1995年从人骨髓瘤蛋白中发现,分子量为175 k,主要由扁桃体、脾等处浆细胞产生,不到血清总Ig的1%,在个体发育中合成较晚。IgD铰链区很长,且对蛋白酶水解敏感,因此IgD半衰期很短,仅2.8 d。血清中IgD确切的免疫功能尚不清楚。在B细胞分化过程中,成熟B细胞同时表达Sm lgM和Sm IgD,对抗原的刺激出现正应答;不成熟的B细胞只表达Sm IgM,抗原刺激后表现为免疫耐受。成熟B细胞活化后,或者变成记忆B细胞时,Sm IgD逐渐消失。所以,IgD是成熟B细胞的标志。
(五)IgE
IgE分子量为188 k,血清中含量极低,仅占血清总Ig的0.002%,在个体发育中合成较晚。IgE主要由鼻咽部、扁桃体、支气管、胃肠等黏膜固有层的浆细胞产生,这些部位常是变应原入侵和I型变态反应发生的场所。IgE为亲细胞抗体,CH2和CH3功能区可与嗜碱性粒细胞、肥大细胞膜上高亲和力FcεRⅠ结合。变应原再次进入机体与已固定在嗜碱性粒细胞、肥大细胞上的IgE结合,可引起Ⅰ型变态反应。寄生虫感染或过敏反应发作时,局部的外分泌液和血清中IgE水平都明显升高。
四、单克隆抗体
(一)多克隆抗体
一种天然抗原性物质(如细菌或其分泌的外毒素以及各种组织成分等)往往具有多种不同的抗原决定簇,而每一种决定簇都可刺激机体一种抗体形成细胞产生一种特异性抗体。
早期传统的抗体制备方法是将一种天然抗原经各种途径免疫动物,由于抗原性物质具有多种抗原决定簇,可刺激产生多种抗体形成细胞克隆,故在其血清中实际上是含多种抗体的混合物,称这种用体内免疫法所获得的免疫血清为多克隆抗体,也是第一代抗体。由于这种抗体是不均一的,无论是对抗体分子结构与功能的研究或是临床应用都受到很大限制。
(二)单克隆抗体
单克隆抗体(monoclonal antibody,McAb)是由识别一种抗原决定簇的细胞克隆所产生的均一性抗体。如能将所需要的抗体形成细胞选出并能在体外进行培养即可获得已知特异的单克隆抗体。
单克隆抗体的制备采用杂交瘤技术,即把将小鼠骨髓瘤细胞和经绵羊红细胞(SRBC)免疫的小鼠脾细胞在体外进行两种细胞融合,结果发现部分形成的杂交细胞既能继续在体外培养条件下生长繁殖又能分泌抗SRBC抗体,称这种杂交细胞系为杂交瘤。这种杂交瘤细胞既具有骨髓瘤细胞能大量无限生长繁殖的特性,又具有抗体形成细胞合成和分泌抗体的能力。应用杂交瘤技术可获得几乎所有抗原的单克隆抗体,只要这种抗原能引起小鼠的抗体应答。
这种用杂交瘤技术制备的单克隆抗体可视为第二代抗体。
单克隆抗体由于纯度高、特异性强,可以提高各种血清学方法检测抗原的敏感性及特异性,但单克隆抗体多为双价抗体,与抗原结合不易交联为大分子集团,故不易出现沉淀反应。单克隆抗体的应用大大促进了对各种传染病和恶性肿瘤诊断的准确性。
单克隆抗体亦可与核素、各种毒素(如白喉外毒素或篦麻毒素)或药物通过化学偶联或基因重组制备成导向药物用于肿瘤的治疗,是一种新型免疫治疗方法,有可能提高对肿瘤的疗效。
单克隆抗体亦可用于对各种免疫细胞及其他组织细胞表面分子的检测,这对免疫细胞的分离、鉴定及分类及研究各种膜表面分子的结构与功能都具有重要意义。
第二节 补体系统
在血液或体液内除Ig分子外,还发现另一族参与免疫效应的大分子,称为补体分子。早在19世纪末,发现在新鲜免疫血清内加入相应细菌,无论进行体内或体外实验,均证明可以将细菌溶解,将这种现象称之为免疫溶菌现象。如将免疫血清加热56℃30 min则可丧失溶菌能力。进一步证明免疫血清中含有二种物质与溶菌现象有关,即对热稳定的组分——抗体,还有对热不稳定的组分——补体(complement,C)。
一、补体系统的组成和理化性质
(一)补体分子的组分和命名
补体是存在于正常人及动物血清中的一组经活化后具有酶活性的蛋白质。目前已知补体是由30余种可溶性蛋白、膜结合蛋白和补体受体组成的多分子系统,故称为补体系统。
根据功能,可将补体的30余种成分分为三类。即:①补体的固有成分,指存在于体液中、参与补体激活级联反应的补体分子,包括经典激活途径的C1、C4、C2;旁路激活途径的B因子、D因子;上述两条途径的共同末端通路的C3、C5、C6、C7、C8和C9;②补体调节蛋白,包括备解素(P因子)、C1抑制物、I因子、C4结合蛋白、H因子、S蛋白、促衰变因子等;③介导补体活性片段或调节蛋白生物学效应的补体受体(CR),包括CR1~CR5、 C3aR、C2aR、C4aR等。
补体系统的命名方法为:①参与补体经典激活途径的固有成分,按其被发现的先后顺序分别命名为C1(C1q、C1r、C1s)C2……C9;②补体其他成分以英文大写字母表示,如B因子、D因子、P因子、H因子;③补体调节蛋白多以其功能命名,如C1抑制物、C4结合蛋白、促衰变因子等;④补体活化后的裂解片段,以该成分的符号后面附加小写英文字母表示,如C3a、C3b等,a为小片段,b为大片段;⑤具有酶活性的成分或复合物,在其符号上划一横线表示,如 ;⑥灭活的补体成分,在其符号前加i表示,如iC3b。
;⑥灭活的补体成分,在其符号前加i表示,如iC3b。
(二)补体的理化性质
补体分子是分别由肝细胞、巨噬细胞以及肠黏膜上皮细胞等多种细胞产生的,半衰期约1 d。全部补体分子的化学组成均为多糖蛋白,大多数补体成分属β球蛋白,少数属α球蛋白及γ球蛋白。血清中补体蛋白约占总球蛋白的10%,其中含量最高的为C3。补体性质不稳定,56℃30 min即失去活性,故临床检测补体时要用新鲜的血清。人类某些疾病其总补体含量或单一成分含量可发生变化,因而对体液中补体水平的测定,或组织内补体定位观察,对一些疾病的诊断具有一定意义。
二、补体系统的激活
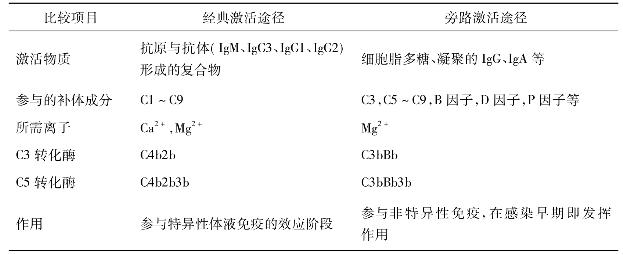
补体系统各成分通常多以非活性状态存在于血浆之中,当其被激活物质活化之后,才表现出各种生物学活性。补体系统的激活可以从C1开始;也可以越过C1、C2、C4,从C3开始。前一种激活途径称为经典途径或传统途径,后一种称旁路途径或替代途径。“经典”、“传统”只是意味着人们早年发现补体系统是从C1开始激活的连锁反应。从种系发生角度而言,旁路途径是更为古老的、原始的激活途径。
(一)经典激活途径
能激活补体经典途径的激活物,主要是抗原与IgG、IgM抗体形成的免疫复合物,参与补体经典激活途径的成分包括C1~C9。按其在激活过程中的作用,人为地分成三组,即识别单位(Clq、Clr、Cls)、活化单位(C4、C2、C3)和膜攻击单位(C5~C9),分别在激活的不同阶段即识别阶段、活化阶段和膜攻击阶段中发挥作用。
1.识别阶段 C1与抗原抗体复合物中免疫球蛋白的补体结合点相结合至C1酯酶形成的阶段。
C1是由三个单位C1q、C1r和C1s依赖Ca2+结合成的牢固的非活性大分子。
C1q分子有6个能与免疫球蛋白分子Fc段上的补体结合点相结合的部位。当两个以上的结合部位与免疫球蛋白分子结合时,即C1q桥联免疫球蛋白之后,其构型发生改变,导致C1r和C1s相继活化,才能激活后续的补体各成分(图4-9),IgG为单体,激活C1需2个IgG。IgM为五聚体,激活补体的能力大于IgG。
在经典途径中,一旦形成C1s,即完成识别阶段,并进入活化阶段。
2.活化阶段 C1作用于后续的补体成分,至形成C3转化酶(C4b2b)和C5转化酶(C4b2b3b)的阶段(图4-10)。
C1s作用于C4,所产生的小片段C4a释放入液相,大片段的C4b可与胞膜或抗原-抗体复合物结合。在Mg2+存在的情况下,C2可与附着有C4b的细胞表面结合,继而被C1s裂解,所产生的小片段C2a被释放入液相,而大片段C2b可与C4b形成复合物,后者即经典途径C3转化酶。可水解C3,所产生的小片段C3a释放入液相,大片段为C3b。大部分C3b与水分子作用,不再参与补体级联反应,10%左右的C3b分子可与细胞表面的C4b2b相结合产生C4b2b3b,后者即是经典途径的C5转化酶,至此完成活化阶段。
3.膜攻击阶段 C5转化酶裂解C5后,继而作用于后续的其他补体成分,最终导致细胞受损、细胞裂解的阶段。

图4-9 C1q示意图

图4-10 经典途径的激活
C5转化酶裂解C5产生出C5a和C5b两个片段。C5a游离于液相中,C5b可吸附于邻近的细胞表面,但其活性极不稳定,易于衰变成C5bi。C5b虽不稳定,但当其与C6结合成C5b6复合物则较为稳定,然而此C5b6并无活性。C5b6与C7结合成三分子的复合物C5b67时较稳定,不易从细胞膜上解离,C5b67即可吸附于已致敏的细胞膜上,其也可以吸附在邻近的、未经致敏的细胞膜上(即未结合有抗体的细胞膜上)。C5b67是使细胞膜受损伤的一个关键组分。它与细胞膜结合后,即插入膜的磷脂双层结构中。其分子排列方式有利于吸附C8形成C5b678。其中C8是C9的结合部位,因此继续形成C5b6789,即补体的膜攻击单位,可使细胞膜穿孔受损。
(二)旁路激活途径
旁路激活途径与经典激活途径不同之处在于激活是越过了C1、C4、C2三种成分,直接激活C3继而完成C5至C9各成分的连锁反应,激活物质是细菌的细胞壁成分—脂多糖,以及多糖、肽聚糖、磷壁酸和凝聚的IgA和IgG4等物质。旁路激活途径在细菌性感染早期,尚未产生特异性抗体时,即可发挥重要的抗感染作用。
1.旁路途径的激活 在正常生理情况下,血浆中的C3可自然地、缓慢地裂解,持续产生少量的C3b,液相中缓慢产生的C3b在Mg2+存在下,可与B因子结合形成C3bB。体液中的D因子作用于C3bB,可使此复合物中的B因子裂解,形成C3bBb和Ba游离于液相中。C3bBb可使C3裂解为C3a 和C3b,C3bBb的半衰期甚短,当其与P因子结合成为C3bBbP时,半衰期可延长。这样可以获得更为稳定的、活性更强的C3转化酶。C3bBb与其裂解C3所产生的C3b可进一步形成多分子复合物C3bBb3b。C3bBb3b像经典途径中的C5转化酶C4b2b3b一样,也可使C5裂解成C5a和C5b。后续的C6~C9各成分与其相互作用的情况与经典途经相同。对同一个体而言,在尚未形成获得性免疫,即未产生抗体之前,经旁路途径激活补体,即可直接作用于入侵的微生物等异物,作为非特异性免疫而发挥效应。
2.激活效应的扩大C3在两条激活途径中都占据着重要的地位。C3是血清中含量最多的补体成分,这也正是适应其作用之所需。不论在经典途径还是在旁路途径,当C3被激活物质激活时,其裂解产物C3b又可在B因子和D因子的参与作用下合成新的C3bBb。后者又进一步使C3裂解。由于血浆中有丰富的C3,又有足够的B因子和Mg2+,因此这一过程一旦被触发,就可能激活产生显著的扩大效应。有人称此为依赖C3bBb的正反馈途径,或称C3b的正反馈途径(图4-11)。

图4-11 C3b的正反馈途径
表4-1 两条激活途径的主要不同点
(四)补体激活过程的调节
机体通过一系列的复杂的因素,调节补体系统的激活过程,使之反应适度。例如经C3b的正反馈途径即可扩大补体的生物学效应。但补体系统若过度激活,不仅无益地消耗大量补体成分,使机体抗感染能力下降,而且在激活过程中产生的大量生物活性物质,会使机体发生剧烈的炎症反应或造成组织损伤,引起病理过程。这种过度激活及其所造成的不良后果,可通过调控机制而避免。这种调控机制包括补体系统中某些成分的裂解产物易于自行衰变以及体液中多种灭活因子和抑制物的调节作用。
三、补体的生物学活性
补体系统是人和某些动物种属,在长期的种系进化过程中获得的非特异性免疫因素之一,它也在特异性免疫中发挥效应,它的作用是多方面的。补体系统的生物学活性,大多是由补体系统激活时产生的各种活性物质(主要是裂解产物)发挥的。补体成分及其裂解产物的生物活性列于表4-2。
表4-2 补体成分及其裂解产物的生物活性


(一)细胞毒及溶菌、杀菌作用
补体能溶解红细胞、白细胞及血小板等。当补体系统的膜攻击单位C5~C9均结合到细胞膜上,细胞会出现肿胀和超微结构的改变,细胞膜表面出现许多直径为8~12 mm的圆形损害灶,最终导致细胞溶解。
补体还能溶解或杀伤某些革兰氏阴性菌,如霍乱弧菌、沙门氏菌及嗜血杆菌等,革兰氏阳性菌一般不被溶解,这可能与细胞壁的结构特殊或细胞表面缺乏补体作用的底物有关。
(二)调理作用
补体裂解产物C3b与细菌或其他颗粒结合,可促进吞噬细胞的吞噬,称为补体的调理作用。C3裂解产生出的C3b分子,一端能与靶细胞(或免疫复合物)结合;其另一端能与细胞表面有C3b受体的细胞(单核细胞、巨噬细胞、中性粒细胞等)结合,在靶细胞与吞噬细胞表面之间起到桥染作用,从而促进了吞噬(图4-12)。

图4-12 C3分子及其裂解产物生物活性示意图
(三)免疫黏附作用
免疫复合物激活补体之后,可通过C3b而黏附到表面有C3b受体的红细胞、血小板或某些淋巴细胞上,形成较大的聚合物,可能有助于被吞噬清除。
(四)中和及溶解病毒作用
在病毒与相应抗体形成的复合物中加入补体,则明显增强抗体对病毒的中和作用,阻止病毒对宿主细胞的吸附和穿入。
近年来发现,不依赖特异性抗体,只有补体即可溶解病毒的现象。例如RNA肿瘤病毒及C型RNA病毒均可被灵长类动物的补体所溶解。据认为这是由于此类病毒包膜上的C1受体结合C1q之后所造成的。
(五)炎症介质作用
炎症也是免疫防御反应的一种表现。感染局部发生炎症时,补体裂解产物可使毛细血管通透性增强,吸引白细胞到炎症局部。
1.激肽样作用 C2a能增加血管通透性,引起炎症性充血,具有激肽样作用,故称其为补体激肽。
2.过敏毒素作用 C3a、C5a均有过敏毒素作用,可使肥大细胞或嗜碱性粒细胞释放组胺,引起血管扩张,增加毛细血管通透性以及使平滑肌收缩等。
3.趋化作用 C5a有趋化作用,故又称为趋化因子,能吸引具有C5a受体的吞噬细胞游走到补体被激活(即趋化因子浓度最高)的部位。
四、血清的补体水平与疾病
人血清补体含量相对稳定,只在患某些疾病时,血清补体总量或各成分含量才可能发生变动。目前可以根据补体的溶血活性测定其总含量,亦可用免疫扩散法测定某些补体成分的含量。
恶性肿瘤等少数疾病病人血清补体总量可较正常人高2~3倍,对其意义并不清楚。在某些传染病中亦可见到代偿性增高。
血清补体总量低于正常值者,称为低补体血症。低补体血症可见于以下几种情况:①补体成分的大量消耗,可发生在血清病、链球菌感染后肾小球肾炎、系统性红斑狼疮、自身免疫性溶血性贫血、类风湿性关节炎及同种异体移植排斥反应等。在这些疾病,除补体总量下降外,尚可伴有C1q、C4、C2、C3及C5各成分的减少;②补体的大量丢失,多见于外伤、手术和大失血的病人。补体成分随血清蛋白的大量丧失而丢失,发生低补体血症;③补体合成不足,主要见于肝病病人,例如肝硬化、慢性活动性肝炎和急性肝炎的重症病例。
第三节 细胞因子
一、细胞因子的概述
细胞因子(cytokines)是由机体细胞合成和分泌的具有生物活性的小分子蛋白物质的统称。在很多情况下,多种免疫细胞间的相互作用是通过细胞因子介导的。从不同的角度,细胞因子有多种其他的名称:如由单核-巨噬细胞产生的细胞因子称为单核因子;由淋巴细胞产生的细胞因子称为淋巴因子;可刺激骨髓干细胞或祖细胞分化成熟的细胞因子称为集落刺激因子。细胞因子通过与细胞表面相应受体结合发挥抗感染、抗肿瘤、免疫调节、参与炎症反应、促进细胞生长和组织修复等多种生物学作用。随着生物技术的发展,已开始应用重组细胞因子调节机体的免疫应答以治疗某些疾病,现可作为生物应答调节剂(biological responsemodifier,BRM)中的一类重要的治疗制剂。
二、细胞因子的分类
细胞因子是细胞间信号分子,通过与细胞表面相应受体结合启动细胞信号转导,最终引起细胞基因转录的变化而发挥生物学作用。根据其结构和功能,细胞因子可分为六类。
1.白细胞介素(interleukin,IL)最初是指由白细胞产生又在白细胞间发挥作用的细胞因子,虽然后来发现IL可由其他细胞产生,也可作用于其他细胞,但这一名称仍被沿用至今。目前已发现29种,分别命名为IL-1~IL-29。
2.干扰素(interferon,IFN)是最早发现的细胞因子,因其能干扰病毒的感染和复制,故称干扰素。根据来源和理化性质分为α、β和γ三种类型。IFN-α和IFN-β合称为Ⅰ型干扰素,主要由被病毒感染的细胞、单核/巨噬细胞、成纤维细胞产生,其作用以抗病毒、抗肿瘤为主,也有一定的免疫调节作用。IFN-γ又称Ⅱ型干扰素,由活化的T细胞和NK细胞产生,其作用以免疫调节为主,抗病毒、抗肿瘤作用不及Ⅰ型干扰素。
3.肿瘤坏死因子(tumor necrosis factor,TNF)因最初发现其能引起肿瘤组织出血坏死而得名。目前发现的肿瘤坏死因子超家族成员至少有18个。主要的有TNF-α、TNF-β(又称淋巴毒素,LT)、CD40L和FasL。
4.集落刺激因子(colony stimulating factor,CSF)是指能够刺激多能造血干细胞和不同发育分化阶段的造血祖细胞增殖分化的细胞因子。主要有粒细胞-巨噬细胞集落刺激因子(GM-CSF)、粒细胞集落刺激因子(G-CSF)、红细胞生成素(EPO)、干细胞生成因子(SCF)、血小板生成素(TPO),IL-11也是重要的造血刺激因子。
5.趋化因子(chemokine)是一类促进炎症的细胞因子,其主要作用是招募血液中的单核细胞、中性粒细胞、淋巴细胞等进入感染发生的部位。主要有单核细胞趋化蛋白1 (MCP-1)、中性粒细胞趋化因子(IL-8)、淋巴细胞趋化蛋白等。
6.生长因子(growth factor,GF)是具有刺激细胞生长作用的细胞因子。包括表皮细胞生长因子(EGF)、血管内皮细胞生长因子(VEGF)、成纤维细胞生长因子(FGF)等。有些未以生长因子命名但也有刺激细胞生长的作用,如IL-2是T细胞的生长因子,TNF-α是成纤维细胞的生长因子。有些生长因子也可表现对免疫应答的抑制作用,如转化生长因子-β(TGF-β)可抑制多种免疫细胞的增殖、分化及免疫效应。
三、细胞因子的生物学活性
细胞因子具有非常广泛的生物学活性,包括促进靶细胞的增殖和分化,增强抗感染和细胞杀伤效应,促进或抑制其他细胞因子和膜表面分子的表达,促进炎症过程,影响细胞代谢等。
(一)免疫细胞的调节剂
免疫细胞之间存在错综复杂的调节关系,细胞因子是传递这种调节信号必不可少的信息分子。许多免疫细胞还可通过分泌细胞因子产生自身调节作用。例如T细胞产生的IL-2可刺激T细胞的IL-2受体表达和进一步的IL-2分泌;Th1细胞通过产生干扰素γ抑制Th2细胞的细胞因子产生;而Th2细胞又通过IL-10、IL-4和IL-13抑制Th1细胞的细胞因子产生。通过研究细胞因子的免疫网络调节,可以更好地理解完整的免疫系统调节机制,并且有助于指导细胞因子作为生物应答调节剂应用于临床治疗免疫性疾病。
(二)免疫效应分子
在免疫细胞针对抗原(特别是细胞性抗原)行使免疫效应功能时,细胞因子是其中重要效应分子之一。例如TNFα和TNFβ可直接造成肿瘤细胞的凋亡,使瘤细胞DNA断裂,细胞萎缩死亡;干扰素α、β、γ可干扰各种病毒在细胞内的复制,从而防止病毒扩散;白血病抑制因子可直接作用于某些髓性白血病细胞,使其分化为单核细胞,丧失恶性增殖特性。另有一些细胞因子通过激活效应细胞而发挥其功能,如IL-2和IL-12刺激NK细胞与Tc细胞的杀肿瘤细胞活性。与抗体和补体等其他免疫效应分子相比,细胞因子的免疫效应功能多样化,因而在抗肿瘤、抗细胞内寄生感染、移植排斥等功能中起重要作用。
(三)造血细胞刺激剂
从多能造血干细胞到成熟免疫细胞的分化发育漫长道路中,几乎每一阶段都需要有细胞因子的参与,由此构成了细胞因子对造血系统的庞大控制网络。某种细胞因子缺陷就可能导致相应细胞的缺陷,如肾性贫血病人的发病就是肾产生Epo的缺陷所致,正因为如此,应用Epo治疗这一疾病收到了非常好的效果。目前多种刺激造血的细胞因子已成功地用于临床血液病,有非常好的发展前景。
(四)炎症反应的促进剂
炎症是机体对外来刺激产生的一种病理反应过程,症状表现为局部的红肿热痛,病理检查可发现有大量炎症细胞如粒细胞、巨噬细胞的局部浸润和组织坏死。在这一过程中,一些细胞因子起到了重要的促进作用,目前已开始利用细胞因子抑制剂治疗炎症性疾病,例如利用IL-1的受体拮抗剂和抗TNFα抗体治疗败血性休克、类风湿关节炎等,已收到初步疗效。
(五)其他
许多细胞因子除参与免疫系统的调节效应功能外,还参与非免疫系统的一些功能。例如IL-8具有促进新生血管形成的作用;M-CSF可降低血胆固醇; IL-1刺激破骨细胞、软骨细胞的生长; IL-6促进肝细胞产生急性期蛋白等。这些作用为免疫系统与其他系统之间的相互调节提供了新的证据。
第四节 主要组织相容性抗原
一、概 述
20世纪初即已发现,在不同种属或同种不同动物个体间进行正常组织或器官移植会出现排斥现象,它是供者与受者组织不相容的反映。其后证明,排斥反应本质上是一种免疫反应,它是由组织表面的同种异型抗原诱导的。这种代表个体特异性的同种抗原称为组织相容性抗原(histocompatibility antigen)或移植抗原(transplantation antigen)。机体内与排斥反应有关的抗原系统多达20种以上,其中能引起强而迅速排斥反应者称为主要组织相容性抗原,其编码基因是一组紧密连锁的基因群,称为主要组织相容性复合体(major histocompatibility complex,MHC)。因此,主要组织相容性抗原也称MHC分子。现已证明,控制机体免疫应答能力与调节功能的基因(immune response gene,Ir gene)也存在于MHC内。因此,MHC不仅与移植排斥反应有关,也广泛参与免疫应答的诱导与调节。不同种属的哺乳类动物其MHC及编码的抗原系统有不同的命名,人类的MHC分子因为首先在人外周血白细胞表面发现,故称为人类白细胞抗原(human leukocyte antigen,HLA),又称为HLA分子。人类的MHC称为HLA复合体。
(一)HLA复合体定位及结构
HLA复合体位于人第6号染色体的短臂上。该区DNA片段长度约3.5~4.0 K个碱基对,占人体整个基因组的1/3 000。图4-13显示了HLA复合体结构。HLA复合体共有224个基因位座,其中128个为功能性基因(有产物表达),96个为假基因。传统上按其产物的结构、表达方式、组织分布与功能可将这些基因位座分为三类。

图4-13 人类HLA复合体结构示意图
1.HLA-I类基因区 主要为HLA-A、-B、-C三个基因座位,其产物为HLA-I类分子的α链,它与第15号染色体编码的β2微球蛋白(β2 m)共同构成HLA-I类分子。
2.HLA-II类基因区 主要为D区,它包括DP、DQ、DR三个亚区。每个亚区又包括两个或两个以上的基因座位。其产物为HLA-II类分子。
3.HLA-III类基因区 包括C2、C4、Bf等基因座位,其主要产物有C2、C4、B因子等补体成分。
近年来,用分子生物学技术在HLA复合体的I类、II类和III类基因区又发现了一些新的基因座位,如I类基因区发现了HLA-E、-G、-H、-J、-K和-L等所谓非经典的I类基因,其编码产物的功能有待研究。II类基因区十分复杂,近年来的大量研究发现,在II类基因区内有与抗原处理和提呈有关的新基因存在,如HLA-DM、HLA-DO、低分子量多肽(LMP)基因、抗原加工相关转运体(TAP)基因等。所以HLA-A、-B、-C又被称为经典的HLA-I类基因,HLA-DP、-DQ、-DR又被称为经典的HLA-II类基因。
(二)HLA复合体遗传特征
1.单元型遗传方式 HLA复合体是一组紧密连锁的基因群。这些连锁在一条染色体上的等位基因很少发生同源染色体间的交换,构成一个单元型。在遗传过程中,HLA单元型作为一个完整的遗传单位由亲代传给子代。
二倍体生物的每一细胞均有两个同源染色体组,分别来自父母双方。故子女的HLA单元型也是一个来自父方,一个来自母方。在同胞之间比较HLA单元型会出现下列三种可能性:二个单元型完全相同或完全不同的机率各占25%;有一个单元型相同的机率占50%;至于亲代与子代之间则必然有一个单元型相同,也只能有一个单元型相同(图4-14)。这一遗传特点在器官移植供者的选择以及法医的亲子鉴定中得到了应用。

图4-14 HLA单元型遗传示意图
注:a、b、c、d代表单元型 A1、A2、B8、B35等代表HLA基因位座等位基因
2.多态性现象 多态性是指在一随机婚配的群体中,染色体同一基因位座有两种以上基因型,即可能编码二种以上的产物。HLA复合体是迄今已知人体最复杂的基因复合体,有高度的多态性。HLA的多态性现象由下列原因所致:①复等位基因,位于一对同源染色体上对应位置的一对基因称为等位基因。由于群体中的突变,同一位座上存在多个等位基因称为复等位基因,但对某一基因位座,一个个体最多只能有两个等位基因。前已述及,HLA复合体的每一位座均存在为数众多的复等位基因,这是HLA高度多态性的最主要原因。由于各个座位基因是随机组合的,故人群中的基因型可达108之多;②共显性,一对等位基因同为显性称为共显性。HLA复合体中每一个等位基因均为共显性,从而大大增加了人群中HLA表型的多样性,达到107数量级。因此,除了同卵双生外,无关个体间HLA型别完全相同的可能性极小。
HLA的高度多态性显示了遗传背景的多样性,这可能是高等动物抵御不利环境因素的一种适应性表现,从而对维持种属的生存与延续具有重要的生物意义,但也给组织移植过程中寻找配型合的供体带来很大的困难。
3.连锁不平衡 HLA复合体各等位基因均有其各自的基因频率。基因频率是指某一特定等位基因与该基因位座中全部等位基因总和的比例。随机婚配的群体中,在无新的突变和自然选择的情况下,基因频率可以代代维持不变。由于HLA复合体的各基因位座是紧密连锁的,若各位座的等位基因随机组合构成单元型,则某一单元型的出现频率应等于该单元型各基因出现频率的乘积。例如,在北欧白人中HLA-A1和HLA-B8频率分别为0.17和0.11。若随机组合,则单元型A1-B8的预期频率为0.17×0.11= 0.019,但实际所测得的A1-B8单元型频率是0.088。此现象称为连锁不平衡,意指分属两个或两个以上基因座位的等位基因,同时出现在一条染色体上的概率高于或低于随机出现频率的现象。特定的HLA基因与某病的易感基因连锁,可能与某些自身免疫病的发生相关。
(三)HLA抗原的分子结构
1.HLA-I类分子 由重链(α链)和轻链(β2m)两条多肽链通过非共价键连接的异二聚体糖蛋白分子。α链的分子量为44 k,β2m为12 k。HLA-I类分子可以分为四个区域(图4-15)。
(1)多肽结合区 由α1和α2功能区组成,共同构成结合槽,与抗原多肽结合。HLA -I类分子的同种异型抗原决定基就位于该区域,同时它也是CD8+ T细胞的TCR识别的部位。
(2)Ig样区 由α3功能区和β2m构成。α3功能区与Ig的恒定区具有同源性,它是Tc细胞表面CD8分子的结合部位。β2 m与α链相互作用对维持HLA-I类分子天然构型的稳定性及表达具有重要意义。
(3)穿膜区 呈螺旋状结构穿过细胞膜并将HLA-I类分子锚定在细胞膜上。
(4)胞浆区 它与细胞内外信号的传递有关。
2.HLA-II类分子 由α链和β链通过非共价键连接的异二聚体糖蛋白分子,它们均由HLA-II类基因编码,分子量分别为34 k、29 k。HLA-II类分子也分为四个区域。(1)多肽结合区 由α1和β1功能区组成,其结合槽与抗原多肽结合。HLA-II类分子的同种异型抗原决定基就位于该区域,同时它也是CD4+ T细胞的TCR识别的部位。

图4-15 HLA-I、HLA-II类分子结构示意图
(2)Ig样区 由α2和β2功能区构成。TH细胞表面CD4分子可与β2功能区结合。
(3)穿膜区 将HLA-II类分子锚定在细胞膜上。
(4)胞浆区 传递细胞内外的信号。
(四)HLA抗原的组织分布
各类HLA抗原的组织分布不同。I类抗原广泛分布于体内各种有核细胞表面,包括血小板和网织红细胞。成熟的红细胞一般不表达I类抗原。不同的组织细胞表达I类抗原的密度各异。外周血白细胞和淋巴细胞所含I类抗原量最多,II类抗原主要表达在某些免疫细胞表面,如抗原提呈细胞(包括B细胞、单核/巨噬细胞,树突状细胞)、胸腺上皮细胞和激活的T细胞等,内皮细胞和某些组织的上皮细胞也可检出HLA-II抗原。另外,某些组织细胞在病理情况下也可异常表达II类抗原。I、II类抗原主要分布在细胞表面,但也可能出现于体液中,血清、尿液、唾液、精液及乳汁中均已检出可溶性HLA-I、II类抗原。HLA-III类抗原一般指几种补体成分,它们均分布于血清中。
二、MHC分子的生物学功能
MHC最初是在研究排斥反应的过程中发现的。MHC分子作为代表个体特异性的主要组织抗原,在排斥反应中起重要作用。自从20世纪60年代发现了Ir基因,70年代发现了细胞毒性T细胞与靶细胞间相互作用的MHC限制性后,对MHC的生物学作用有了更深入的认识。MHC的主要功能包括:
(一)参与抗原的提呈
在免疫应答中,内源性抗原(如肿瘤抗原、病毒抗原等)必须与相应的HLA-I类分子结合,以内源性抗原多肽-HLA-I类分子复合物的形式表达于细胞表面,才能被相应的CD8+ Tc细胞的TCR识别。外源性抗原被APC加工处理后的抗原多肽与HLA-Ⅱ类分子结合,以外源性抗原多肽-HLA-Ⅱ类分子复合物的形式表达于细胞表面,才能被相应的CD4+ TH细胞的TCR识别。
(二)参与T细胞限制性识别
T细胞抗原受体(TCR)在识别抗原肽的同时,还需识别与抗原肽结合的同基因型MHC分子,这一现象称为MHC限制性。即具有同一MHC表型的免疫细胞才能有效地相互作用。例如,Tc细胞杀伤病毒感染的靶细胞时,其TCR要联合识别靶细胞表面抗原多肽-HLA-I类分子复合物的抗原多肽和HLA-I类分子的α1和α2功能区的同种异型决定基。TH细胞的TCR也要联合识别APC表面的抗原多肽和HLA-Ⅱ类分子的α1和β1功能区的同种异型抗原决定基。只有这样Tc细胞才能杀伤靶细胞,TH细胞才能活化、增殖。
(三)参与T细胞分化过程及自身耐受的建立
T细胞必须在胸腺中经过阳性选择和阴性选择才能发育为成熟的T细胞,MHC分子参与这两种选择。
1.阳性选择 CD4+、CD8+双阳性T细胞与胸腺上皮细胞表面MHC-Ⅱ或MHC-Ⅰ类分子结合,才能继续分化为只表达CD4+或CD8+的单阳性细胞,此为阳性选择。T细胞通过阳性选择获得MHC限制性。
2.阴性选择 经阳性选择的T细胞与APC表面的自身抗原肽-MHC分子复合物结合,被激活后发生凋亡或失能;未与自身抗原肽-MHC分子复合物结合的单阳性T细胞才能继续发育为成熟的T细胞,此为阴性选择。T细胞通过阴性选择获得对自身抗原的耐受性。
(四)参与免疫应答的调节
MHC通过抗原提呈、MHC的限制性、参与T细胞分化发育和活化、建立自身耐受等诸多环节,调节影响免疫应答。
三、HLA与临床医学
HLA领域的研究工作在医学实践中有十分重要的意义。
(一)HLA与疾病相关性
某些疾病的发生与一些特定的HLA分子相关,最典型的例子是强直性脊柱炎(AS)。病人中HLA-B27分子阳性率高达58%~97%,而健康对照人群仅为1%~8%。表4-3列出了某些疾病与HLA的相关性。
表4-3 HLA和疾病的相关性

续表4-3

迄今已检出了众多的HLA基因多态性标志。因此,有可能在DNA水平上探讨HLA与疾病的相关性,甚至发现一些与经典HLA抗原未表现出关联、但与HLA基因型别关联的疾病。可以预期,随着DNA水平研究的不断深入,最终有可能在HLA复合体中发现某些疾病的易感基因,甚至测出这些基因的核苷酸序列。这将有助于阐明某些疾病的发病机制,并在此基础上制订全新的防治措施。
(二)HLA表达异常与疾病的关系
HLA表达异常即细胞表面HLA分子质与量的异常,可参与疾病发生。
1.HLA-I类抗原表达异常 在许多人类肿瘤或肿瘤衍生的细胞株均已发现MHCI类抗原表达缺失或密度降低。若将I类基因转染给肿瘤细胞株,则恶变细胞可发生逆转,且浸润性与转移性消失或降低。这可能是由于MHC-I类抗原缺失的肿瘤细胞不能被TC识别并攻击,从而导致肿瘤免疫逃逸(sneaking through)。
2.HLA-II类抗原表达异常 器官特异性自身免疫疾病的靶细胞可异常表达HLAII类抗原。诸如Graves病患者的甲状腺上皮细胞、原发性胆管肝硬化患者的胆管上皮细胞、I型糖尿病患者的胰岛β细胞等均可发现HLA-II抗原异常表达。其机制可能是局部感染诱生IFN-γ,后者诱导II类抗原表达。II类抗原乃抗原呈递的效应分子,一旦靶细胞异常表达II类抗原,就可能以组织特异性方式把自身抗原呈递给自身反应性T细胞,从而启动自身免疫反应。激活的自身反应性TH又可分泌大量IFN-γ,诱导更多的靶细胞表达II类抗原,加重和延续自身免疫反应,最终导致迁延不愈的自身组织损伤。
(三)HLA与排斥反应
移植物存活率很大程度上取决于供者和受者之间HLA型别相合的程度。在肾移植中,各HLA基因位座配合的重要性依次为HLA-DR、HLA-B、HLA-A。近年来特别重视HLA-DP对移植器官长期存活的意义。在骨髓移植中,为预防严重的移植物抗宿主反应(graft versus host reaction,GVHR),一般要求从同胞中选择HLA全相同的个体作为供者。此外,某些输血反应以及习惯性流产也与HLA不相容所导致的排斥反应有关。
(四)HLA与法医
由于HLA复合体的高度多态性,在无关个体间HLA表型全相同的机率极低,故HLA复合体被看作是伴随个体终生的特异性遗传标记。借助HLA基因型和(或)表型检测,可用于法医上的个体识别。另外,由于HLA复合体具有高度多态性以及单元型遗传的特点,使HLA分型成为鉴定亲子关系的重要手段。
小 结
免疫球蛋白结构:Ig分子是由两条H链和两条L链通过二硫键连接而成的四肽链结构; V区是抗原结合部位,重链的C区具有激活补体和结合细胞活性。抗体的功能:结合抗原、激活补体、调理吞噬和介导ADCC、通过胎盘、结合SPA。人体的免疫球蛋白主要有五类:IgM、IgA、IgG、IgD、IgE,不同类别的Ig在体内发挥不同的免疫效应。
补体系统由补体固有成分(C1~C9,MBL及B因子、D因子等)、补体调节蛋白和补体受体组成。补体系统需激活才可发挥生物学活性。其激活途径包括经典途径和旁路途径,补体的激活处于严格的调控之下。补体系统的生物学活性包括:溶菌溶细胞、调理吞噬、引起炎症反应、清除免疫复合物及免疫调节作用。
细胞因子是由细胞产生的具有生物活性的蛋白类物质的统称。细胞因子可被分为白细胞介素、干扰素、肿瘤坏死因子、集落刺激因子、生长因子和趋化因子六类。
MHC即主要组织相容性基因复合体。人类MHC称HLA,本章重点为经典的HLAI、II类基因及其产物的分布和功能。MHC的主要生物学功能是以其产物结合并提呈抗原肽供T细胞识别,启动特异性免疫应答。
(丁 丽)
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。
















