第六节 冠心病合并肾功能不全的介入治疗策略
肾功能不全患者的心血管系统疾病发病率及死亡率均较高,这可能与肾功不全可以加速动脉粥样硬化进程、冠脉病变钙化、多支血管病变发生率高、激活凝血系统及增加血栓发生率有关。在终末期肾脏疾病患者中,心源性死亡原因占所有原因的一半左右,其中50%为心肌梗死,为正常人群的3~5倍。
肾功能不全的再血管化治疗原则与没有肾功不全的患者相同,但肾功能不全对治疗后短期及长期效果的影响应认真考虑(表6-8、表6-9)。
总体来看,慢性透析患者经皮血运重建术后缺血并发症、血管并发症和再狭窄发生率较高。与总人群相比,血液透析患者PTCA或CABG治疗后,其1个月和12个月的死亡率高2~3倍。尽管植入了支架,但是与肾功能正常的患者相比,肾功能不全患者(透析或未透析)缺血并发症和死亡率仍然较高。
表6-8 肾功能不全患者的PCI治疗
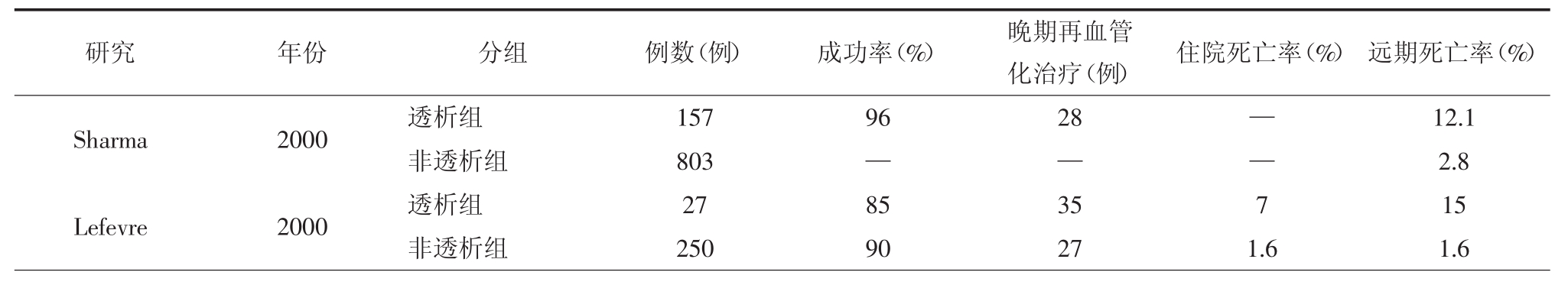
续表

表6-9 肾功能不全(透析)患者的PC I与CABG治疗的比较
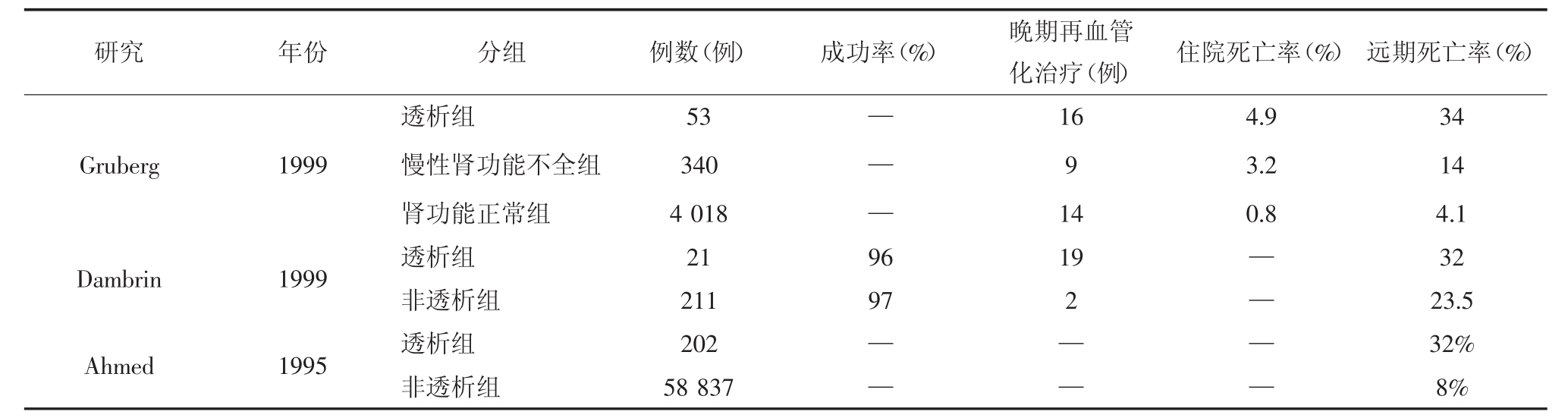
介入医疗设备和手段的改进,在一定程度上减少了PCI治疗后并发症的发生,美国在透析患者中进行了PCI治疗与CABG治疗效果的比较,结果表明,从死亡率及再血管化角度来看,PCI的效果不如CABG。Szczech等的研究表明,冠心病合并肾功能不全患者(血清肌酐>221mmol/L)CABG死亡率高于PCI治疗组;但对于终末期肾功能不全患者,CABG优于PCI治疗。
肾功能不全患者冠脉介入治疗的手术成功率与肾功能正常的患者相似,但因为肾脏疾病特点,在PCI前后应注意一些问题。
1.抗血小板药物的应用研究结果表明,在肾功能不全患者中应用糖蛋白Ⅱb/Ⅲa受体拮抗剂受限,因为与正常人群相比出血并发症较多。床旁血小板聚集力的检测有助于指导抗血小板药物的应用,但有关肾功能不全人群的抗血小板治疗目标尚未确定。
2.介入手段选择
在血肌酐>1.5mg/dL情况下,观察了362例患者支架植入与单纯PTCA相比的远期死亡、心肌梗死及再血管化的比例。支架植入后在轻、中度肾功能不全患者中远期再狭窄率仍较高。循证医学证实冠脉旋切或旋磨可能在肾功能不全患者中有较好的治疗效果,但样本量较小。
3.介入治疗中造影剂的应用
(1)造影剂种类选择:应选用低渗、非离子性造影剂。目前使用的造影剂成分主要包括碘原子、羧基、钠离子和葡甲胺及羟基等。碘原子起显影作用,而解离的微粒引起肾毒性。成像质量与肾毒性之间的关系直接取决于碘原子与可溶微粒之间的比率。比率越高,成像质量越好,肾毒性越低。高渗造影剂比率为1.5,低渗造影剂比率为3,等渗造影剂比率为6。此外,造影剂还可分为离子型和非离子型造影剂;非离子型造影剂为水溶性,但其并不解离为离子状态,因而并不增加可溶微粒。理论上非离子型、低渗及等渗造影剂可提供更高质量的影像和更小的肾毒性。低渗造影剂对肾血流量影响较少,可能较传统的造影剂更为安全。Rudnick等研究显示,肾功能正常的患者接受低渗造影剂后造影剂肾病(CIN)的发生率无明显差异,而术前血肌酐>1.6mg/dL的患者,接受高肾造影剂的CIN发生率高3.3倍,故对有危险因素的患者提倡用低渗造影剂。
(2)造影剂剂量的选择:Cigarroa建议肾功能不全患者造影剂剂量根据公式,体重(kg)×5/血清肌酐(mg/dL),最后算出的值为造影剂用量(mL)(表6-10)。
4. PCI治疗后肾功能损害的处理敏感的肾功能检测表明,大多数血管内注射碘类造影剂的病人都会出现轻度、一过性的肾功能变化。造影剂诱发肾病的一般定义是暴露于造影剂后血清肌酐水平呈一定量升高[0.5mg/dL(441μmoL/L)]或呈比例升高(25%)。病人既往没有肾病时,则该病的发病率低得多。
原有肾功能不全患者为预防PCI后肾功能恶化,以下手段可能有效:
(1)水化:水化是使用最早、目前被广泛接受的有效减少造影剂肾病发生率的方法。水化可增加尿量,防止肾小管内结晶形成,而造影后补液可预防造影剂的渗透性利尿作用。目前普遍采用的补液方法:0.45%氯化钠注射液分别于造影前后各12h,以1.0~1.5mL/(kg·h)的滴速各维持12h,保持尿量75~125mL/h。对左心功能不全患者尤其要注意补液量及尿量,以防加重心衰。门诊患者于术前口服补液、造影后6h静脉补液,同样可取得良好效果。
(2)腺苷受体抑制剂:腺苷是肾脏缩血管物质,参与造影剂肾病的发生。肾功能不全患者,造影剂可激动A2[a]和A1受体,前者引起早期舒血管作用,后者引起持续的血流动力学变化。茶碱作为腺苷受体拮抗剂已引起人们注意。早期研究表明,茶碱可减轻使用造影剂后GRF和Cr的下降,但新近研究却并没有发现茶碱在预防造影剂肾病上有额外益处。特异性A1受体拮抗剂在体外及动物模型体内试验均发现有预防造影剂肾病的作用。
(3)非诺多泮:非诺多泮是高度选择性的DA-1受体激动剂,其作用机制主要是引起血管平滑肌的舒张,减少肾血管阻力,为多巴胺作用的6倍,并增加肾血流量、GFR、尿钠排泄及尿量。研究发现,使用非诺多泮时造影剂肾病发病率为4.7%,而对照组为18.8%(p<0.001),对糖尿病患者尤其有益。
(4)多巴胺:多巴胺在所谓的肾脏剂量时[0.5~2μg/(kg·min)]可增加肾血流量、GFR及尿钠排泄率。
(5)N-乙酸半胱氨酸(NAC):最近NAC对造影剂肾病的预防作用引起重视。NAC预防造影剂肾病的可能机制包括:①NAC的直接抗氧化作用,其中-OH可灭活ROS。②NAC可促进谷胱甘肽合成,通过后者间接发挥抗氧化作用。③NAC可引起血管舒张作用,主要通过一氧化氮来发挥作用。近3年来,共有13项相关研究,其中5项支持NAC的肾脏保护作用,8项得出相反结论。因此目前尚无法肯定NAC对造影剂肾病的预防效果。
(6)钙离子拮抗剂(CCB):CCB对肾脏血管起舒张作用,且对入球小动脉扩张作用强于出球小动脉。此外,还增加尿钠排泄。
(7)内皮素受体抑制剂:内皮素(ET)包括ET1、ET2和ET3,其中ET1在人类和动物中含量最丰富。ET是已知的最强的血管收缩物质,而肾血管对ET的敏感性最强。ET1可引起肾血管收缩,外髓质血流减少,肾血流量和GFR下降。体内和体外试验均发现造影剂可引起ET1和ET2增加,而这与造影剂用量有关(≥150mL)。由于目前尚无选择性ETRA抑制剂的人体试验,因而缺乏进一步研究。
(8)利尿剂:一项研究比较0.45% NaCl、0.45% NaCl+甘露醇和0.45% NaCl+呋塞米对78例慢性肾功能不全血管造影患者的肾脏保护作用,结果三组造影剂肾病发病率分别为11%、28%和40%(p=0.01)。PRINCE试验中有98例慢性肾功能不全患者随机接受0.45% NaCl及0.45% NaCl+呋塞米+甘露醇,发现尿量<150mL/h的患者的造影剂肾病发病率较尿量>150mL/h的患者低(21.6%和45.9%)。尽管临床习惯于急性肾功能衰竭时使用利尿剂,但从目前研究结果来看,利尿剂对造影剂肾病没有明显预防作用,甚至有可能加重损害,因而不主张使用。
(9)透析:无论血液透析还是腹膜透析都可以有效清除造影剂。
迄今为止,对已经发生的造影剂肾病并没有有效对策。随着造影剂肾病危险因素的逐步确定,在患者造影术前最大限度地改善及纠正上述危险因素,可有效预防造影剂肾病发生。随着造影剂肾病发病机制的认识加深,人们不断尝试不同药物的预防作用。然而遗憾的是,目前认为有预防效果的方法只有水化,但也不能完全杜绝,且受患者心功能限制。腺苷受体抑制剂、非诺多泮、NAC及内皮素受体抑制剂等药物的预防作用近来引起广泛关注,但由于其相关研究结论存在矛盾,其应用尚存在争议,需要更大样本、设计更完善的研究来确认。
表6-10 肾功能不全患者造影剂用量

(于 波)
参考文献
[1] Leier CV, Boudoulas H. Cardiorenal Disorders and Diseases Mount Kisko, NY: Futura Publishing Co, 1992.
[2] Jungers P, Massy ZA, Khoa TN, et al. Incidence and risk factors of atherosclerotic cardiovascular accidents in pre-dialysis chronic renal failure patients: a prospective study[J]. Nephrol Dial Transplant,1997, 12: 2597-2602.
[3]Manske CL,Wang Y, Rector T, et al. Coronary revascularization in insulin-dependent diabetic patients with chronic renal failure[J]. Lancet, 1992, 304: 998-1002.
[4] De Meyer M, Wyns W, Dion R, et al. Myocardial revascularization in patients on renal replacement therapy[J]. Clin Nephrol, 1991, 36: 147-151.
[5] Kahn JK, Rutherford BD, McConahay DR, et al. Short-and long-term outcome of percutaneous transluminal angioplasty in chronic dialysis patients[J]. Am Heart J, 1990, 119: 484-489.
[6] Ahmed WH, Shubrooks SJ, Gibson CM, et al. Complications and long-term outcome after percutaneous coronary angioplasty in chronic hemodialysis patients[J]. Am Heart J, 1994, 128: 252-255.
[7]Reusser LM, Osborn LA,White HJ, et al. Increased morbidity after coronary angioplasty in patients on chronic hemodialysis[J]. Am J Cardiol, 1994, 73: 965-967.
[8] Utsimoniya M. Angiographic study of stenosis and calcification of coronary vessels in long-term dialysis patients: examination of risk factors for coronary calcification[J]. Nippon Jinzo Gakkai Shi, 1996, 38: 155-163.
[9] MacIsaac A I, Bass TA, Buchbinder M, et al. High speed rotational atherectomy: outcome in calcified and noncalcified coronary artery lesions[J]. J Am Coll Cardiol, 1995, 26: 731-736.
[10] Ellis S, Vandormael M, Cowley M, et al. Coronary morphologic and clinical determinants of procedural outcome with angioplasty for multivessel coronary disease: implications for patient selection: Multivessel Angioplasty Prognosis Study Group[J]. Circulation, 1990, 82: 1193-1202.
[11] Vanderzwet PM, Reiber JH. Issues of QCA validation[J]. Cathet Cardiovasc Diagn, 1994, 33: 97-98.
[12] Schoebel FC, Gradaus F, Ivens K, et al. Restenosis after elective coronary balloon angioplasty in patients with end stage renal disease: a case control study, using quantitative coronary angiography[J]. Heart, 1997, 78: 337-342.
[13] Rinehart AL, Herzog CA, Collins AJ, et al. A comparison of coronary angioplasty and coronary artery bypass grafting outcome in chronic dialysis patients[J]. Am J Kidney Dis, 1995, 25: 281-290.
[14]Oesterle SN. Beyond stents: third generation coronary devices[J]. Ann Thorac Surg, 1998, 66: 1045-1049.
[15] Use of a monoclonal antibody directed against the platelet glycoprotein IIb/IIIa receptor in high risk coronary angioplasty: the EPIC Investigation[J]. N Engl J Med, 1994, 330: 956-961.
[16] Platelet glycoproteinⅡb/Ⅲa receptor blockade and low-dose heparin during percutaneous coronary revascularization: the EPILOG Investigators[J]. N Engl J Med, 1997, 336: 1689-1696.
[17] Anderson R, O’Brien M, MaWhinney S, et al. Renal failure predisposes patients to adverse outcome after coronary artery bypass surgery: VA Cooperative Study[J]. Kidney Int, 1999, 55: 1057-1062.
[18] Hammermeister KE, Burchfiel C, Johnson R, et al. Identification of patients at greatest risk for developing major complications at cardiac surgery[J]. Circulation, 1990, 82(suppl IV):380-389.
[19] Kurki TSO, Kataja M. Pre-operative prediction of postoperative morbidity in coronary artery bypass grafting[J]. Ann Thorac Surg, 1996, 61: 1740-1745.
[20] John R, Choudhri AF,Weinberg AD, et al. Multicenter review of pre-operative risk factors for stroke after coronary artery bypass grafting[J]. Ann Thorac Surg, 2000, 69: 30-36.
[21] Zamora JL, Burdine JT, Karlberg H, et al. Cardiac surgery in patients with end-stage renal disease[J]. Ann Thorac Surg, 1986, 42: 113-117.
[22] Samuels LE, Sharma S, Morris RJ, et al. Coronary artery bypass grafting in patients with chronic renal failure: a reappraisal[J]. J Card Surg, 1996, 11: 128-133.
[23] Rostand S, Kirk K, Rutsky E, et al. Results of coronary artery bypass grafting in end stage renal disease[J]. Am J Kidney Dis, 1988, 12: 266-270.
[24] Peper WA, Taylor PC, Paganini EP, et al. Mortality and results after cardiac surgery in patients with end-stage renal disease[J]. Cleve Clin J Med, 1988, 55: 63-67.
[25]Opsahl JA, Husebye DG, Helseth HK, et al. Coronary artery bypass surgery in patients on maintenance dialysis: long-term survival[J]. Am J Kidney Dis, 1988, 12: 271-274.
[26] Effect of a rapid intra-arterial infusion of dextrose 5% prior to coronary angiography on frequency of contrast-induced nephropathy in high-risk patients. Clavijo LC, Pinto TL, Kuchulakanti PK[J]. Am J Cardiol, 2006, 97(7):981-983.
[27]Chronic kidney disease in patients with non-ST-segment elevation acute coronary syndromes. Han JH, Chandra A,Mulgund J, Roe MT[J]. Am J Med, 2006, 119(3):248-254.
[28] Bagshaw SM, Culleton BF. Contrast-induced nephropathy: epidemiology and prevention[J]. Minerva Cardioangiol, 2006, 54(1):109-129.
[29] Rahman M, Pressel S, Davis BR. Cardiovascular outcomes in high-risk hypertensive patients stratified by baseline glomerular filtration rate[J]. Ann Intern Med, 2006, 144(3):172-180.
[30] Keough-Ryan TM, Kiberd BA, Dipchand CS. Outcomes of acute coronary syndrome in a large Canadian cohort: impact of chronic renal insufficiency, cardiac interventions, and anemia[J]. Am J Kidney Dis, 2005, 46(5):845-855.
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。
















