第二章 肺部疾病的生物学基础
呼吸系统由呼吸道和肺两大部分组成,呼吸道包括鼻、咽、喉、气管和各级支气管。通常将喉以上的部分称为上呼吸道,喉以下的部分为下呼吸道。从气管到肺内的肺泡是一连续而反复分支的管道,只有肺泡能进行吸入空气与血液之间氧气和二氧化碳的气体交换(即呼吸功能)。自鼻至肺内的终末细支气管属导气部,呼吸性细支气管至肺泡属呼吸部。肺由肺实质(支气管树和肺泡)和肺间质(结缔组织、血管、淋巴管、淋巴结和神经)组成。
一、气管、支气管和肺脏的基本结构
(一)上呼吸道
上呼吸道包括鼻、口、鼻咽、口咽和喉,具有空气调节作用,如对吸入气进行加温和加湿等,同时还有净化空气、嗅觉和发声等作用。
鼻上皮大部分由假复层纤毛柱状上皮细胞组成,其间有杯状细胞、分泌性腺体,并有纤维固有层附着在骨膜上,而嗅觉区、鼻孔与前鼻甲间的区域、咽和会厌缺乏纤毛上皮细胞。鼻上皮表面被覆着浆液和黏液,而且血管床丰富,可湿化和加温吸入空气。由于上呼吸道各部位的横断面积不同,吸入气的线性速率可以发生相当急剧的变化,有利于鼻和咽部清除大部分吸入的尘埃和反应性气体。咽后的淋巴组织在身体与外部环境的重要结合处执行免疫处理的任务。
(二)气管、支气管
气管、支气管、叶支气管至段支气管分支后继续分支,形成小支气管、细支气管、呼吸性支气管、肺泡管至肺泡,为一种不对称的叉状分支结构,多者可达23级分支。气管直径随分支逐渐减少,但相应的横断面积却因分支数目增多而增加。在吸气状态下,管径大于2mm者称为大气道,包括叶、段支气管;管径小于2mm者为小气道,包括部分小支气管和细支气管等。小气道为膜性气道,管壁无软骨支持,具有气道阻力小和容易阻塞等特点,使吸入的气体均匀分布到所有的肺泡中。当小气道发炎和痰液阻塞时,或气道外压力大于气道内压力时,小气道极易闭合。阻塞性肺病,如慢性支气管炎、肺气肿等,病变多从小气道开始。气管和支气管的管壁均由黏膜、黏膜下层和外膜组成。
1.黏膜 由上皮和固有层组成。上皮表层几乎全由纤毛柱状上皮细胞构成,细胞呈粒状,顶端有指向管腔的纤毛,细胞间散在分布着杯状细胞,两种细胞的比例约为5∶1。在气管隆突部和一些次级分叉部,可由鳞状上皮替代纤毛上皮。在细支气管和肺泡管的分界处,Clara细胞取代杯状细胞。在黏膜的基膜上可见到卵形的基底细胞,呈散在单行排列。黏膜内有刷细胞、淋巴细胞、白细胞和肥大细胞。固有层为疏松结缔组织,纵向排列的弹性纤维,并可见血管、淋巴管、弥散淋巴组织及浆细胞、淋巴细胞、粒细胞等。
(1)纤毛细胞(ciliated cell)。被认为是基底细胞或分泌细胞分化成熟的最后阶段。细胞呈柱状,核卵圆形,位于细胞中部。每个细胞的游离面约有200~300根排列整齐的纤毛,每平方厘米上约有15亿~20亿根纤毛,纤毛之间有稀而短的微绒毛。在气管内纤毛长为6~8μm,到终末细支气管缩短为4~5μm,直径约为0.3μm,基部较粗,连于顶部胞质中的基粒(basal body),顶端渐细。细胞核位于胞质的基部,其上有高尔基复合体,细胞上部富含线粒体。纤毛的轴心胞质中含有纵行微管,核周有溶酶体和板层小体。纤毛由微管蛋白、动力蛋白和连接蛋白等组成,其中动力蛋白是一种大分子的A TP酶。每个动力蛋白每秒可分解11~35个A TP,产生的能量引起相邻周围微管间的相对滑动,使纤毛发生每分钟约1 000次有节律的单向摆动。纤毛摆动时,同列纤毛同步,并与相邻行列纤毛的运动时相不同,整片纤毛运动时前后协调,将上皮表面的黏液连同黏于其上的颗粒物质推移至喉头排除。纤毛的转运率从在大气道处的20 mm/min到小气道处的1 mm/min不等。呼吸道黏液层实际上由不相混合的两层组成,下层为溶胶层,分布于纤毛周围,为低黏度的水样液,较厚,为纤毛摆动的场所,起润滑层作用,使黏液在纤毛的尖端部位进行运送;上层为黏弹性凝胶层,薄而黏稠。纤毛细胞不尚有分泌功能,其离子泵吸收管腔内的钠和水,向管腔排泌氯化物,从而控制黏液层的厚度及黏度。纤毛的运动还需要合适的温度、湿度与酸碱度,空气中某些有害因子如二氧化硫、甲醛、氨及吸烟等均可影响纤毛运动,严重时可使纤毛遭广泛破坏乃至消失。病毒和细菌感染可引起纤毛细胞内的线粒体肿胀、变性,使纤毛运动减弱。卡塔格纳(Kartagener)综合征患者的纤毛细胞不能合成动力蛋白,使纤毛丧失运动能力,常导致支气管扩张和感染。慢性支气管炎和支气管扩张时,纤毛数目减少,黏液分泌过量,可使纤毛运动失效。
(2)黏液细胞(mucous cell)、杯状细胞(goblet cell)和黏液腺。人类气管的表面上皮中杯状细胞的含量为6 000~7 000/mm2,支气管分支越细,杯状细胞数目越小,至细支气管时黏膜仅为一层纤毛细胞和极少的杯状细胞。杯状细胞基部细长,上部膨大,核近基部,核周有少量嗜碱性胞质,顶部胞质中富含酸性黏蛋白。细胞基部胞质中富含粗面内质网和游离核糖体,核上区有发达的高尔基复合体,胞质顶部含有大量粗大的黏原颗粒,游离面有短而稀的微绒毛。正常情况下杯状细胞与黏液腺一起分泌黏液,每日10~100 ml。黏液层能吸附吸入空气中的颗粒物质,然后通过纤毛的摆动,与黏液一起被推向咽部排出。杯状细胞的分泌活动受副交感神经和多种介质的调控和影响。慢性支气管炎病人的气管和支气管上皮可出现杯状细胞区域性增生和黏液分泌亢进,甚至增加到10 000/mm2。多种致敏原引发的气道过敏性炎症和感染性炎症过程中产生的多种介质,如组胺、白细胞介素4(IL-4)、激肽等,均可与杯状细胞膜上相应的受体结合,引起增殖和分泌亢进。阿托品抑制分泌,造成黏膜干燥,抑制纤毛活动,增加黏液层的稠度。
(3)浆液细胞(serous cell)。可在人类和多种动物的表面上皮中发现。胞内含有大量的粗面内质网和直径约为600 nm的颗粒,部分含有中性黏蛋白,一些还含有非黏液样物质。上皮中的浆液细胞和黏液下腺中的形态相似。在健康小鼠中,浆液细胞约占支气管上皮细胞的20%~30%,当暴露于烟草刺激时会转变成黏液细胞。
(4)刷细胞(brush cell)。数量少,细胞呈柱状,游离面有排列整齐而密集的微绒毛,形同刷状,锥体形核位于近基部,核上方可见高尔基复合体,滑面内质网较发达,并可见粗面内质网、溶酶体、微丝、糖原颗粒等,顶部胞质中有基粒和许多吞饮小泡,细胞基部常与神经纤维末端形成突触。刷细胞的功能至今仍不清楚,通常认为有:①吞饮功能,参与黏液的清除;②为未成熟的纤毛细胞;③是一种化学感受器。
(5)基底细胞(basal cell)。细胞较小,呈锥体形,细胞质较少,其中含有对细胞角蛋白具有细胞反应性的单丝结构。基底细胞位于上皮的基部,是一种未分化细胞,能分裂、分化成其他上皮细胞以补充因老化或损伤死亡的上皮细胞。主要见于大气道,但直至细支气管水平仍可见到基底细胞。
气道上皮更新较慢,通常仅有不足1%的细胞处于分裂状态。但有害刺激,如烟草刺激存在时分裂明显增加,主要是基底细胞和有分裂能力的分泌细胞。当损伤后上皮部分脱落时,基底细胞将发挥修复作用,在20min内迅速覆盖暴露的基膜,建立细胞间连接,形成完整的保护性屏障。基底细胞通过桥粒与纤毛柱状上皮相连,通过半桥粒与基膜相连,从而将柱状上皮黏附在基膜上,而柱状上皮与基膜之间无桥粒或半桥粒结构,因此基底细胞可以加强柱状上皮与基膜黏附作用。
(6)Clara细胞。Clara细胞是细支气管上皮的无纤毛细胞。在人类和家兔中仅见于末端细支气管,而在其他动物如小鼠中可以一直延伸到鼻腔。其胞体为柱状,细胞顶部呈圆顶形突向管腔,游离面有少量微绒毛。胞核椭圆形,位于细胞中部。核下胞质中线粒体较多,粗面内质网发达,核上区高尔基复合体明显,顶部胞质中可见滑面内质网和许多直径约为500~600nm的圆形分泌颗粒。Clara细胞可能产生表面活性物质中的低密度成分,参与正常小气道薄层浆液的产生,参与化学沉积物的解毒,调节气道的免疫和炎症反应。另外还可产生一种Clara细胞特有的分泌性蛋白(Clara cell secretory protein,CCSP),分子量差别很大,从10×103到200×103不等,其中分子量10×103的CCSP能激活基质中成纤维细胞和平滑肌细胞合成Ⅰ型和Ⅲ型胶原,而分子量16×103的CCSP则能抑制成纤维细胞的趋化活性。缺乏分子量16×103的CCSP是肺部纤维化的主要因素之一。人的周围气道表面还发现一种物质,即抗白细胞蛋白酶,它似乎也来源于Clara细胞,对多形核白细胞蛋白酶有强大的抑制作用。Clara细胞还能产生蛋白酶抑制剂,产生细支气管毒性物质的结合蛋白。Clara细胞还可能参与远端传导气道液体和电解质的调节。此外,Clara细胞是基底细胞和黏液细胞较少的小气道中的主要的干细胞,可再生自身及支气管上皮,参与细支气管上皮受损后的再生与修复。同时Clara细胞还显示了细胞色素P-450依赖性的氧化酶系的活性,可对多种药物和外来有毒物质,如致癌物等进行生物转化,使之减毒或易于排泄。
(7)神经内分泌细胞(neuroendocrine cell,NE)。又称小颗粒细胞(small granulated cell),常单个散布于整个呼吸道的黏膜上皮中,或4~10个成串出现,称为神经上皮小体(neuroepithelial bodies,NEBs)。细胞呈锥体或卵圆形,基部贴于基膜,顶部尖窄形成一条细长的突起直达腔面,细胞顶端可见短小的微绒毛,与相邻的上皮细胞间有桥粒、紧密连接等连接形式。胞体和突起中均含有细小(70~150nm)的嗜银颗粒,颗粒均有单位膜包裹,中心电子密度高,与被膜间有一浅晕。颗粒内含有5-羟色胺、铃蟾肽、降钙素、脑啡肽、促胃液素等生物胺类和肽类活性物质。大多数学者认为肺的神经内分泌细胞属于APUD(amine precursor uptake and decarboxylation)系统,其分泌物可通过旁分泌作用,或经血液循环,参与呼吸道血管平滑肌的收缩,调整腺体的分泌和纤毛摆动,以及周围上皮细胞的增殖与分化活动。NE细胞的内含物和其在上皮表面的分布使其对缺氧特别敏感,可以释放血管活性物质,使血管收缩和血液重新分布。在石棉肺的动物模型、先天支气管肺发育不良和支气管肿瘤的病人中,NE肥大增生。大部分NE细胞受胆碱能神经末梢的支配,乙酰胆碱参与其分泌物质,特别是生物胺的释放,因此胆碱酯酶活性与这些细胞的功能有关。
(8)其他细胞。其他仍有一些非纤毛细胞不能明确分类。另外在正常的上皮中存在一些细胞具有以上两种或两种以上细胞的过渡特点,这些细胞的研究可能有利于对肿瘤发生的了解。
2.黏膜下层 为疏松的结缔组织层。纤维较固有层粗疏,纵行成束沿黏膜皱襞分布,并与黏膜以及纤维软骨层中的软骨和环形弹性纤维相连接。在细支气管中,弹性纤维向外与肺泡的弹性纤维相连。黏膜下层含有血管、淋巴管、神经、淋巴组织、少量的浆细胞和较多的混合腺体。浆细胞合成的Ig A和J链进入上皮后,与上皮细胞合成的分泌片(secretory component)结合成分泌性的SIg A,释入上皮表面的糖衣内,能破坏或抑制外来抗原和某些细菌、病毒。当缺乏SIg A时,易发生呼吸道感染。
混合腺由浆液性腺泡、黏液性腺泡和混合性腺泡构成。浆液性腺泡的腔较小,由锥体形的浆液性腺细胞组成,核呈圆形,近基底,着色浅,基部胞质嗜碱性强,顶部胞质中可见嗜酸性的酶原颗粒。黏液性腺泡的腺腔较大,由黏液性腺细胞构成,胞体呈锥体形,胞核扁小,紧贴细胞基部,着色较深,胞质中含黏多糖,H E染色时常被溶解,故着色浅呈泡沫状。黏液性腺泡分泌黏稠的中性黏多糖;混合性腺泡由黏液性腺细胞和浆液性腺细胞构成,以黏液性腺细胞为主,浆液性腺细胞常聚集成半月形位于腺泡的末端。混合腺分泌的黏液主要含酸性和中性多糖,此外还有白蛋白和球蛋白,尚有一些特殊抗体、溶酶体和转移因子的存在,说明可能有非特异性免疫功能。混合腺腺体的分泌除源于直接刺激外,还可由迷走神经反射诱发。乙酰胆碱可使黏液腺分泌,但对杯状细胞无影响。阿托品可减少黏液腺体的分泌。慢性支气管炎病人的混合腺(主要是黏液腺泡)肥大、增生、黏液分泌亢进及纤毛运动的减弱,使大量黏液潴留于管腔中,引起支气管扩张和管壁增厚。黏液还可能覆盖在入侵细菌的表面,阻碍抗体的防御作用。另一方面,当气管造口术后,黏液不足或气道过分干燥,以致黏液层干枯,也可阻碍纤毛的有效功能。
3.外膜 外膜由透明软骨环和纤维组织构成。软骨环呈“C”形,缺口位于背侧,由环行和纵行排列的平滑肌束和结缔组织连续,构成膜壁。人类气管有16~20个软骨环,左侧支气管为7~8个,右侧支气管为3~4个。软骨环起支持作用,使管腔保持通畅。平滑肌收缩时,气管管径变小。在4~5级以下的较小支气管中,软骨则由不规则的软骨片所代替,随支气管树深向边缘部分,支气管中的软骨片渐小,细支气管壁内不再有软骨存在,外膜平滑肌渐呈纵行排列,如螺旋状。当平滑肌收缩时,支气管变狭、变短。细支气管无黏液腺,仅由一层纤毛上皮构成,偶见杯状细胞。终末支气管由上皮覆盖。呼吸性支气管则因有肺泡开口于其上,仅部分由上皮覆盖。正常呼吸情况下,由于肺内支气管周围的肺组织含有弹性纤维及软骨结构,气道不会塌陷。不连续的软骨环为肺内支气管提供支持的同时允许其收缩。
平滑肌细胞呈梭形,两端尖细,中间含核部分较粗,核呈椭圆形或杆状,细胞收缩时,核常扭曲成螺旋形。细胞质中充满肌丝、中间丝和密体。中间丝组成平滑肌细胞的骨架,呈斜向十字交叉排列,交织成菱形网架,其交叉处为密体,中间丝两端附着于胞膜处为密斑。粗肌丝由肌球蛋白组成,游离于胞质中。细肌丝由肌动蛋白、原肌球蛋白和钙调素构成,其一端附着于密体或密斑,一端游离于胞质中。大约有12~15条细肌丝呈花环状围绕一条粗肌丝,组成一个肌丝单位。胞核两端各有一个锥体形的无肌丝区,其中可见少量线粒体、粗面内质网和高尔基复合体等细胞器。在豚鼠和狗的呼吸道中,平滑肌纤维是各自分开的。而在人类的平滑肌丝间有许多连接,使得平滑肌在接受电偶时可以同时收缩。穿过气道平滑肌的神经主要从外膜进入,并在通过气道肌肉以前发出分支到神经节。平滑肌除受自主(植物)神经支配外,也可在许多化学介质如前列腺素、5-羟色胺、组胺、缓激肽等作用及机械性刺激下引发收缩。在哮喘病人的大气道和小气道以及慢性阻塞性肺疾患(chronic obstructive pulmonary disease,COPD)患者的小气道中平滑肌的含量明显增加。
呼吸道的软骨由弹性软骨和透明软骨构成,主要分布于鼻、喉、气管和支气管壁,起气道支撑作用。软骨所含的原纤维成分为Ⅱ型、Ⅺ型和Ⅸ型胶原分子,也可能存在Ⅵ型和Ⅹ型胶原分子,弹性软骨还含弹性纤维。软骨由细胞和细胞间基质组成,分别占组织体积的5%~10%和90%~95%。除了胎儿和刚出生的婴儿外,软骨不含血管、神经纤维和淋巴管。呼吸道软骨外被含有血管和神经的致密纤维丰富的胶原结缔组织层所包裹。软骨细胞主要通过弥散和对流过程获得营养。
(三)肺
肺位于胸膜腔内、纵隔的两侧,是有弹性的海绵状器官,形似圆锥形,上端称肺尖,下端称肺底,内侧面称纵隔面,外侧面称胸肋面。成年人两侧肺最多可容纳5~6L空气,男性肺重量约为850g,女性重量约为750g。肺表面有光滑、湿润而有光泽的胸膜脏层,在两肺内侧肺门处反折与胸膜壁层延续。胸膜表面光滑润泽,便于肺在胸腔内的扩张与收缩。肺内侧的纵隔面上有一凹陷,叫肺门,是支气管、血管、淋巴管和神经出入肺之处。肺的表面可见大小不等的多边形肺小叶的轮廓,由每个细支气管及其所属的分支构成,底部呈多边形,每边长约1.0~2.5cm,朝向表面,肺小叶的尖端朝向肺门,小叶间有结缔组织分隔。每个肺叶含有50~60个肺小叶,是肺的结构单位,小叶性肺炎即发生于此。肺分实质和间质两部分,实质为肺内支气管的各级分支和其末端的肺泡,90%的肺容量由气体交换区或肺实质组成;间质为肺内的结缔组织、神经、血管和淋巴管等。左肺借斜裂分为上、下两叶。右肺借斜裂和右肺副裂(水平裂)分为上、中、下三叶。支气管自肺门入肺后反复分支,其末端膨大为肺泡。支气管在肺内的分支为小支气管,其内径为2~3mm。随着不断分支,管径逐渐变细,当内径为1mm左右时称细支气管,内径为0.5mm时称为终末细支气管。从肺叶支气管至终末细支气管属肺的导气部;终末细支气管以下的分支属肺的呼吸部。肺泡管几乎完全是气泡性的,每个肺泡都有一上皮层,由Ⅱ型肺泡细胞和Ⅰ型肺泡细胞组成。上皮像个筛子,筛孔大小为0.5~0.6nm。肺泡上皮细胞间有紧密连结以防液体从循环中漏入肺泡。此外,肺泡内还有来源于骨髓而起吞噬、清除颗粒和细胞碎片作用的肺泡巨噬细胞(alveolar macrophage,AM)。
1.肺的导气部 包括肺内的小支气管、细支气管和终末细支气管,为一连续的管道,结构近似,无明确界线,随着不断分支,管径渐细,管壁渐薄,结构渐趋简单。
(1)小支气管。管壁结构类似于支气管,由黏膜、黏膜下层和外膜构成,但管径渐细,管壁渐薄。黏膜上皮为假复层纤毛柱状上皮,固有层较薄,杯状细胞渐少,结缔组织中的纵行弹性纤维紧贴基膜。黏膜下层中多为混合腺,腺体渐少。外膜由不规则的软骨片和结缔组织构成,软骨渐少,平滑肌相对增多,软骨片间出现环行或斜行排列的平滑肌束,并可见支气管动、静脉的分支。慢性支气管炎患者,其小支气管壁的软骨片可发生不同程度的萎缩变性,支撑能力减弱,甚至可发生塌陷或折叠,形成肺气肿。
(2)细支气管(bronchiole)。上皮由假复层纤毛柱状上皮逐渐过渡为单层纤毛柱状上皮,杯状细胞和黏膜下的混合腺逐渐减少。黏膜呈纵向皱褶,外膜中的软骨片亦逐渐减少变小,而平滑肌相对增多,逐渐形成环行肌束围绕管壁。
(3)终末细支气管(terminal bronchiole)。上皮由单层纤毛柱状上皮逐渐变成单层立方上皮,无杯状细胞、腺体和软骨,平滑肌已形成完整的环形,上皮内除少量纤毛细胞外,大部分为无纤毛的Clara细胞。细支气管和终末细支气管的环行平滑肌受自主神经支配,调节进出肺泡的气流量。由于管壁没有软骨支撑,平滑肌的舒缩对管径变化的影响更大。某些药物或过敏等病理情况可使管壁平滑肌发生痉挛性收缩,使气道阻力增加乃至堵塞,造成呼吸困难。
2.肺的呼吸部 包括呼吸性细支气管、肺泡管、肺泡囊和肺泡。它们均含有肺泡,能进行气体交换,故称为呼吸部。
(1)呼吸性细支气管(respiratory bronchiole)。是导气部向呼吸部过渡的管道,每个终末细支气管分出2~3支呼吸性细支气管,其起始部内径在0.5 mm以下,管壁因有肺泡开口而不完整。上皮细胞由单层柱状纤毛上皮延续为单层立方上皮,到肺泡管时,管壁完全由肺泡上皮覆盖。立方上皮细胞的胞质内可见多泡体和板层小体,它是肺泡Ⅱ型上皮细胞的前身。上皮下方为薄层结缔组织和分散的平滑肌束。
(2)肺泡管(alveolar duct)。每个呼吸性细支气管可分支形成2~11个肺泡管,平均内径为0.1 mm左右,是由许多肺泡围成的管道,其自身的管壁结构很少,只存在于相邻肺泡开口之间的部分,此处有少量的环行平滑肌和弹性纤维,故在肺泡管的断面上,可见相邻肺泡开口处的肺泡隔呈结节状膨大,管壁上皮为单层立方上皮。肺泡管是肺内最后具有平滑肌的管道,肌纤维的舒缩可改变肺泡口的直径,以调节进出肺泡的气量。
(3)肺泡囊(alveolar sac)。与肺泡管相续,每个肺泡管分支形成2~3个肺泡囊,是多个肺泡的共同开口,切面上常呈梅花形。其结构与肺泡管相似,但肺泡开口间无结节状膨大,也不含平滑肌,单层扁平上皮下只有少量结缔组织,肺泡囊的相邻肺泡之间为结缔组织构成的肺泡隔。人体大约有800万个肺泡囊。
(4)肺泡(pulmonary alveoli)。是支气管树的终末部分,为圆形或多边形的薄壁囊泡。平均直径为250μm,重力作用使上部肺泡的直径大于下部肺泡,可开口于肺泡囊、肺泡管和呼吸性细支气管。成人共有约3亿个肺泡,总面积约为70~80 m2。肺泡的舒缩变化大,深呼气时总面积仅为30 m2,深吸气可达100 m2。肺泡是肺内唯一能进行气体交换的结构,壁很薄,表面衬以单层上皮。相邻肺泡间的结构为肺泡隔。肺泡内主要含有5种细胞成分:Ⅰ型和Ⅱ型肺泡上皮细胞主要覆盖于肺泡上皮的表面;肺内皮细胞约占肺实质细胞成分的30%;间质细胞是肺泡壁结缔组织的来源,形成肺泡壁的支架结构;而肺泡巨噬细胞是肺部防御和清除机制的主要组成部分。
1)肺泡上皮:由扁平的Ⅰ型上皮细胞和立方形的Ⅱ型上皮细胞组成。
(i)Ⅰ型肺泡上皮细胞(typeⅠalveolar cell):Ⅰ型上皮是薄的鳞状上皮,平均表面积为5 000μm2,细胞大而扁平,形似荷叶,含有非常稀薄的细胞质,平均厚度仅为0.2μm。其结构简单,胞核小而致密,呈扁圆形,核周胞质中有少量较小的线粒体、高尔基复合体和散在的内质网,周边部的胞质中可见较多的吞饮小泡和散在的微丝、微管,细胞间边缘彼此相连重叠,或为紧密连接,亦可通过紧密连接与Ⅱ型肺泡上皮细胞相连,可以使液体、分子和离子等通过。另外通过胞饮作用使大分子物质等自肺泡腔到间质或和间质液体一起到达局部淋巴管。上皮下有一层基膜,可与邻近的毛细血管内皮、基膜融合为一,为肺泡腔内与毛细血管血流内气体交换的场所。因为气体易于通过,液体不易由血管内向肺泡腔渗出,也称血液空气屏障。Ⅰ型肺泡上皮细胞覆盖了肺泡93%的表面积,其分化程度高,无分裂增生能力,很容易受损伤,主要由Ⅱ型肺泡上皮细胞修补或转化为Ⅰ型细胞。
(ii)Ⅱ型肺泡上皮细胞(typeⅡalveolar cell):又称分泌细胞,胞体较小,呈圆形或立方形,散布于Ⅰ型肺泡上皮细胞之间,主要分布于肺泡角处,数量约为Ⅰ型肺泡上皮细胞的两倍,但仅覆盖肺泡表面的7%左右。细胞突向肺泡腔,游离面有丰富的微绒毛,尤以细胞周边部为多。核圆形位于细胞中央,胞质着色浅,常有空泡。胞质中富含线粒体、粗面内质网、游离核蛋白体,高尔基复合体较发达,核上区的胞质中有嗜锇板层小体(osmiophilic multilamelar body)和多泡体。嗜锇板层小体呈球形,直径为0.2~1.0μm,颗粒内有呈同心圆或平行排列的板层结构,内含有丰富的磷脂质、黏多糖与蛋白质。部分板层小体存在于细胞的游离面,贴附于游离面的细胞膜,在该处形成破口排出内容物。分泌物在肺泡表面形成一层薄的液膜,就是肺表面活性物质。表面活性物质可降低肺泡的表面张力,防止肺泡萎陷,稳定肺泡直径。Ⅱ型细胞有4个主要功能:①分泌表面活性物质。②作为离子泵,通过细胞顶部的钠通道,使液体从肺泡腔进入间质腔,同时水随钠的运动被动吸收。③修复肺泡损伤。Ⅱ型细胞是肺泡上皮的祖细胞,可再生为Ⅰ型上皮细胞。④控制肺泡炎症。Ⅱ型细胞分泌抗炎因子、抗氧化剂,包括细胞外超氧化物歧化酶,还可通过激活一氧化氮合酶分泌一氧化氮。现在已知Ⅱ型细胞也具有产生释放细胞因子,如单核细胞趋化因子(monocyte chemoattractant protein,MCP)等的功能。新生儿呼吸窘迫综合征(infant respiratory distress syndrome,IRDS)即因Ⅱ型细胞不成熟,不能产生和分泌足够的肺表面活性物质而发病,急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)的发病过程亦与表面活性物质的不足有关。
2)肺泡隔(alveolar septum):相邻肺泡之间的薄层结缔组织构成肺泡隔,属肺的间质,内含密集的毛细血管网。毛细血管为连续型,内皮甚薄、无孔,厚度仅为0.1~0.2μm,内皮为扁平上皮细胞,胞质内含较多吞饮小泡和少量细胞器。肺泡隔内含有丰富的弹性纤维及少量胶原纤维和网状纤维,这些纤维常呈网络状或薄板状排列,作为肺泡和毛细血管的支架。老年人因弹性纤维退化,肺泡回缩能力减弱,易发生肺气肿;炎症发生时可破坏弹性纤维而使肺弹性减弱,肺泡扩大而导致肺气肿。肺泡隔内还含有成纤维细胞、巨噬细胞、浆细胞和肥大细胞以及淋巴细胞和神经纤维。肺泡隔内的毛细血管大多紧贴肺泡上皮,上皮基膜与内皮相互融合,少数部位的肺泡上皮与毛细血管内皮之间有少量结缔组织。
3)肺泡孔(alveolus pore):是相邻肺泡间相互通连的小孔,当肺扩张时其直径可达10~15μm。肺泡孔位于肺泡隔毛细血管网眼中,孔周围的肺泡壁完整,上皮下有少量弹性纤维环绕。每个肺泡约有1~7个肺泡孔,是相邻肺泡间平衡压力的通道,当某个终末细支气管或呼吸性细支气管阻塞时,肺泡孔起侧支通气作用。但在肺感染时,病菌也可通过肺泡孔扩散,使炎症蔓延。
4)气-血屏障(air-blood barrier):肺泡腔与毛细血管腔之间的结构是气体交换必经的结构,组织学上称为气-血屏障,或称为呼吸膜(respiratory membrane)。主要由Ⅰ型肺泡细胞、基膜、毛细血管内皮的基膜和内皮细胞4层构成,厚度约为0.5μm,间质性肺炎时,肺泡隔结缔组织水肿,炎性细胞浸润,可致肺气体交换功能障碍。
(5)肺炎症免疫细胞。正常肺的炎症免疫细胞主要见于肺间质,偶尔见于上皮表面,分单核吞噬细胞和淋巴细胞两大类。肥大细胞也属此类,但它是即刻型超敏反应的效应细胞。此外,在肺炎症过程起重要作用的还有中性粒细胞、嗜酸性粒细胞、嗜碱性粒细胞、血小板。这些细胞都是可移动的细胞,尤其是肺泡巨噬细胞在肺的炎症、免疫反应中起着极为重要的作用。
1)肺泡巨噬细胞:广泛分布于肺内各处,起源于骨髓的幼单核细胞,经血流到达肺内后,发育成熟并转化成巨噬细胞,部分巨噬细胞在肺内进行复制。人肺巨噬细胞直径为20~40μm,形态不规则,常有伪足突起,胞核卵圆形或肾形,着色较深,胞质丰富,呈嗜酸性,胞质中含有丰富的溶酶体,它高速耗氧并分泌中性蛋白酶,比其他组织的巨噬细胞更活跃。细胞表面有发达的微皱褶和突起,胞质中含有丰富的各级溶酶体、吞噬体、吞饮小泡、微丝、微管,此外还含有一些粗面内质网、滑面内质网、高尔基复合体、线粒体等细胞器。
肺泡巨噬细胞具有活跃的吞噬功能,可以吞噬表面活性物质,同时参与许多肺泡外成分的代谢。肺泡巨噬细胞能吞噬进入肺内的细菌、尘粒等异物和衰老死亡的细胞,并将它们分解、消化、清除,调理素可以通过与细胞表面受体的结合而加强此过程。此外,肺巨噬细胞还具有抗肿瘤作用,是机体防御功能的一道重要防线。当心力衰竭肺淤血时,大量红细胞穿过毛细血管进入到肺泡隔被巨噬细胞吞噬,细胞质内含许多血红蛋白的分解产物——含铁血黄素颗粒,此种肺巨噬细胞又称心力衰竭细胞。吞噬了尘粒后的肺巨噬细胞称尘细胞(dust cell)。
正常情况下,巨噬细胞的寿命为7天,吞噬异物的巨噬细胞大部分逆行进入细支气管腔内,通过纤毛的摆动,随黏液排出体外,小部分进入肺间质或淋巴管。吞噬了某些有毒颗粒,如二氧化硅(SiO2)的肺巨噬细胞,在间质和淋巴管内运行的过程中,逐渐肿胀死亡。细胞崩解后释出的矽粒吸引更多的肺巨噬细胞,使之集结并吞噬矽尘。死亡的巨噬细胞还能释放一种致纤维化因子,刺激成纤维细胞大量增生,形成肺硅沉着病(矽肺)特有的结节状纤维化病灶。近年来的研究证明,肺巨噬细胞在病理性的过度集结和被激活的状态下,能释放多种生物活性物质如活性氧、白细胞介素-1、血小板衍生生长因子(platelet-derived growth factor,PDGF)、前列腺素、白三烯-C、血纤维蛋白酶激活因子、弹性蛋白酶和胶原酶等,在许多肺部疾病的发病中起十分重要的作用。肺泡巨噬细胞可以和肺部淋巴细胞相互作用,接受抗原刺激的T细胞释放的淋巴因子的刺激后,通过细胞表面的免疫球蛋白和补体受体发挥抗原递呈作用及辅助细胞作用,但此作用较弱,肺部主要的抗原递呈细胞是树突状细胞。
2)肥大细胞(mast cell):广泛分布于肺间质中,尤多见于小支气管和细支气管黏膜的浅层。细胞表面有线性微绒毛,胞体呈圆形或卵圆形,直径为20~30μm,胞核较小,胞质中充满着异染性、水溶性的颗粒,直径为0.6~0.8μm,颗粒的表面均有膜包裹,其内部呈螺旋状、网络状或细颗粒状的多样结构形式。胞质中还可见到发达的高尔基复合体、稀少的游离核糖体、粗面内质网、散在的线粒体和大小不一的圆形脂质体。近胞膜处的胞质中可见微管和微丝网。
肥大细胞的异染颗粒内含有组胺、肝素、嗜酸性粒细胞趋化因子、中性粒细胞趋化因子、类胰蛋白酶、N-乙酰-β氨基葡糖苷酶等多种生物活性物质。被激活的肥大细胞还能合成白三烯、前列腺素、血小板激活因子、活性氧代谢产物等多种生物活性物质。当肥大细胞被激活时释放出这些物质,改变上皮和血管的通透性,造成炎症反应,吸引其他白细胞,使气道和平滑肌收缩,并激活其他一些效应细胞。在纤维性变的肺组织中,在纤维性间质中肥大细胞明显增加,他们通常在再生的上皮细胞如Ⅱ型细胞和细支气管立方细胞之间游走,通过将其胞质变长而通过上皮下基膜的间隙和上皮中的紧密连接,在游走过程中,肥大细胞发生活跃的缓慢脱颗粒。在吸烟者中肥大细胞占上皮细胞的比例亦明显升高。
3)其他炎症细胞:在健康肺中,中性粒细胞少见,但在肺部炎症时,中性粒细胞在肺部间隙明显增多,在趋化因子的作用下,中性粒细胞移进组织间隙并吞噬入侵的微生物,通过氧化介导的机制或通过细胞内颗粒包含的杀微生物蛋白杀灭微生物。淋巴细胞、树突状细胞等通常存在于肺部的上皮。上皮内的淋巴细胞主要功能是去除气道内的刺激性颗粒,同时气道促进肺脏免疫反应生物作用,在某些疾病如过敏性肺泡炎、结节病、结核病和胶原血管病中,其绝对计数增加。在COPD患者中,CD8+淋巴细胞数量增加。T细胞的免疫活化需要树突状细胞表面的MHCⅠ的表达,树突状细胞可以在上皮和局部淋巴结内移动。实验中发现大鼠中表皮内的树突状细胞的浓度为50~600/mm2。正常肺组织中无嗜酸性细胞,在超敏反应诱导的肺炎症中明显增加。嗜酸性粒细胞可合成并分泌强有力的炎症介质,如血小板激活因子和LTC4等,主要功能是抗寄生虫。
(6)肺间质。是介于肺泡壁间的结构,其结构基础是胶原纤维构成的网络支架,间质内为富含透明质酸的胶状液体,包括:①纤维系统,起机械支撑作用;②各种各样的细胞,具不同的功能;③与淋巴有关的某些游离细胞外液;④上皮和内皮基膜。主要作用是既将气腔上皮、血管内皮和胸膜间皮等细胞分开,又将它们结合成整体,同时作为骨架连接肺的其他部分。
肺泡壁的主要间质细胞群为成纤维细胞、成肌纤维细胞、平滑肌细胞、外膜细胞等,炎症(免疫)细胞包括淋巴细胞、肥大细胞和少数多形核白细胞以及间质巨噬细胞。间质基质由胶原、弹性纤维、蛋白多糖、基膜成分和各种各样的大分子组成。肺间质的弹性纤维由不定型的弹性蛋白和具有高度结构特点的微原纤维组成,纤维连接素可以促进细胞的粘连、移动、分化、吞噬和生长。肺泡壁的主要蛋白多糖是硫酸乙酰肝素、硫酸软骨素、硫酸皮肤素和透明质酸等。蛋白多糖影响肺的顺应性和水的平衡,影响细胞与基质的粘连以及细胞的增殖和移动,还参与肺发育的调节。基膜由细胞外基质形成,为一层很薄的膜,环绕上皮组织、周围神经、肌肉和血管。肺毛细血管在间质内蜿蜒前行,某些部位毛细血管壁和肺泡上皮基膜融合,其间无液体和其他组织结构,形成薄部,肺泡和毛细血管内的气体分子可以弥散通过,发生气体交换;而间质的其余部位,两者之间有较大距离,气体分子不易弥散通过,在有效循环障碍时肺间液体易积聚在此形成肺水肿,称为厚部。因为胶体分子对水有较大亲和力,肺间质内有较多液体积聚时,间质内的压力升高不明显。上皮和内皮基膜是连续的,可以调节某些分子通过气腔和从血液进入间质的过程,同时对微粒子、病原、恶性肿瘤转移细胞的侵害形成防御性屏障。此外,基膜还可刺激细胞的分化、形态发生和运动。
(四)肺血管
肺有两套供血系统,一套为肺循环,由肺动脉及其分支、毛细血管和肺静脉组成,接受全身各器官的静脉回心血,在肺内进行气体交换;另一套为体循环中的支气管循环,包括支气管动脉和静脉,是肺、气道和胸膜等的营养血管。肺循环与支气管循环之间通过动脉-动脉和静脉-静脉吻合支互相交通,因此当肺动脉分支阻塞时,其所支配的区域可由支气管动脉供血。
1.肺循环
(1)肺动脉。起自右心室,并由肺动脉主干分为左、右肺动脉。右肺动脉在右上叶支气管的前下方行进,而左肺动脉则在左上叶支气管的上方。当右肺动脉分出肺动脉前干,左肺动脉分出上叶动脉后即称右、左中间动脉。中间动脉再分出中叶和舌叶动脉,即为基底动脉,分布到下叶基底部。肺动脉与支气管树相对应逐渐分支,直到在肺腺泡分布的终末小动脉。终末小动脉分支为肺毛细血管,在肺泡间隔内形成毛细血管网。根据外径和结构特点,肺动脉通常可分为弹性动脉、肌性动脉和非肌性动脉。主肺动脉及其分出的直径大于1 mm的肺动脉为弹性动脉,动脉的内膜下有数层弹性组织,每层弹性组织间隙有平滑肌细胞,血管外层为疏松的纤维外膜,来自支气管动脉的滋养血管穿过外膜为肺动脉提供营养。直径在0.5~1.0 mm之间的肺动脉为弹性动脉和肌性动脉的过渡型,动脉弹性组织逐渐减少,最终仅残留内外两层弹力膜。直径为100~500μm的肺动脉为肌性动脉,血管有一单层内皮细胞,内外弹力膜之间包含血管平滑肌,内膜为内皮细胞和邻近的结缔组织,中膜为平滑肌和包绕的弹力膜,外膜为中膜外层的疏松纤维组织。除了与支气管树平行分支外,许多小肌性动脉分支直接进入肺实质。在成人,肌性动脉通常伴行于小气道、呼吸性细支气管、肺泡管和肺泡。直径小于100μm的小动脉随着不断分支和直径变细,平滑肌细胞完全消失,称为非肌性动脉。非肌性动脉的远端衍生出肺毛细血管。
(2)肺静脉。最小的静脉血管从肺泡导管的远端开始,为毛细血管后支,聚集成小静脉,在肺小叶周边部分进入小叶间隔,集合成为小叶间静脉,直径为20~30μm,最后逐渐聚合在肺门部,每侧形成两支主干,两侧上、下静脉干各以两支肺静脉注入左心房。最小的静脉血管仅含有一层内膜和一层基膜,随着血管直径的增加,血管壁中逐渐出现平滑肌和弹性组织。
(3)肺循环毛细血管。肺终末小动脉的分支进入肺泡隔内形成毛细血管,继而在肺泡内形成密集的毛细血管网,此毛细血管网平均直径约为10μm,壁较薄,有利于肺泡与血液间的CO2和O2的迅速交换。肺毛细血管迂回行进于肺泡隔的间质腔中,毛细血管间距离非常近,且多吻合支与动静脉短路,毛细血管床占肺血管表面积96%,且有相当大的延展性。毛细血管内皮主要由单层内皮细胞组成。内皮细胞间通过紧密连接相连,和气道上皮间连接相比,对大分子物质的通透性更强。血管内皮细胞和紧邻的肺泡上皮细胞均固定于相隔的基膜上。毛细血管周边约一半的内皮细胞基膜与肺泡上皮细胞基膜相融合,形成肺泡-毛细血管隔的薄部,为气体交换提供了最大的表面积和极短的扩散距离。毛细血管周边的另一半,两层基膜相互分开形成肺泡隔厚部,是肺液体和溶质跨毛细血管转运的主要部位。厚隔由各种胶原纤维、弹性蛋白和蛋白多糖组成。
肺毛细血管床是全身血管系统(体循环)的有效滤器。全身静脉系统的微血栓经肺过滤,可经肺脏的胞溶作用或网状内皮系统迅速清除。肺血管内膜表面的内皮细胞直接与血液接触,具有多种重要的生理功能,诸如物质交换、抗凝、促凝作用等。又通过代谢、转运和分泌体液因子在维持内环境稳定中起着重要作用,是激活或降解许多血管活性介质的关键场所。内皮细胞还通过表达细胞表面黏附分子调节吞噬细胞的功能。黏附分子与吞噬细胞表面的受体相互作用,促进吞噬细胞经过血管床移进相邻组织。内皮细胞可通过产生和释放内皮依赖性因子参与血管平滑肌舒缩活动的调节,分泌促进平滑肌细胞增殖的物质,使血管结构发生变化。内皮细胞的损伤与肺动脉高压、高血压、动脉粥样硬化等疾病的发生、发展有着重要的关系。
2.支气管循环
(1)支气管动脉。其起源部位和数量变异较大,一般起源于主动脉弓远端和胸主动脉腹侧,有时也从肋间动脉分出,供应支气管和直到呼吸性细支气管水平肺组织、脏层胸膜的营养,同时也供应肺动脉和肺静脉的滋养血管、纵隔结构和气管、支气管的淋巴结。支气管动脉从肺门附近进入肺,通常行走于支气管血管鞘内,在支气管周围的结缔组织中伴随支气管而分支,直到终末细支气管的远端。支气管动脉在支气管黏膜下层和支气管周围形成动脉丛,两者间有细小动脉通过支气管壁相连,动脉丛再分支形成细的毛细血管丛,以营养黏膜。支气管动脉的管径明显小于伴行的支气管或肺动脉,炎症病变时可明显扩张。支气管动脉有一层明显的内弹力膜,外弹力膜缺乏或模糊不清,中膜通常为丰富的平滑肌细胞。
(2)支气管静脉。分深浅两种,深支气管静脉起自肺内的细支气管、肺泡管的毛细血管网,并同肺静脉相吻合,最后形成一支,注入肺静脉或左心房。浅支气管静脉一般每侧有两支,引流肺外支气管、肺胸膜和肺内淋巴结的静脉血,也与肺静脉相吻合。右侧支气管静脉注入奇静脉,左侧一般注入副半奇静脉。来自支气管动脉的血液只有一部分经由支气管静脉流入体循环的静脉而入右心房,另一部分则经由肺静脉入左心房。正常时,通过肺毛细血管的侧支分流,即不通过气体交换的血量很少,当在肺纤维化、支气管扩张症、支气管肺癌等疾患时,肺动脉间的交通支明显增多。支气管扩张症时,由于扩张的支气管动脉系受体循环支配而压力高,一旦咯血常常量大且较为严重。
3.肺血管间的交通 肺循环与支气管循环的含血量显著不同,但两者的血流量却总是相平衡的,说明肺动、静脉与支气管动、静脉两种循环系统间,常有潜在性交通管道,能时相调节或相互补偿。肺脏有如下3种主要的交通。
(1)支气管动脉与肺动脉的交通。由于正常时肺动脉与支气管动脉间有着潜在的交通支,在支气管扩张、肺脓疡时交通支显著扩张。肺动脉有感染性血栓时,血液可从支气管动脉流入肺动脉,导致肺梗死;支气管动脉阻塞时,血液可从肺动脉流入其他支气管动脉而得到代偿,防止组织缺血坏死。
(2)支气管静脉与肺静脉的交通。正常时肺的支气管静脉与肺静脉间有交通支存在。正常情况下左心压力较高,支气管静脉血可流入右心。肺源性心脏病时,支气管静脉的血流可经交通支反流入左心,引起动脉血氧饱和度减低。二尖瓣狭窄时,左心压力增高,血液可由肺静脉反流入支气管静脉,进入右心。
(3)肺动脉与肺静脉的交通。在正常情况下,肺动脉与肺静脉的交通支,处于闭合状态。肺气肿、肺纤维化等引起肺动脉高压,右心血液可通过交通支进入左心,降低右心压力和动脉血氧饱和度。
(五)肺的淋巴
肺内淋巴组织丰富,肺淋巴管分浅、深两组,浅淋巴管位于脏层胸膜的深面,收集肺周围部的淋巴,行向肺门淋巴结。深淋巴管起于肺小叶间结缔组织和小支气管壁的淋巴毛细管网,收集肺深部淋巴,围绕支气管和肺血管形成深淋巴管丛,汇集成一些大的淋巴管进入肺门淋巴结。肺内的淋巴引流起始于肺间质厚部,淋巴管道最初起始为由内皮细胞包卷成的终囊,液体和蛋白质透过囊壁形成淋巴液。在间质内逐渐移行中,管壁上形成完整的基膜,同时管道上出现单向瓣膜,完成终囊到淋巴管的结构转变。在继续向肺门移行的过程中,管壁上逐渐出现平滑肌的环绕。在终囊的水平,较大淋巴管的蠕动使终囊内压低于间质内压,间质内的液体和蛋白质进入终囊形成淋巴液;在小淋巴管水平,肺通气造成肺间质内胶状液体的压力变动,在单向活瓣的协助下推动淋巴液向较大淋巴管流动;在较大的淋巴管内,平滑肌的舒缩造成管壁的蠕动,推动淋巴液的前行。淋巴管壁的平滑肌受自主神经调节。
在肺门、肺外支气管和气管旁有许多淋巴结。淋巴液经淋巴结之间的吻合支沿气管上行,在右侧经锁骨下静脉重新进入全身循环,在左侧经胸导管或左锁骨下静脉返回全身循环。右肺所有的淋巴液将进入右侧淋巴导管,左肺上部及部分中部经过气管旁淋巴结,进入胸导管,左肺其他部分的淋巴液流入右淋巴导管。肺内主要有4组淋巴结,包括叶、段、小支气管、小叶间隔处的胸膜下淋巴结。肺外淋巴结位于主支气管分叉处的隆突下区域,并沿主支气管气管壁分布。
(六)肺的神经
支气管及肺接受内脏运动神经和内脏感觉神经两类神经支配。内脏运动神经包括交感神经和副交感神经(迷走神经),主要调节气管、支气管与血管等的平滑肌的舒缩以及腺体的分泌。内脏感觉神经的末梢分布于气管及支气管的黏膜上皮、血管外膜和脏层胸膜,接受这些部位的感觉性冲动,调节咳嗽反射,对刺激性粉尘、气体及间质液体压产生反应。另外,传入神经释放的各种神经肽可调节气道张力、血管张力及气道分泌。
支气管及肺的交感神经即肾上腺素能神经纤维起自脊髓胸2~6节段的侧角,在胸上部交感干的颈神经节交换神经元,节后纤维在肺门与胆碱能神经混合组成肺丛,分布于支气管及肺。副交感神经为迷走神经,发自延髓内的迷走神经背核,分支参与组成肺丛,在肺内神经节交换神经元,节后纤维分布至肺。支气管的感觉神经起自支气管上皮、固有膜、支气管平滑肌以及软骨的感觉神经末梢,感觉神经细胞在颈部和胸部的迷走神经干内,感觉神经只到呼吸性细支气管。感觉系统沿迷走神经和胸交感神经节上行,主支气管处有受体介导咳嗽反射。小气道包含刺激物受体,可对刺激性气体、粉尘做出反应。
支配肺的迷走和交感神经在肺门部位形成肺丛进入肺组织后,沿支气管和血管的走向,在肺实质内延伸为支气管丛,随支气管分支的逐级变细,神经纤维亦相应减少。最后,末梢神经消失于细支气管平滑肌、肺泡管、肺泡囊。动脉神经丛走行在中膜内并延续至所有的肌性动脉;静脉神经丛一直延续至脏层胸膜甚至到达胸膜下的肺泡壁。肺泡壁有小的无髓鞘的神经纤维,数量极少,来源不清,代表为J(毛细血管旁)感受器。J感受器可对间质液体压及特定的化学物质作出反应,引起短暂的反射性的呼吸困难及浅快呼吸。
肺部主要的运动神经支配是副交感神经(胆碱能神经)。刺激迷走神经导致支气管收缩,黏液分泌增强。这些作用可被阿托品阻断。副交感神经来自肺内一级支气管迷走神经节内的神经突触。主要的支气管黏膜张力抑制剂是血管活性肠肽(VIP)。副交感神经元储存并释放VIP,VIP与乙酰胆碱可能存在于同一神经元。这样,同组神经元可能释放乙酰胆碱收缩气道平滑肌,并且释放VIP松弛气道平滑肌。
同时肺部还有第3条自主神经通路,即非肾上腺素能非胆碱能自主神经(NANC)。肺内主要的胆碱能神经起兴奋作用,起抑制作用的为肾上腺素能神经和NANC神经。在特定条件下,后两种神经可起兴奋作用。现已明确,NANC神经为肽能神经,末梢释放神经肽,主要由P物质(SP)、VIP、铃蟾肽、生长抑素、胆囊收缩素和内源性阿片肽等,VIP是支气管的强松弛剂,但对小气道作用甚微。
肺血管的神经支配尚有待进一步研究。在多数动物身上,肺动脉系统的肾上腺素能神经明显强于胆碱能神经。电刺激肺部神经既可引起血管收缩,也可引起血管舒张。肺小动脉是血管阻力的主要部位,肺静脉系统对调节肺血管系统阻力及容量方面也有一定作用,刺激动物交感神经可引起肺静脉收缩。
二、胸膜
胸膜是起源于中胚层的浆膜,由结缔组织上覆盖一层间皮细胞组成。间皮细胞间以紧密连接和桥粒相连,覆盖于肺表面和叶间裂的胸膜为脏层胸膜;覆盖胸廓内侧面的胸膜为壁层胸膜,两者汇合于肺门处,自肺门向下延伸为肺韧带。胸膜的脏、壁两层在肺根部互相反折延续,围成两个封闭的胸膜腔,腔内为负压。胸膜表面为连续的单层上皮,称为胸膜间皮,其下为起支撑作用的结缔组织,它们共同覆盖于胸膜腔的表面。
(一)脏层胸膜
脏层胸膜间皮下有一层薄的结缔组织和一层纤维层,最深层为一层含丰富血管的结缔组织并与其深处的小叶间隔相延续。当胸膜伸入右肺的上叶和中叶、中叶和下叶间,左肺的上、下叶之间时形成叶间胸膜。血运主要由支气管动脉支配,深处尚有少数肺动脉的分支支配,支配胸膜的动脉终端形成一毛细血管网。淋巴引流入肺淋巴结,脏层胸膜的神经来自肺丛,经肺门沿肺动脉的外膜、支气管周围和小叶间隔进入肺表面,属内脏感觉神经。
(二)壁层胸膜
壁层胸膜因为其贴附部位不同,可分为肋胸膜、纵隔胸膜、膈胸膜和胸膜顶4部分。肋胸膜衬附于肋骨及肋间肌内侧,其与肋骨和肋间肌之间有胸内筋膜存在,较易剥离。纵隔胸膜呈矢状位,贴附于纵隔两侧,其中部包绕肺根后移行于脏层胸膜。在肺根的下方,系于纵隔外侧面与肺内侧面之间的脏、壁胸膜移行部形成双层的胸膜皱襞,称肺韧带。膈胸膜覆盖在膈的上面,与膈紧密相贴,不易剥离。胸膜顶包被在肺尖的上方,突入颈根,高出锁骨内侧1/3段上方2~3cm,是由肋胸膜和纵隔胸膜上延至胸廓上口平面以上形成的穹隆状结构。
壁层胸膜无基膜,由间皮细胞直接覆盖在结缔组织之上。不同部位的胸膜的结缔组织层的成分和厚度不同,心包表面处的大部分是胶原纤维,而覆盖膈肌者以弹性纤维为主。壁层胸膜主要由肋间动脉和胸廓内动脉的分支分布,膈胸膜和纵隔胸膜由心包膈动脉和支气管动脉供应血液,静脉与动脉伴行,分别注入奇静脉、半奇静脉、副半奇静脉和头壁静脉等。壁层胸膜淋巴分别注入胸骨淋巴结、肋间淋巴结、膈淋巴结、纵隔前后淋巴结及支气管肺淋巴结。支配壁层胸膜的神经为肋间神经和膈神经,属躯体感觉神经。胸膜炎等疾患刺激神经引起的疼痛不仅可沿肋间神经向胸、腹壁放射,也可沿膈神经向颈部和肩部放射。
(三)胸膜腔及胸膜的隐窝
由于胸膜脏、壁两层在肺根和肺韧带处互相移行,在左、右两肺周围各形成了完全封闭的胸膜腔。胸膜腔内的压力低于大气压,腔内有少量浆液,以减少呼吸运动时胸膜脏、壁层间的摩擦。正常情况下,胸膜腔内负压及浆液的吸附作用使脏、壁胸膜紧密地贴在一起。但在壁层胸膜各部转折处,脏、壁胸膜之间有一定的间隙,称为胸膜隐窝(窦)。其中以肋胸膜和膈胸膜转折处与肺下外缘之间形成的肋膈隐窝最大且位置最深,即使深吸气也不能完全被肺所充满,因此,胸膜腔内的积液常蓄积于此。左侧肋胸膜与纵隔胸膜在前方的转折处与左肺前内缘(相当于肺的心切迹处)之间为肋纵隔隐窝,位于胸骨左侧第4~5肋间隙的后方。在左胸膜腔,膈胸膜和纵隔胸膜之间,由于心尖向左突出,而构成膈纵隔隐窝,一般较小。
胸膜腔内有1~20 ml液体,液体量取决于脏层、壁层胸膜内静水压、胶体渗透压、组织压的综合作用。液体主要来自壁层胸膜的毛细血管,经壁层胸膜的淋巴管重吸收。当肺毛细血管静水压增加、炎症导致蛋白泄漏、血管内胶体渗透压降低时,胸膜腔内液体增多。
胸膜由间皮细胞组成,形成单层粘连于基底层。这些细胞多为扁平,厚为1~4μm,周边呈多角形,也可见立方形或圆柱形,内含吞饮泡和粗面内质网。细胞表面有杂乱的微绒毛,长约为3μm,粗为0.1μm,随向肺底部的延伸而增加,脏层胸膜多于壁层胸膜,肋胸膜更少。微绒毛使与胸膜接触的细胞表面增加,因此液体吸收更容易,微绒毛表面的黏多糖可以减少摩擦。间皮细胞同时具有清除功能,因为在体外培养时具有吞噬作用。间皮细胞也是某些特异因子,特别是一些石棉纤维的靶细胞,导致胸膜间皮瘤。
正常间皮细胞更新率很低,各种炎症因子可使间皮细胞脱屑,间皮细胞更新率提高,目前认为可能由损伤区周围的正常间皮细胞增殖和扩展而成,也可能是由悬浮在胸腔积液中的脱落健康间皮细胞增殖而成。
间皮细胞合成和分泌各种细胞外基质成分,至少部分负责胸膜结缔组织基质的产生。体外实验显示间皮细胞产生Ⅰ、Ⅲ、Ⅳ型胶原,弹性蛋白,膜素和纤维连接素。间皮细胞还可能与胸液中部分透明质酸有关,后者参与呼吸时两层胸膜表面滑动的调节。
三、肺的生物化学过程
肺具有广泛的生化、代谢功能,可以影响全身各脏器,在机体免疫防御功能的维持和调节、肺部与全身某些疾病的发生中起重要作用。
(一)氧利用和能量产生
肺的主要生理作用是通过提供所需的氧,带走产生的CO2,以支持其他器官的中间代谢。然而肺细胞本身也利用氧,产生CO2,以适应它们的代谢需求。肺泡腔的大部分氧由血液摄取并输送到其他脏器,小部分直接为肺细胞所利用以供其氧化代谢之需。肺利用氧显著少于代谢上活跃的器官,只占肾皮质的22%,脑皮质的32%和肝的50%。能量供应主要通过有氧氧化即氧化磷酸化在线粒体内完成。肺脏的能量代谢可以分为3种方式:①化学方式。黏液、肺表面活性物质、胶原和弹性硬蛋白的合成。②机械方式。支气管和血管的肌肉收缩、纤毛摆动,巨噬细胞的吞噬、吞饮作用,黏液和肺表面活性物质的分泌。③渗透和浓缩。
(二)糖代谢
肺所进行的氧化代谢依赖于可代谢底物对细胞的供应,这一过程系通过血液所带营养的摄取和加工完成的。通常生理条件下,葡萄糖是主要的底物,各种碳源都可经肺代谢。虽然供氧充足,但肺内糖代谢的主要产物为乳酸。肺不以葡萄糖为主要供能物质,肺细胞内糖原很少,胰岛素对肺内糖代谢无明显调节作用,但肺内糖代谢的正常进行对肺功能的维持有重要意义,长期低血糖可引起肺水肿。约有20%的葡萄糖被氧化成CO2,10%转变成氨基酸,参与蛋白质的合成,30%~40%转换为乳酸,5%形成脂质。
磷酸戊糖途径在肺内的糖代谢中有重要意义,此过程产生的烟酰胺(尼克酰胺)二核甘酸磷酸(还原型辅酶Ⅱ,NADPH)主要用于生物合成反应,尤其是脂肪酸和表面活性物质的合成,而且在谷胱甘肽还原酶反应使谷胱甘肽由氧化型恢复到还原型过程中起辅因子的作用,有助于避免高浓度的氧或氧化剂对肺组织造成损伤。线粒体转氢酶反应也可使还原型烟酰胺(尼克酰胺)二核甘酸(还原型辅酶Ⅰ,NADH)转变成NADPH。苹果酸酶和异柠檬酸脱氢酶催化的反应,也能产生NADPH。
(三)蛋白质代谢
肺有合成RNA、DNA、白蛋白、载体蛋白等功能,肺内还能生成各种结构蛋白、免疫球蛋白、干扰素、补体、α1-抗胰蛋白酶和α2-巨球蛋白等,肺内蛋白的合成量与葡萄糖代谢有密切关系,合成还需要钙离子、谷胱甘肽、鸟苷、ATP产生系统和氨基酸的补给,在Ⅱ型肺泡上皮细胞中完成,其合成的调节是相当复杂的。
1.基质分子 弹性蛋白是肺的重要功能性蛋白,能作用于肺的弹性回缩,弹性蛋白与至少一种其他蛋白结合以产生微纤维。肺弹性蛋白可由不同类型的细胞合成,动脉壁弹性蛋白由平滑肌细胞提供,肺间质弹性蛋白则由间质成纤维细胞合成。出生前肺弹性蛋白的产生达到高峰,出生后随年龄而减少。胶原是肺里含量较多的蛋白,Ⅰ型胶原含量最多,Ⅱ型胶原主要分布于支气管的软骨部位,Ⅲ型胶原往往与Ⅰ型胶原并存,对Ⅳ型胶原了解较少。肺胶原持续地合成和降解,在正常肺中可达到平衡,但这种平衡很容易被破坏,因为肺损伤可使胶原降解和再合成。产后的早期胶原增加,随年龄而减少,成人的胶原合成较儿童低。当肺部炎症时,大量聚集的白细胞释放出以弹性蛋白酶为主的多种蛋白水解酶。弹性蛋白酶水解弹性蛋白和胶原蛋白,造成肺泡膜和毛细血管基膜受损,渗透性增高,发生肺损伤。
2.蛋白酶 肺内各种蛋白酶能合成、激活、灭活和转化多种活性物质,如血管紧张素被转化酶转化,去甲肾上腺素被肺内多巴脱羧酶灭活,5-羟色胺能被单胺氧化酶分解。肺内还有丰富的水解酶、溶菌酶、磷酸酶、脱氧酶和抗氧化酶等,与肺生理、代谢有密切关系。
(1)α1-抗胰蛋白酶。α1-抗胰蛋白酶在呼吸道黏膜的分泌液中与小分子量的胰蛋白酶抑制物并存,并可以与一种或多种酶结合成复合物,在肺泡巨噬细胞中亦有α1-抗胰蛋白酶的存在。α1-抗胰蛋白酶可抑制胰蛋白酶、血纤维蛋白溶酶、胰凝乳蛋白酶和弹性蛋白酶。正常肺内α1-抗胰蛋白酶与蛋白溶解酶保持平衡,此平衡的破坏将导致肺组织的损伤,如A RDS和肺气肿等。
(2)抗氧化酶。除了基质蛋白以外,某些酶在维持肺功能中也起重要的作用,例如抗氧化酶。氧中毒时过氧化酶对肺组织造成损伤,但机体有抗氧化酶起相应的保护作用。抗氧化酶有过氧化物歧化酶、过氧化氢酶、谷胱甘肽酶和过氧化物酶,均于出生后短时间内在肺合成,能增加对氧的耐受,防止氧中毒。
(四)脂类代谢
肺具有较强的摄取、氧化脂肪酸和合成脂类的能力,肠道吸收的脂肪可不经过肝脏处理直接进入肺循环,显示了肺在脂类代谢中的重要性。脂肪酸在肺内是氧化供能物质,来源于肺细胞的合成和血液中的乳糜微粒、血脂蛋白和三酰甘油。肺主要以Ⅱ型肺泡细胞摄取脂肪酸,肺泡细胞可贮存脂类。脂质是肺的重要成分,占肺组织干重的10%~20%。70%~80%的肺脂质为磷脂,而主要的中性脂质是胆固醇和三酰甘油。肺磷脂的主要功能是构成许多细胞和细胞内膜的动力组织。中性脂肪,如三酰甘油的主要作用是储备代谢燃料。肺内某些细胞还有少量糖脂,具有抗原性。
肺表面活性物质(pulmonary surfactant,PS)的主要成分是磷脂和某些中性脂肪。中性脂肪主要是胆固醇,在Ⅱ型细胞层状体内合成并与蛋白结合,存在于肺泡表面,被巨噬细胞和其他细胞摄取,经磷酸酯酶A分解,在肺泡、终末细支气管表面降解,由纤毛系统加以清除。也可被肺泡Ⅱ型上皮细胞摄取后清除或重新利用。PS大约由90%的脂质和10%的表面活性物质特异蛋白,如SP-A,SP-B,SP-C和SP-D等蛋白组成,在肺泡表面形成一层不溶性膜,以防止肺泡在低肺容量时,发生萎陷和液体漏进肺泡腔。在ARDS等肺疾病时,表面活性物质合成减少,或灭活增加。表面活性物质系统出生前才出现,早产新生儿呼吸窘迫综合征即由于表面活性物质缺乏所致。此外,PS还在肺的免疫防御和炎症反应过程中起重要作用,在免疫反应早期即特异免疫反应还未出现或免疫状态受损时尤其重要。PS的不同组分在免疫调节中的作用有差别,具体可分为对外来颗粒的直接作用,介导免疫细胞和外来颗粒的相互作用,对免疫细胞的调节作用等。肺泡蛋白沉积症与肺泡内沉积类脂有关。
(五)血管活性物质的肺内代谢
肺是血管活性物质代谢的重要器官,具有生成、储存、释放、激活或灭活多种生物活性物质的作用,肺的正常代谢对维持这些生物活性物质在体内的平衡和稳定有重要意义。
1.一氧化氮 自由基气体一氧化氮(NO)是一种内皮源性舒张因子,它在血管内皮细胞由其前体L-精氨酸和氧分子在一氧化氮合酶(NOS)及其辅助因子的作用下产生,迅速进入平滑肌细胞,通过增加环磷酸鸟苷(c GMP)的生成,介导平滑肌舒张并对平滑肌细胞增殖起抑制作用。NO极不稳定,在氧存在时,经O2和超氧离子数秒钟内氧化成硝酸和亚硝酸根,失去生物活性。一氧化氮合酶广泛分布于呼吸系统各组织细胞内,气道上皮细胞、血管平滑肌细胞、血管内皮细胞和胸膜巨噬细胞等均有NOS的表达。NO具有多种生理作用,可通过对抗缩血管物质的作用舒张肺血管,对维持肺血管的张力具有重要意义。另外,NO有抗血栓形成和明显的细胞毒作用,在抗感染、抗肿瘤免疫中有重要作用。在神经系统中NO可作为一种新的递质,参与信息传递。肺内产生的NO参与肺通气/血流(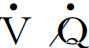 )比值的调节,是维持肺循环低张、低压状态的重要因素。急性缺氧时,NO合成减少,可引起肺动脉收缩而导致肺动脉高压;而NO内源性生成过多,可引起气道黏膜充血水肿,促发炎症引起支气管哮喘。同样,增加神经介质阻止NO的释放,可缓解支气管痉挛。
)比值的调节,是维持肺循环低张、低压状态的重要因素。急性缺氧时,NO合成减少,可引起肺动脉收缩而导致肺动脉高压;而NO内源性生成过多,可引起气道黏膜充血水肿,促发炎症引起支气管哮喘。同样,增加神经介质阻止NO的释放,可缓解支气管痉挛。
2.内皮素 内皮素(endothelin,ET)由血管内皮细胞合成和分泌,是一种多肽物质,主要包括4种类型:ET-1,ET-2,ET-3和血管活性肠收缩物质。ET广泛分布于肺血管、呼吸道上皮、黏膜腺体和拟交感神经节,在肺内小支气管含量最高,胸膜含量最低。广泛分布于呼吸道的ET受体在与ET结合后发生内趋化,使膜上受体数目减少,对ET的反应性降低。ET不仅是一种循环激素还是一种潜在的神经介质和细胞生长因子,可调节心血管的功能和平滑肌细胞等的增殖。ET对支气管平滑肌有明显的收缩作用,其中ET-1最强,其次是ET-2和ET-3。同时ET可结合于肺血管平滑肌,可使肺血管强烈收缩,特别是肺小血管。另外ET-1可促进血管平滑肌增生和纤维化,这一作用可通过血小板源性生长因子和表皮生长因子等调节或加强。ET在离子运输、神经传递、下丘脑和垂体功能、花生四烯酸生成中有重要作用。ET的合成、分泌和代谢异常可诱发多种呼吸道疾病,如支气管哮喘、ARDS、肺动脉高压和肺部肿瘤等。
3.肾素-血管紧张素系统(renin-angiotensin system,RAS) 肾素-血管紧张素系统是存在于血液中的调节机体血压的活化系统,通过肾素、血管紧张素原(angiotensinogen)、血管紧张素Ⅰ(angiotensinⅠ,AngⅠ)、血管紧张素转化酶(angiotensin-converting enzyme,ACE)和血管紧张素Ⅱ(angiotensinⅡ,AngⅡ)等物质间发生的级联反应,最终产生具有强烈收缩血管平滑肌的AngⅡ。
(1)血管紧张素转化酶(ACE)。是一种二肽水解酶,广泛分布于体内各组织,尤以肺部含量为多,为膜结合蛋白,主要分布于内皮细胞的质膜。AngⅠ经过肺循环时,在ACE作用下转变为有活性的AngⅡ。同时ACE还可水解缓激肽、神经紧张素、脑啡呔等,对高血压的发病、醛固酮的分泌和水盐代谢的调节有重要的作用。单核-巨噬细胞和肉芽肿细胞可以在特定条件下产生ACE,因此结节病时血中ACE显著升高,病情缓解或激素治疗后可以转为正常。
(2)血管紧张素。是一种肽类血管活性物质,现已分离鉴定的有4种:AngⅠ,AngⅡ,AngⅢ和AngⅣ。肾小球旁器分泌的肾素将血管紧张素原转化为AngⅠ,后者在血管紧张素转化酶的作用下转化为AngⅡ,AngⅡ又可在血管紧张素酶的作用下水解为无活性肽类,也可在α-氨基肽酶的作用下变为AngⅢ,后者被氨基肽酶N代谢后变为AngⅣ。AngⅡ具有较强的血管收缩作用,同时AngⅡ可以作为生长激素,促进原癌基因的表达,导致血管增生、重构,产生重要的病理作用,还可促进醛固酮的释放,促进心肌间质增生、肥厚和重建。肺是转化AngⅠ为AngⅡ的重要器官,原发性肺动脉高压可能与肺循环Ang浓度有关,严重肝病合并肺动脉高压可能由于Ang在肝灭活减少,大量入肺,引起肺血管收缩所致。
4.花生四烯酸代谢产物 花生四烯酸(arachidonic acid,AA)及其氧化代谢产物与炎症反应和人类疾病密切相关。AA的代谢产物主要为:前列腺素(prostaglandins,PGs)、血栓素(thromboxanes,T Xs)、白三烯(leukotrienes,L Ts)、脂氧素(lipoxine,LX)和单羟基-二十碳四烯酸(monohydroxyeicosatetraenoic acids,H ETEs)等。在肺部炎症周围有大量的A A代谢产物,使炎症周围的细胞和组织发生生物化学和功能的改变。低水平的代谢产物可以产生保护性应答,增加对疾病的抵抗力,过量则会产生毒性应答。
(1)前列腺素(PG)。肺是含PGs最多的器官,又是PGs合成代谢的主要场所之一。膜磷脂在磷脂酶A的作用下生成A A,后者在环氧化酶的作用下生成各种不同的PGs。其中舒血管的有PGE2和PGI2,缩血管的有PGF2α和T X A 2。一次肺循环后,约有82%的PGE2、58%的PGF2α和38%的PGA 2被肺循环的血管内皮细胞摄取、代谢,而PGI2不能代谢,故肺对PGs的灭活是有选择性的。PGs对血流动力学、屏障保护和呼吸功能均有影响,可作为炎症介质参与哮喘和急性肺损伤等的病理生理变化过程。
(2)白三烯。A A经脂氧化酶作用生成白三烯,是强有力的缩血管物质,参与缺氧性肺动脉高压反应。在A A的代谢过程中,L Ts可激活细胞膜上磷脂酶A 2等酶系统,促进巨噬细胞产生PGE2,血管内皮产生PGI2,血小板释放T X A 2。炎症反应时,白细胞、巨噬细胞和肥大细胞数量常增加,加上炎症因素的刺激使L Ts产生增多,L Ts使血管渗透性增高,导致炎症渗出。L Ts与过敏性哮喘的发生及其引起的气道狭窄、肺功能损害的关系非常密切,由于L Ts释放需要钙离子,因此钙离子拮抗剂可以用来治疗哮喘。
5.血小板活化因子 血小板活化因子(PA F)是第一个被发现有生物活性的、具有醚键的磷脂,也是目前发现的作用最强烈的脂质介质,其细胞来源非常广泛,嗜酸性粒细胞、嗜碱性粒细胞、中性粒细胞、血小板、肥大细胞、内皮细胞、巨噬细胞和单核细胞等被适当的刺激原(内毒素、酵母聚糖、细胞因子、特异性抗原等)刺激时,都能合成PA F。PA F合成的前体是烷酰基甘油磷酸胆碱,在磷脂酶A 2作用下生成溶血PA F,后者经过乙酰转移酶的作用生成PA F。合成的PA F约有80%储存在细胞内,当受到一定刺激原刺激时,PA F从细胞内释放出来作用到邻近细胞(旁分泌)或激活自身细胞(自分泌),PAF还可通过很多介质,如胺类、花生四烯酸类代谢产物,以及其他活化的体液和细胞产物(如氧自由基、细胞因子等)发挥作用,引起血小板聚集和活化。PAF是一种很强的化学介质,参与气道炎症和超敏反应,与许多肺部疾病如哮喘、A RDS和肺血管疾病有密切关系,可以引起支气管收缩、支气管黏膜黏液分泌亢进、气道高反应性、气道纤毛的清除能力降低、血管壁通透性增加、气道炎症及平滑肌细胞增生、肺水肿和肺动脉高压等病理生理改变。PAF还可使各种炎症细胞在肺内聚集,导致炎症细胞趋化因子、组胺、5-H T、T X A 2、L Ts、溶酶体酶和氧自由基等的释放,一方面使气道反应性增加,另一方面使气道炎症进一步加剧,形成恶性循环,导致哮喘的发生。
6.缓激肽 缓激肽(bradykinin,BK)和赖氨酰缓激肽(lysyl bradykinin)是天然存在的血管活性肽,均由激肽原在激肽释放酶的作用下产生,被激肽酶灭活。肺含有丰富的激肽释放酶和激肽酶。BK有很强的血管活性作用,能收缩肺静脉,被动扩张肺动脉,对体循环血管也起扩张作用,对气道的主要作用为:使气道平滑肌收缩、血管通透性增加、促进气道分泌、刺激感觉神经末梢,引起呼吸急促,亦可促进感觉神经肽如P物质和神经肽A、B的释放,引起神经源性反应,导致血浆外渗。
7.神经肽 存在于肺或能够影响肺功能的大部分生物活性肽为神经多肽,其中血管活性肠肽(VIP)和P物质远较其他为高。肺是含有VIP浓度较高的器官之一,人的气管、支气管以及实验动物的呼吸道腺泡周围存在大量含VIP的神经纤维,VIP神经纤维亦见于血管周围和平滑肌束中。VIP具有松弛支气管平滑肌、舒张肺血管的强大作用,肝脏是灭活VIP的主要场所。囊性纤维化和哮喘患者的血液中VIP抗体水平升高或活性增加。
8.肺生物胺 主要包括5-HT、去甲肾上腺素(NA)、儿茶酚胺等。5-HT位于大脑、血小板和肠道等处,由L-色氨酸作用而产生,肺的神经母细胞通过5-羟色胺酸脱羧亦能生成5-HT。5-HT和NA都是单胺,通过内皮细胞膜主动摄取后被线粒体中的单胺氧化酶(MAO)灭活。肺是5-HT灭活的主要器官,经一次肺循环后约有80%的5-HT和30%~40%的NA被清除。由于肺内皮细胞对两者的摄取有赖于能量和钠离子的转运,故高浓度的毒毛花苷(哇巴因)、可卡因和三环抗抑郁药可抑制他们的摄取。5-HT可以使肺血管收缩、血管渗透性增加、支气管收缩。
(邵长周 何礼贤)
参考文献
1.李洪霞.呼吸系统的解剖.见:俞森洋主编.现代呼吸治疗学.北京:科学技术文献出版社,2003,3~17
2.吕永利.呼吸系统的应用解剖学.见:朱元珏,陈文彬主编.呼吸病学.北京:人民卫生出版社,2003,3~21
3.崔莲仙.肺的生化基础.见:朱元珏,陈文彬主编.呼吸病学.北京:人民卫生出版社,2003,41~75
4.Jeffery PK.Microscopic structure of the lung.In:Gibson GJ,Geddes DM,Costabel U,et al.eds.Respiratory medicine.3rd ed.China:RDC Group Ltd,2003,34~50
5.George RB,Chesson AL,Rennard SI.Functional anatomy of the respiratory system.In:George RB,Light RW,Natthay MA,et al.eds.Chest medicine-essentials of pulmonary and critical care medicine.3rd ed.Maryland:Williams &Wickins,1995,3~23
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。















