第二节 补体的激活途径(Complement Activation Pathways)
正常生理情况下,血清中的补体成分以活性前体状态存在,没有生物学功能。只有在某些活化物的作用下,补体级联酶促反应才会发生,产生具有生物学活性的物质。目前所知,多种外源性或内源性物质可通过三条相对独立的途径激活补体,它们分别为:①经典激活途径;②替代激活途径;③凝集素激活途径。上述三条激活途径具有共同的末端通路反应,产生膜攻击复合物(membrane attack complex,MAC)以及溶细胞效应(图5-1)。
在进化和发挥抗感染作用的过程中,最先出现或发挥作用的依次是不依赖抗体参与的替代激活途径和凝集素激活途径,最后才是依赖抗体参与的经典激活途径。
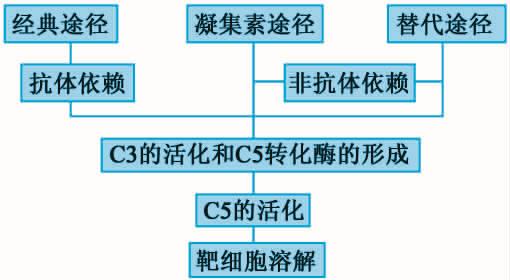
图5-1 补体三条激活途径
一、经典激活途径
经典激活途径(classcial pathway)又称传统途径、第一途径或C1途径,是最早发现的补体激活途径。该途径的激活依赖抗体的参与,它是抗体介导的体液免疫应答主要的效应方式。
1.激活物
抗原抗体复合物(免疫复合物)是启动经典激活途径的主要激活物质。抗原包括细菌、病毒以及感染的细胞,结合抗原的抗体包括IgG(IgG1、IgG2和IgG3)和IgM分子。
2.参与的补体成分
参与经典激活途径的补体成分包括:C1、C4、C2、C3以及C5~C9。
(1)C1 该分子由C1q、C1r和C1s三种糖蛋白亚单位组成(图5-2)。
C1q是补体成分中分子量最大的分子,相对分子量为410 kU,由18条多肽链组成。肽链之间以二硫键连接,多肽链的末端呈球形,每3条不同的多肽链(α,β,γ)结合在一起形成6个亚单位,可与6个IgG分子结合,其结合部位在球状的头部。
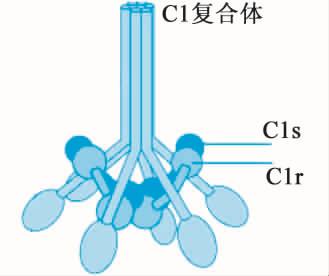
图5-2 C1大分子
C1r和C1s均是具有催化活性的亚单位,2分子C1r、2分子C1s与1分子C1q借Ca2+相连接形成C1大分子。
(2)C4 由α、β、γ3条多肽链组成。活化的C1s可将C4的α链裂解,释放出较小的多肽C4a,余下的大片段C4b结合在靶细胞上,进行补体的下一步活化程序。
(3)C2 是血清中含量最少的补体成分,是补体活化级联酶促反应的限速步骤。激活的C2极不稳定,易衰变,形成补体系统中的一种自身调节机制。
(4)C3 由α和β两条多肽链组成,其中α链参与C3的活化,α链的第77位精氨酸和78位丝氨酸之间的肽链是C3裂解酶的作用部位。C3裂解后产生小片段C3a和大片段C3b;C3b受H因子、I因子和CR1的协同作用降解为无活性的iC3b;iC3b可被进一步水解为C3c和C3dg,C3dg还可被进一步降解为C3d和C3g。C3是血浆中浓度最高的补体成分(1.0~1.5mg/ml),它也是三条补体激活途径的共同组分。
(5)C5 由α和β两条多肽链组成,它与C3、C4的结构相似,靠近N端的第74位精氨酸和75位亮氨酸之间为C5转化酶作用的部位。在C5转化酶的作用下,C5α链N末端裂解出一小片段C5a进入液相中,其余部分为大片段C5b,结合在靶细胞上。C5b在极短时间内能保持与C6结合的构象,可与C6以非共价结合。但C5b生成后其潜在的生物学活性存在时间非常短,若无C6结合则迅速衰变为iC5b。
(6)C6~C9 C6和C7各由一条多肽链组成,结构相似,不需激活即可直接与C5b结合,结合后不具酶活性,其排列方式有助于吸附C8。C8由α,β,γ 3条多肽链组成。C9由一条多肽链组成,C9一旦与C8结合后,构象发生改变,可形成多聚体。
3.激活过程
整个激活过程分为识别阶段、活化阶段和膜攻击阶段(末端通路反应)(图5-3)。
(1)识别阶段 在这一阶段中,抗原和抗体结合后,抗体发生构象改变,使Fc段的补体结合位点暴露,补体C1与之结合并激活。
C1q的球状头部是与Ig结合的部位;C1q可结合IgG1、IgG2、IgG3的CH2区或是IgM的CH3区,但不能与IgG4、IgA、IgD和IgE结合。当两个以上的C1q头部被IgG或是IgM Fc段结合固定后,C1q大分子的构象才会发生改变,故必须有2个以上的IgG分子同时与C1q结合,C1q才发生活化;而一分子的IgM即可激活C1q。C1q的构象发生改变后,C1r被裂解进而C1s裂解,形成有酶活性的C 1s,继而进入下一阶段的连续反应。
(2)活化阶段 即C3转化酶和C5转化酶形成阶段。在这一阶段中,活化的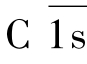 依次酶解C4、C2,形成具有酶活性的C3转化酶,后者进一步酶解C3形成C5转化酶。
依次酶解C4、C2,形成具有酶活性的C3转化酶,后者进一步酶解C3形成C5转化酶。
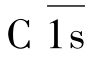 作用的第一个底物分子是C4,在Mg2+存在的条件下,C4被裂解为C4a小片段和C4b大片段,C4a产生后释放入液相,而大片段C4b则与固相介面或抗原抗体复合物结合。同样,在Mg2+存在的条件下,C2迅速结合在产生的C4b片段上。此时,
作用的第一个底物分子是C4,在Mg2+存在的条件下,C4被裂解为C4a小片段和C4b大片段,C4a产生后释放入液相,而大片段C4b则与固相介面或抗原抗体复合物结合。同样,在Mg2+存在的条件下,C2迅速结合在产生的C4b片段上。此时,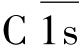 作用于C2,将其裂解为C2b和C2a两个片段,小片段C2b进入液相,大片段C2a与C4b一起形成
作用于C2,将其裂解为C2b和C2a两个片段,小片段C2b进入液相,大片段C2a与C4b一起形成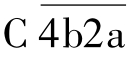 ,即C3转化酶。
,即C3转化酶。
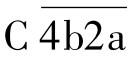 可与C3结合,随后C2a水解C3,所产生的小片段C3a释放入液相,大片段C3b与
可与C3结合,随后C2a水解C3,所产生的小片段C3a释放入液相,大片段C3b与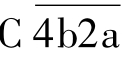 一起形成
一起形成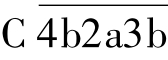 ,即C5转化酶。
,即C5转化酶。
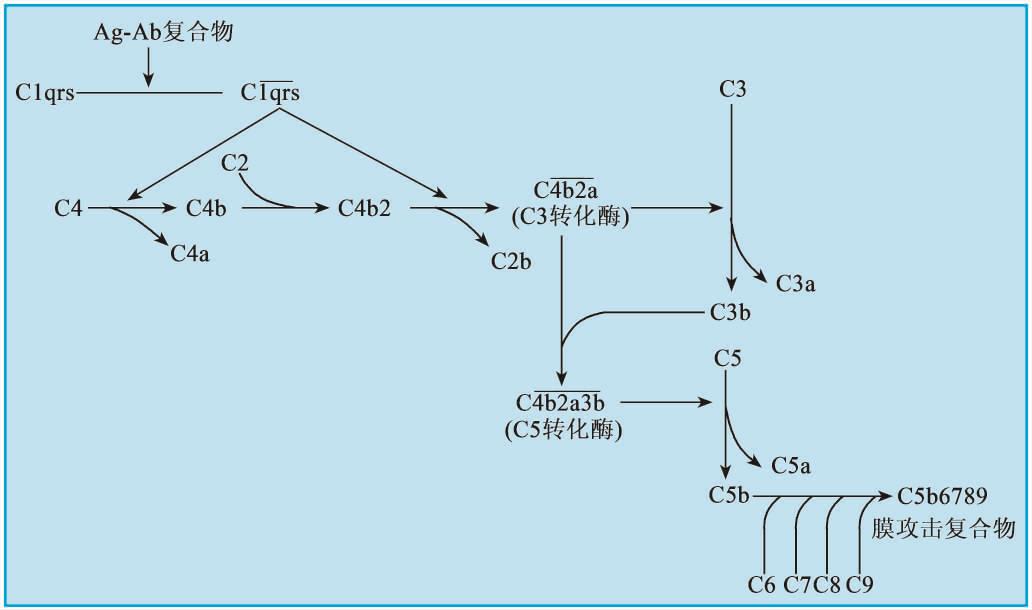
图5-3 补体经典激活途径
(3)膜攻击阶段(末端通路反应) 即C5b、C6、C7、C8和C9的序列反应,由此形成膜攻击复合物(MAC),导致靶细胞溶解、死亡的过程。由于补体的经典激活途径、替代激活途径和凝集素激活途径中都经历这一过程,该过程也被称为补体的共同末端通路反应(terminal pathway of complement activation)(见图5-4)。
在C5转化酶的作用下,C5被裂解为C5a和C5b,此反应是补体激活级联反应的最后一步,此后的反应仅涉及蛋白的结合和聚合。裂解产生的C5a进入液相,C5b结合在靶细胞表面,并依次与C6、C7结合,形成C5b67复合物,稳定地插入靶细胞膜的浆膜脂质双层中,并且该复合物可与C8高亲和力结合。之后,C8加入其中形成C5b678的复合物结构,此时C5b678可牢固地附着于细胞表面,但它的溶细胞能力有限。最后,12~15个C9加入到复合物中,形成C5b6789的结构,该结构实际是一个贯穿靶细胞膜、内径约为11 nm的跨膜通道,即为MAC。
MAC在细胞膜上打孔,使得细胞内的可溶性分子、离子以及水分子可自由通过胞膜;但蛋白质等大分子不能从胞浆溢出,最终导致胞内渗透压降低,细胞溶解死亡。此外,补体成分插入胞膜,可使致死量钙离子被动向胞内弥散,也会造成细胞的死亡。
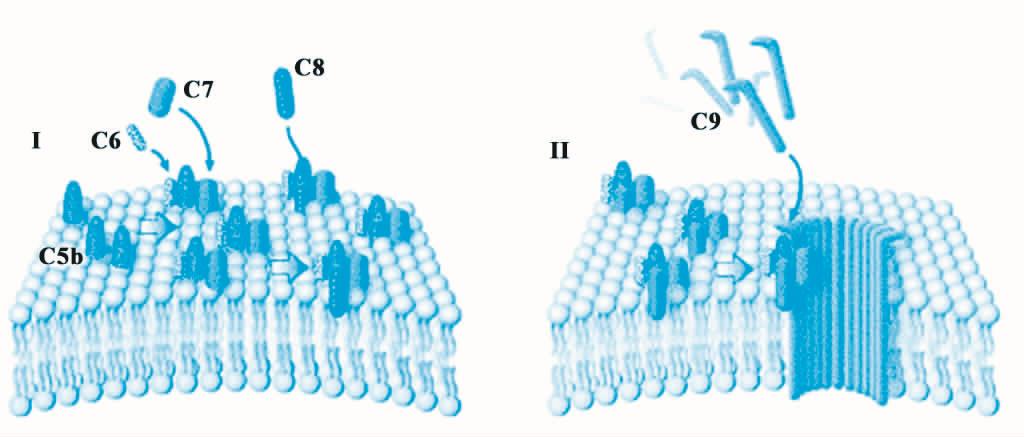
图5-4 MAC的形成
共同末端通路反应的效应过程因发生的位置不同,可形成不同的产物:若发生在靶细胞膜上则形成MAC;若激活并没有在靶细胞表面进行,而是在血清中发生时,发挥调节作用的S蛋白会结合到相关的补体复合物上,形成无活性的SC5b67、SC5b678和SC5b6789。
二、凝集素激活途径
凝集素激活途径(lectin pathway)指由血清中的甘露聚糖结合凝集素(mannose-binding lectin,MBL)或纤维胶凝蛋白(ficolin)直接识别多种病原微生物包括酵母、病毒和细菌表面的糖基,进而依次活化MASP-1、MASP-2、C4、C2、C3,形成和经典途径相同的C3与C5转化酶,激活补体级联酶促反应的活化途径。MBL主要识别病原微生物上的N-氨基半乳糖或甘露糖;ficolin主要识别病原微生物表面的N-乙酰葡萄糖胺。
该途径的激活不需要抗体的参与,它的发生早于补体的经典激活途径,在固有免疫中发挥着重要的作用,是感染性物质突破宿主机械屏障所必须跨越的第一道防线。
1.激活物
主要为病原微生物表面的糖基,MBL和Ficolin通过与这些糖基的识别而活化,进而活化下游的MBL相关丝氨酸蛋白酶(MASPs)。
2.参与的补体成分
参与凝集素激活途径的补体成分包括MBL/Ficolin、MASPs、C4、C2、C3以及C5~C9。
(1)MBL和Ficolin为模式识别分子,均属于C型凝集素家族。两者的结构均与C1q相似。MBL含有一个胶原样区和一个碳水化合物结合区,Ficolin含有一个胶原样区和一个纤维蛋白原样区;其中MBL的碳水化合物结合区和Ficolin的纤维蛋白原样区执行着对病原微生物表面的糖基识别的功能(图5-5)。
(2)MASPs包括MASP-1、MASP-2、MASP-3、sMAP。MASP-1在功能上类似于C1r,而MASP-2的功能类似于C1s,MASP-3和sMAP的功能尚不清楚;当MBL或Ficolin与病原微生物的糖基结合后,它们可进一步结合MASPs,最终导致的是C4、C2的降解,形成C3转化酶。
3.激活过程
如图5-6所示,MBL或Ficolin与病原微生物的糖基结合后,构象发生改变,MASPs(MASP-1、MASP-2、MASP-3)结合到携带有病原微生物表面糖基成分的MBL或Ficolin分子上,形成MBL/Ficolin-MASPs复合物,其中有活性的MASP-2可水解C4和C2分子,而有活性的MASP-1则可直接切割C3,继而形成C3转化酶;其后的反应过程与经典途径相同。
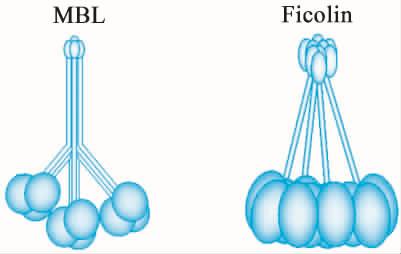
图5-5 MBL和Ficolin的结构
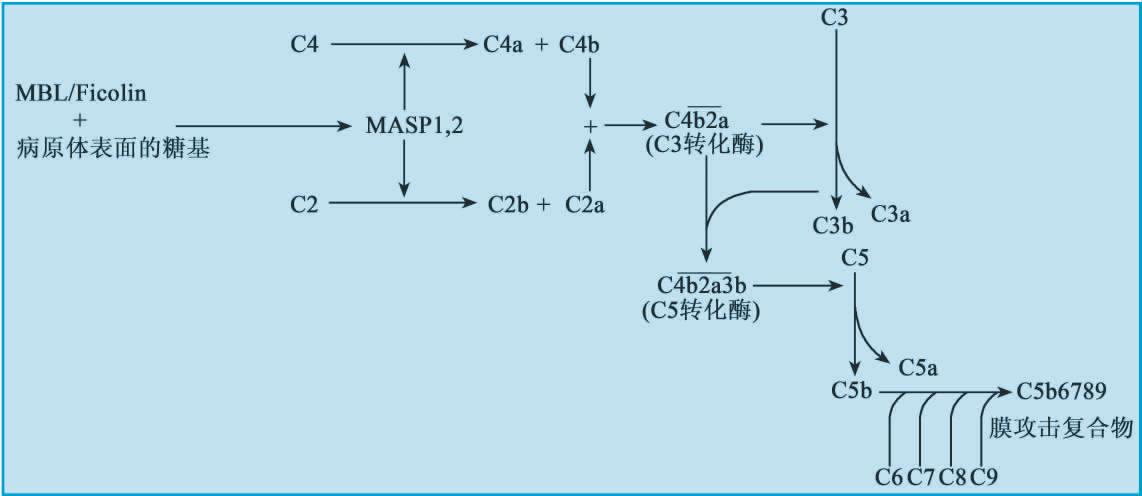
图5-6 补体凝集素激活途径
三、替代激活途径
替代激活途径(alternative pathway)又称旁路激活途径、第二途径或C3途径,是指不经C1、C4、C2,而由C3、B因子、D因子参与的激活过程,在该过程中,直接由微生物或外源性异物刺激C3的活化。这种激活方式可不依赖于特异性抗体的形成,在感染的早期发挥作用。从种系发生的角度来看,替代途径是最早出现的补体活化途径,是机体抵御微生物感染强有力的非特异性防线。
1.激活物
某些细菌、革兰阴性菌的内毒素、酵母多糖、葡聚糖、凝集的IgA和IgG4以及其他哺乳动物细胞,均可绕过C1直接“激活”补体的替代途径。这些成分提供了补体级联反应得以进行的接触界面,使得替代途径的激活能顺利的进行。
2.参与的补体成分
参与替代激活途径的补体成分包括:B因子、D因子、备解素(properdin,P因子)、C4、C2、C3以及C5~C9。
(1)C3 在经典激活途径中已介绍。
(2)B因子 为单链多肽,在结构和功能上类似于经典激活途径中的C2蛋白。B因子在同C3b结合之后容易被D因子裂解,产生小片段Ba和大片段Bb,后者具有丝氨酸蛋白酶的催化功能。
(3)D因子 单链丝氨酸蛋白酶,在血清中含量极低。
(4)备解素 (properdin,P因子)在替代激活途径中,其功能是稳定C3和C5转化酶。
3.激活过程(见图5-7)
(1)启动阶段 主要是形成C3转化酶的阶段。
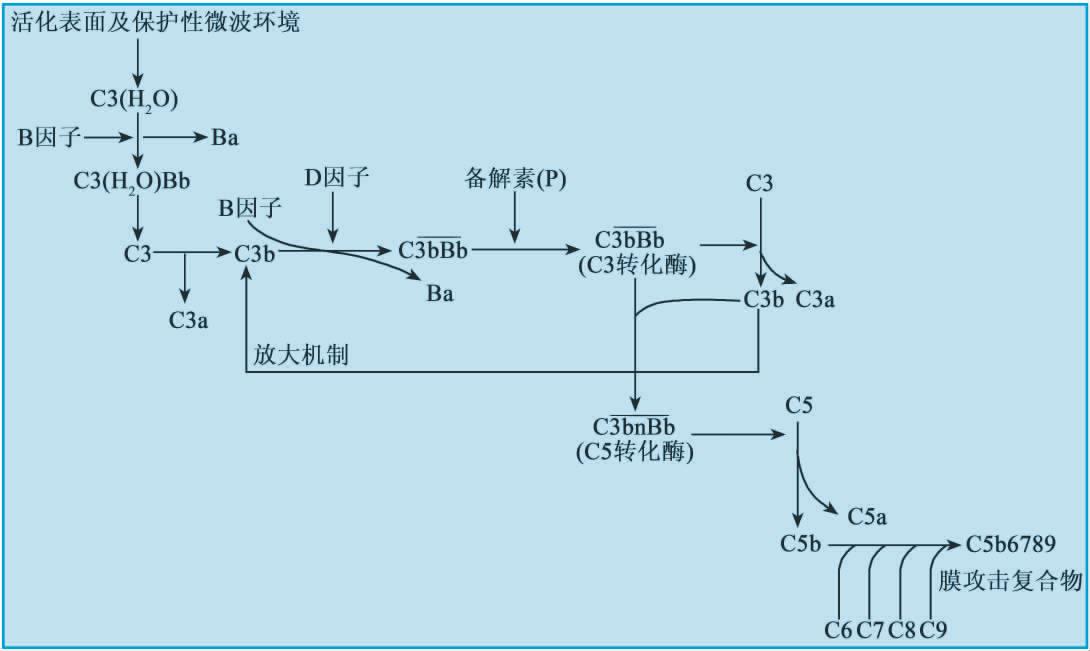
图5-7 补体替代激活途径
在生理状况下,血清中的C3不断自发性水解,形成C3a和C3b,若有稳定物(如细菌等)与C3b结合,在Mg2+存在条件下,C3b可与液相中的B因子结合形成C3bB。C3bB形成后,D因子裂解结合的B因子,形成小片段Ba和大片段Bb,Ba进入液相,Bb仍结合在C3b上,形成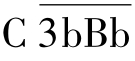 ,即替代途径中的C3转化酶。
,即替代途径中的C3转化酶。
绝大多数C3b在液相中快速失活,少数可与附近的膜表面结构共价结合,但结合在自身组织细胞表面的C3b可被H因子、I因子、DAF、MCP、CR1等调节蛋白降解;只有结合在细菌等“激活物”表面的C3b不能被有效灭活,而是与B因子结合。在此激活途径中,备解素(P因子)与C3b和Bb分子结合起到稳定转化酶的作用。
(2)活化阶段主要是C3大量裂解和C5转化酶形成的阶段。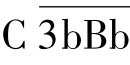 大量裂解C3形成C3b。C3b进一步与B因子结合,并被D因子裂解,形成更多的
大量裂解C3形成C3b。C3b进一步与B因子结合,并被D因子裂解,形成更多的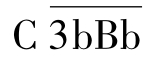 ,进而促进对C3的裂解,这一过程称为C3b的正反馈(positive feed back)作用;裂解产生的C3b可进一步与
,进而促进对C3的裂解,这一过程称为C3b的正反馈(positive feed back)作用;裂解产生的C3b可进一步与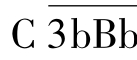 结合,形成多分子复合物
结合,形成多分子复合物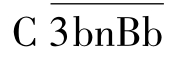 (n≥2),即C5转化酶,其后进入终末过程。
(n≥2),即C5转化酶,其后进入终末过程。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。

















