静脉发育畸形(venous anomalies)是一组低流速血管畸形,其估计发病率约为1/10 000。主要包括静脉畸形(venous malformation),约占95%。主要呈散发性(散发性静脉畸形),也可以常染色体显性遗传的方式发生[皮肤黏膜静脉畸形(cutaneomucosal venous malformation,VMCM),约占1%]。约5%的静脉发育畸形为通常呈显性遗传的静脉球变畸形(glomuvenous malformation,GVM)。
(一)静脉畸形
静脉畸形(VM)由扩张的静脉样管腔组成,具有薄层扁平的内皮细胞层,血管平滑肌细胞稀少并呈斑片状分布。通常位于皮肤或黏膜,但很多时候也可向更深部浸润入肌肉、神经和骨骼。内脏静脉畸形可累及多种不同器官包括肝脏、脾脏、胃肠道和中枢神经系统,罕见于椎体。通常为先天发生,皮肤和黏膜的病变扁平或凸起,呈青紫色,范围从小泡状到更为广泛的病变不等,散发者以单发的大范围病变更为常见。静脉畸形的局限性血管内凝血(localized intravascular coagulation,LIC)可导致40%的患者D-二聚体产物增高,更为极端的病变可出现可溶性纤维蛋白和纤维蛋白原降低。这些散发型静脉畸形的病因目前尚不清楚,尽管家族型皮肤黏膜静脉畸形的基因已被鉴定,这为研究静脉畸形的致病过程和可能涉及的分子提供了重要线索(两者可能重叠)。静脉畸形也可在更为复杂的综合征背景下发生,如前所述的Klippel-Trenaunay综合征、Maffucci综合征(尚可见多发内生性软骨瘤)和蓝色橡皮泡痣综合征(皮肤疱疹和胃肠道静脉畸形),其病因亦不清楚(图7-4至图7-6)。
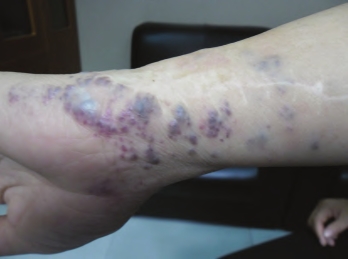
图7-4 上肢静脉畸形

图7-5 手指静脉畸形

图7-6 静脉畸形(较大的扩张管腔)
(二)皮肤黏膜静脉畸形
常染色体显性遗传型皮肤黏膜静脉畸形(VMCM)以多发的小而隆起的皮肤病变为特征,很少向深部浸润。伴有家族史的口腔黏膜病变具有代表性,尽管畸形通常无症状。已经发现TIE2(TEK)基因的激活突变介导疾病的发生,这种基因定位于9p21的血管生成素(人Ang-1,2,4或鼠ANG-3)的内皮细胞特异性酪氨酸激酶受体。
Tie2在微血管芽生、成熟、稳定性和完整性中起重要作用。在与其活化配体Ang-1以多聚体形式结合后,Tie2即形成二聚体并发生磷酸化。另一方面,Ang-2通常被认为是一种拮抗物;但是其作用似乎具有显著的背景依赖性(context-dependent)。已经发现Tie2也可与Tie1结合成异二聚体(一种旁系同源基因),而后者可在某些情况下再次调节Tie2信号通路。
Tie1、Tie2、Ang-1和Ang-2基因的缺失均可导致小鼠血管发育的严重缺陷和胚胎期死亡。Tie2-/-小鼠因缺乏内皮细胞导致原始毛细血管丛形成缺陷,还可出现心脏发育不完全和出血。在Ang1-/-小鼠表现为相似的重叠表型时,Ang-2过表达转基因组与Tie2缺失小鼠表型相似。Tie2的活化导致一系列下游信号介质包括PI3K和Akt的磷酸化和激活,而这两种分子具有抗凋亡效应。PI3K也可激活局部黏着斑激酶(focal adhesion kinase,FAK)和内皮特异性一氧化氮合成酶(endothelial-specific nitric oxide synthase, eNOS),参与细胞的迁移和芽生。其他可与Tie2相互作用的信号分子包括可影响细胞迁移的分子Dok-R,以及Grb2、Grb7、Grb14和蛋白酪氨酸磷酸酶(protein tyrosine phosphatase)Shp2,后者依次与FAK结合并激活MAPK通路,影响内皮细胞的迁移和存活。Tie2通过与ABIN-2(NF-κB的一种新型抑制物)的相互作用使其在内皮细胞中发挥抗炎作用,减少白细胞外渗,并促进血管的稳定和完整。
到目前为止已经报道了在皮肤黏膜静脉畸形中的两种Tie2基因突变(R849W和Y897S),二者均定位于激酶结构域内。这两种突变在体外过度表达时可引起配体非依赖性Tie2超磷酸化。另一方面,来自正常血管和静脉畸形的病变血管内皮细胞内的Tie2磷酸化似乎差别不大。已经发现R849W基因突变具有依赖于p Akt和p52Shc的强大的抗凋亡效应,但不引起细胞增殖。在Tie2过表达引起转录调节因子STAT-3和STAT-5活化时,突变形式另可激活STAT-1并导致P21细胞周期抑制因子的诱导增加。可以推测在缺乏足够的平滑肌细胞时突变促使内皮细胞凋亡减少,但是引起前者缺乏的机制尚不清楚。最近我们鉴定了具有新型遗传性超磷酸化Tie2突变的6个皮肤黏膜静脉畸形家系,除了一个家系以外的其余家系的突变位点定均位于激酶结构域。6个另外的家系具有R849W突变。我们还在1例病人中发现体细胞第二次突变,提示在脑海绵状血管畸形病人中皮肤黏膜静脉畸形可能具有近显性遗传模式。值得注意的是,在散发型静脉畸形中也发现Tie2基因的体细胞突变。表明对导致常见的散发型发育畸形的体细胞突变进行筛查是有价值的,其基因(或信号通路)与相应的罕见遗传型发育畸形有关(图7-7,图7-8)。

图7-7 舌黏膜静脉畸形

图7-8 唇部静脉畸形
(三)静脉球变畸形
静脉球变畸形(GVM)由表面隆起、呈粉红色到蓝紫色的结节状皮肤病变组成,通常多发并伴有皮肤过度角化。在组织学上表现为扩张的静脉管腔,以圆形“血管球”壁细胞为特征;该细胞为异常分化的平滑肌细胞,缺乏正常的纺锤形外观和某些发育标记物。与静脉畸形不同,静脉球变畸形不向深部浸润,触诊时常引起疼痛,压迫时不能完全排空,也不出现可在静脉畸形中所观察到的凝血功能异常。静脉球变畸形与静脉畸形的鉴别非常重要,因为二者需要不同的治疗方式:静脉球变畸形的主要治疗方法为手术切除,或在某些情况下采取硬化治疗。大多数静脉球变畸形(约70%)为常染色体显性遗传,不完全外显率随着年龄的增加而增加,即使是在同一家系中的不同成员之间也可存在广泛的异质性。定位于1p21-22的球管蛋白(glomulin,GLMN)基因的突变介导这种发育畸形的发生,迄今为止已经在约100个家系中鉴定出约30个不同的基因功能缺失。其中仅有8种突变普遍存在,这使得基因的筛查相对有效。突变分布于整个基因,不存在基因型-表型关系。静脉球变畸形中的血管球细胞似乎缺乏GLMN的表达。通过增加体细胞第二次突变的鉴定,可提示静脉球变畸形也存在近显性遗传模式。
GLMN主要在血管平滑肌细胞中特异性表达,在缺乏GLMN时血管平滑肌细胞不能正常分化。GLMN出现在其他大多数平滑肌细胞分化标记物之后,但出现在smoothelin-B之前。已经发现GLMN可与FKBP12结合,依次通过结合转化生长因子-βRI损害转化生长因子-β信号通路,并通过转化生长因子-βRⅡ抑制转化生长因子-βRI磷酸化。因此,GLMN通过与FKBP12的竞争性结合在促进转化生长因子-β信号传导中发挥作用。已知转化生长因子-β信号传导在平滑肌细胞的发育中具有重要作用,而且当GLMN缺乏时转化生长因子-β信号传导可受到严重抑制。GLMN还可与c-MET的无活性形式结合, c-MET是HGF的酪氨酸激酶受体,参与细胞增殖、通过内皮细胞形成管腔及平滑肌细胞的迁移。GLMN通过HGF与c-MET进行配体结合并使c-MET磷酸化后,GLMN也发生磷酸化并被释放,同时伴有激酶p70S6K及其下游靶点PI3-K的活化。此外,转化生长因子-β可上调c-MET自身的表达,因此GLMN可能在两个信号通路中起协同作用。通过其与Cu17相互作用的能力,GLMN也可参与泛素介导的蛋白质降解过程的调节。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。
















