脓胸的概念就是当细菌侵入正常无菌的胸膜腔、造成感染,形成脓液积聚。世人对脓胸发病机制的认识以及脓胸的处理方法,都是经过多方探索、逐步形成的。早在1918年,Graham和Bell就提出了治疗脓胸的基本原则:充分引流脓液、尽早消灭脓腔、足够的营养支持,这些原则在现在仍然适用。在抗生素出现以前(20世纪30、40年代),发生肺炎的病人中约有10%的患者合并脓胸感染。随着抗生素的问世,肺炎后脓胸的发生率明显下降了。由于胸外科技术的快速发展,外科治疗胸部病种的增加,手术后脓胸的发生率所占比例反而升高了。但总体来说,伴随着抗生素的广泛开发和合理应用,脓胸在临床诊治过程中已不多见,尤其是年轻医师对此病的认识和处理尚缺乏经验。
【历史回顾】
据医学史料记载,希波克拉底是第1个详细描述脓胸的临床表现和自然转归的,也是第1个采用脓胸切开引流的人。而第1例胸腔穿刺治疗脓胸的病例记载是在1852年,由Wyman和其同事Henry完成的,当时他们是在第6肋间和第7肋间近脊柱旁穿刺,抽出约20ml脓液。较大的进步是用胸腔闭式引流替代胸腔穿刺,此项成就是Playfair在1875年完成的。随着医学的快速发展,治疗脓胸新的方式、方法不断出现,如Estlander于1879年完成了胸廓成形术,Fowler于1893年完成了胸膜剥脱术。但是由于当时处理急性脓胸的方法是肋骨切除、开放式引流,造成病人气胸和纵隔移位,患者往往在术后30min内死亡,其死亡率高达30%。为此,在第一次世界大战期间还专门成立了“脓胸研讨委员会”,这个委员会中的Graham和Bell,于1918年在美国的Surgeon General杂志上发表了他们的研究结果,Graham和Bell在文中建议:处理急性脓胸,应采用胸腔闭式引流术而非开放式,充分引流脓液并尽早消灭脓腔。随着这一方法的应用,死亡率很快从30%下降到了5%~10%。这些处理早期脓胸的方法经过岁月的检验证实是非常正确的,并一直沿用至今。医学发展到现今阶段,随着抗生素的不断研发和营养支持手段的丰富科学化,影像诊断技术的不断提升,尤其是20世纪90年代以后,各种腔镜微创技术的应用推广,使脓胸的处理不仅效果好,而且手段更加的多元化。
【病因】
脓胸的致病原因见表8-3。
表8-3 脓胸的致病原因

临床上所谓的“原发性脓胸”,实际上是由亚临床的肺部病变所引起。脓胸基本上是由临近胸膜的组织器官化脓性感染引起。其中50%以上继发于肺部感染。肺炎导致脓胸的发病机制有二:一是肺部感染灶通过淋巴回流污染了淋巴液,炎性物质造成了肺部淋巴管堵塞,细菌随着淋巴液直接扩散到了胸膜腔。二是肺部的炎性反应引起了肺部终末细支气管组织坏死和脓肿形成,末梢气道的堵塞造成气流不畅以及肺气肿的形成,胸膜下的肺气肿(大疱)可以自发破裂,并把感染灶带入胸膜腔。封闭的胸膜腔+胸腔积液良好的培养基+进入的细菌,共同作用,形成了脓胸。
发生脓胸的另一大原因是进行了胸腔有关的操作,如胸腔穿刺、胸膜腔置管引流,肺、纵隔或食管等手术后,导致细菌直接污染胸膜腔,造成手术后脓胸。手术后脓胸在全肺切除后的发生率为6%~8%,肺叶切除术后的发生率为1%~2%。
另外,产生脓胸的原因还有自发性气胸、胸部创伤、膈下脓肿、气管内吸入异物致肺破裂和自发性食管破裂等。在胸部创伤中,有两种情况较易引起脓胸的产生:胸壁穿透伤和血气胸;前者是由于带有细菌的异物将细菌直接带入了胸膜腔内,后者是由于血液是更好的培养基,而气胸则导致细菌置入进了这个培养基中。有资料表明(Ogilvie,1950):血气胸比单纯血胸和单纯气胸更容易继发感染。其他少见的胸外伤导致的脓胸还有食管破裂(包括医源性)和急性膈破裂致肠嵌顿坏死等。膈下脓肿往往首先导致胸膜腔反应性积液,感染严重时可直接穿透膈肌污染胸膜腔。
血源性播散感染导致的脓胸,都是先造成周围型肺脓肿,继而感染胸膜腔引起的,其发生率不到整个脓胸发生原因的1%。某些少见的因素也可造成脓胸,如胸壁感染、胸椎感染、颈后深部软组织感染以及较罕见的纵隔淋巴结感染等(见表8-3)。
【细菌学】
在抗生素出现以前,约10%的肺炎患者演变成脓胸,常见致病菌是链球菌和肺炎球菌。随着抗生素的广泛应用,不仅主要致病菌的菌谱发生了变化,而且脓胸的发病率和病死率也显著下降了。近来的多项研究表明,金黄色葡萄球菌、革兰阴性菌以及厌氧菌成为了最主要的致病菌;尤其是2岁以下的儿童脓胸患者,约92%培养出的细菌为葡萄球菌。在分离出的多种厌氧菌中,最常见的是消化道链球菌属。
在1993年,Brook和Frazier两组团队,分别从两个医院共研究了197例细菌培养阳性的脓胸患者,单纯的需氧菌感染占64%,需氧菌和厌氧菌混合感染占23%,单纯厌氧菌感染占13%。需氧菌感染中,肺炎链球菌约占70%,金黄色葡萄球菌约占58%,大肠埃希菌约占17%,肺炎克雷伯菌约占16%,流感嗜血杆菌约占12%。主要的厌氧菌感染中,厌氧球菌属约占36%,布氏菌属和卟啉单胞菌属约占24%,脆弱类杆菌属约占22%,梭形杆菌属约占20%。
肺炎演变成脓胸的可能性,取决于肺部感染病菌的种类。Johnson和Finegold在1994年指出,在肺炎患者中,60%~70%为肺炎链球菌感染,但其发展成脓胸的比率仅在2%左右;β-溶血性链球菌在肺炎患者中仅占1%~2%,但在成年患者中约10%、在儿童患者中约50%可出现脓胸(表8-4)。
根据2010年9月发布的中国细菌耐药性检测,可见葡萄球菌属和肺炎链球菌属对抗生素的耐药和敏感率情况(表8-5,表8-6)。
表8-4 胸腔积液、脓胸的发生率和肺炎致病菌的关系

表8-5 葡萄球菌属对各种抗菌药的耐药率和敏感率(%)

MSSA:甲氧西林敏感的金黄色葡萄球菌;MRSA:耐甲氧西林金黄色葡萄球菌;MSCNS:甲氧西林敏感的凝固酶阴性葡萄球菌;MRCNS:耐甲氧西林凝固酶阴性葡萄球菌;*:数据为菌种数量
表8-6 儿童及成年患者肺炎链球菌(非脑膜炎株)的耐药率(%)

PSSP:青霉素敏感的肺炎链球菌;PISP:青霉素中度敏感的肺炎链球菌;PRSP:青霉素耐药的肺炎链球;*:数据为菌种数量
【病理分期】
在1962年,美国胸外科协会根据脓胸的自然病程,将脓胸分为3个发展阶段。
1.炎性渗出期或急性期 此期的胸膜腔内有大量渗出液,胸腔积液表现稀薄清亮、细胞成分少,胸腔积液中的红细胞、白细胞和乳酸脱氢酶(LDH)水平都较低,胸腔积液中的糖分和pH均正常,少量纤维蛋白沉积,无纤维素沉着,胸膜充血水肿,胸腔积液易于引出,肺仍能复张良好。
2.纤维化脓期或过渡期 随着细菌的侵入,胸腔积液中红细胞、白细胞增加,大量纤维素沉积在壁层胸膜和脏层胸膜表面,尤其是壁层胸膜较多。胸腔积液变得黏稠和浑浊,胸腔积液中的糖分和pH下降,乳酸脱氢酶(LDH)升高。纤维素形成分隔防止脓胸扩散的同时,也使肺的膨胀受到了限制。
3.慢性期或机化期 此期发生于细菌感染后7~10d,在4~6周形成。在此期间,脏层和壁层胸膜上大量的纤维素沉淀,毛细血管和成纤维母细胞长入其中,在胸膜表面尤其是壁层胸膜上形成致密的纤维板,厚可达2~3cm,增厚的脏、壁层胸膜之间为脓腔,脓液十分黏稠。脏层胸膜和肺被纤维板包裹,肺的舒缩功能严重受限,肺功能受到很大影响,不进行胸膜纤维板的剥脱,肺就无法膨胀。此期的后期,还表现为患侧胸廓缩小、胸壁肋间隙变窄等(表8-7)。
我们在临床治疗上常分为两期:急性期和慢性期。
表8-7 脓胸的分期(美国胸科协会,1962年)

【并发症】
在整个脓胸发病过程的任何时期,均可产生并发症,但临床上更多出现在脓胸的慢性期。最常见的并发症是引起肺纤维化,患侧功能肺组织明显缩小。近脏层胸膜表面的脓液可侵蚀穿破肺组织,经支气管内引流排出,表现为患者突然咳出大量的脓痰。近壁层胸膜的脓液可穿透胸壁软组织、经皮肤破溃形成窦道,多发生在第5肋软骨交界处。较少见的并发症还有肋骨或椎骨骨髓炎、气管-食管瘘、化脓性心包炎、纵隔脓肿、经膈裂孔引发腹腔感染等。罕见并发症的报道还有脓肿远处播散至颅内,造成脑脓肿(Scheld等,1998)。
【临床表现】
脓胸患者的临床症状表现和其他感染相比较没有特异性。脓胸患者的临床表现与致病菌的性质、胸膜腔内脓液量的多少、患者自身的免疫状况等都有关系,有的表现很轻微,有的表现很严重。典型的急性脓胸患者常见的主诉是患侧胸痛、沉重感,全身症状可有发热,疲乏无力,心率、呼吸增快,可有咳嗽并带脓痰。
Varkey等在1981年对72例脓胸患者的研究结果显示,最常见的临床症状是:呼吸困难(82%)、发热(81%)、咳嗽(70%)、胸痛(67%)。当然,这些症状在肺炎患者身上也常见。需氧菌性肺炎导致的脓胸患者,通常有急性期的发热、胸痛、咳痰、白细胞增多。厌氧菌感染所致的脓胸患者临床症状比较隐匿,往往在感染后10d左右临床症状才明显。医院内感染和免疫功能减退以及应用过抗生素治疗的脓胸患者,其临床表现可能与上述有所不同。
【辅助检查】
为明确脓胸的诊断,临床上常用的辅助检查手段有:胸部正侧位X线片、胸部CT、超声检查、胸腔穿刺液的实验室检查、支气管镜检查等。胸部磁共振成像(MRI)不作为首选的检查方法,若想了解包裹性积液和心脏大血管、脊柱椎体等的关系时,可考虑MRI检查。
1.影像学检查
(1)胸部X线片:可发现胸腔积液、肺炎或其他稍大的胸部病变。脓性胸腔积液可表现为胸下部大片模糊阴影,直立时可见下胸部S形线,有时脓腔内可见气-液平面;后侧膈肌角处,是脓液常处的部位,侧位胸部X线片更容易显示清楚;包裹性脓胸在胸部X线片上表现为靠近胸壁的扁丘状阴影。
(2)胸部CT:对胸腔积液性质的鉴别,尤其是对于包裹性积液的判定上,胸部X线片是无法与之相比的。胸部CT不仅能区分肺脓肿和脓胸,还可以了解肺内病变,测定液体量的多少、密度值的大小以及确定液体的位置。液体的定位对制订治疗方案非常重要。CT引导下的胸腔穿刺技术已经常规开展,其精准性和安全性已经得到公认。另外,胸部CT还可判定脓胸分隔的程度。
2.超声检查 可以判断胸腔积液的有无、量的多少和部位所在;对胸腔积液与肺实变、肺不张的鉴别也有帮助。还可以在超声定位下穿刺。
3.胸腔穿刺液检查 对怀疑脓胸的患者,一旦证实胸腔内有积液,就应进行胸膜腔诊断性穿刺。对仅凭胸部X线片判断而无CT或超声帮助的医生,如何从积液量的多少来决定能否进行胸腔穿刺?Light等在1980年提出了一种方法:让患者取患侧侧卧位摄胸部X线片,从胸部X线片测量胸壁的内侧缘与肺的外侧缘的距离,若此距离超过10mm,就可完成胸腔穿刺。若有CT或超声的引导帮助,完成胸腔穿刺将更加方便。通常是用18号穿刺针,在局部麻醉下就可完成。
Orringer在1988年提出,穿刺液的大体形态特征和味道对脓胸的诊断和处理有价值。稀薄的液体即使培养出细菌,胸腔穿刺抽液加上抗生素治疗就可取得满意的疗效,浓稠、分隔的脓液则需要外科手术处理。厌氧菌脓液通常散发出恶臭,而需氧菌则无或小有异味。
(1)胸腔穿刺液要送细菌培养和药敏试验,包括革兰染色和厌氧菌培养。若怀疑是恶性肿瘤导致的胸腔积液,还应送找瘤细胞。
在送检的胸腔积液中,有25%~60%的患者细菌培养结果阴性,其原因应想到细菌培养方法是否正确、该患者是否使用过抗生素,尤其应想到对厌氧菌的培养和其标本在运送过程中的注意事项。在进行胸腔积液细菌培养的同时,还应做痰的检查和培养,它的意义在于造成肺部感染的致病菌往往也是脓胸的致病菌。但对于脓胸造成的胸壁皮肤窦道口的脓液培养出的病原菌,则可能不是造成脓胸的病原菌。若连续多次细菌培养结果为阴性,而患者对治疗无明显改善时,还应考虑到结核菌和真菌感染的可能。
既往结核菌的诊断主要有皮试、涂片、培养以及影像学诊断等,进入21世纪,人们又有了一项新的诊断结核的方法:由体外酶联免疫斑点技术(ELISPOT)发展而来的T-SPOT.TB(结核感染T细胞斑点试验)。其原理是结核杆菌感染激发机体产生较强的Th1细胞介导的细胞免疫应答,因此,结核杆菌特异的T淋巴细胞可以作为结核感染的精确检测指标。体外酶联免疫斑点技术ELISPOT是目前直接检测血液中抗原特异性T淋巴细胞的最灵敏方法,它可以检测样品中每一个反应的T细胞,即使是免疫功能减退的患者,只要单个的T淋巴细胞有反应,就可以被检出。通过检测结核感染后特异性T细胞分泌的γ-干扰素(IFN-γ),并据此结果判断是否感染结核。
随着广谱抗生素的临床使用,以及各种器官移植、免疫抑制药的应用,真菌感染呈上升趋势,既往临床上检测真菌的方法如真菌涂片、真菌培养的敏感性和特异性都较低。近年来临床上应用的G试验和GM试验检测真菌感染,具有早期、快速、敏感、特异、采样方便的优点。
G试验检测的是真菌的细胞壁成分——(1,3)-β-D-葡聚糖,人体的吞噬细胞吞噬真菌后,能持续释放该物质,使血液及体液中含量增高(浅部真菌感染无类似现象)。(1,3)-β-D-葡聚糖可特异性激活鲎(Limulus)变形细胞裂解物中的G因子,引起裂解物凝固,故称G试验。G试验适用于除隐球菌和接合菌(包括毛霉菌、根霉菌等)外的所有深部真菌感染的早期诊断,尤其是念珠菌和曲霉菌,但不能确定菌种。以下情况可出现假阳性:①使用纤维素膜进行血透,标本或患者暴露于纱布或其他含有葡聚糖的材料;②静脉滴注免疫球蛋白、清蛋白、凝血因子或血液制品;③链球菌血症;④操作者处理标本时存在污染。另外,使用多糖类抗癌药物、放疗、化疗造成的黏膜损伤导致食物中的葡聚糖或定植的念珠菌经胃肠道进入血液等也可能造成假阳性。假阴性的情况可出现在棘白菌素类,因它可抵制(1,3)-β-D-葡聚糖的合成。
GM试验主要是诊断曲霉菌感染。曲霉菌细胞壁成分中的半乳甘露聚糖在菌丝的组织生长过程中释放出来,GM试验主要检测此半乳甘露聚糖成分而得以诊断。GM的检测结果和曲霉菌的负荷量相关,GM试验也存在着假阳性和假阴性的情况。G试验和GM试验互补可缩小病原谱,增加诊断的准确性。G试验和GM试验,为临床增添了真菌感染的诊断手段,但不能完全依赖,要注重动态监测,涂片、培养、药敏仍是最基本的真菌学检测手段,实验室和临床均不可忽视。
(2)胸腔穿刺液的生化指标:主要是查积液的pH、LDH和糖成分。Light(1985)和Houston(1987)等认为,当胸腔积液中的pH低(<7.0),LDH含量高(>1 000U/L),葡萄糖含量低(<2.8mmol/L)时,预示着即将产生脓胸,应予胸腔引流。原因是感染的胸液中的白细胞活性增加、酸性代谢产物升高所致,且这些生化指标的异常显现先于革兰染色和培养的结果。对上述观点,学术界尚存有争议。
4.脓胸患者的支气管镜检查 主要是为了排除气管内肿瘤或者吸入性异物,必要时也可做气管内毛刷、肺泡灌洗,并将灌洗液和毛刷标本送病理和培养等。
【诊断及鉴别诊断】
对于有临近胸膜腔感染的病史,尤其是有急性肺部感染史的患者,出现胸腔积液,均应想到脓胸的可能。脓胸的诊断依据主要是病史、临床症状和体征、实验室检查、影像学资料等,胸腔穿刺抽出脓液即可确诊(表8-8)。
在急性期发作4~6周后,发热和胸痛持续不退,甚至加重,引流出的脓液稠厚;肺部影像提示胸壁增厚包裹脓腔、脓腔内出现分隔,虽经引流肺仍然膨胀不全;病程较长的患者,体检可发现杵状指、患侧胸壁萎陷、肋骨聚拢、肋间隙变窄、纵隔移向患侧等慢性病表现。此时提示进入了慢性脓胸期。
【鉴别诊断】
1.胸腔积液和肺实变 当X线片示一侧胸腔大部或整个变“白”时,应注意区分是胸腔被胸液充满所导致的影像改变,还是因肺实变导致。因在X线片上,实变无通气的肺和胸液的密度表现是相似的。因此,在胸部X线片上很难辨别出两者。可借助患侧的胸部听诊来帮助鉴别。实变的肺是可以传导呼吸音的,但胸腔积液则不能。另外,胸部X线片可观察气管和纵隔的移位,若移向健侧,则提示是胸腔积液;若移向患侧,则提示是肺实变。对于上述情形的鉴别,超声和CT扫描能提供更好的帮助。特别是CT扫描对诊断复杂、多分隔的脓胸帮助更大。
2.脓胸和肺脓肿 此两者的鉴别对治疗的指导意义较大。虽然两者的治疗原则都是抗感染和脓液引流,但若辨别不清,误将胸管插入肺脓肿内,则可能产生气胸、脓胸、出血、支气管胸膜瘘等并发症;况且肺脓肿的引流方式是体位内引流,而脓胸的引流方式是外引流。因此,对两者的鉴别有重要意义。胸部X线片对两者的判定有一定难度,尤其是周围型肺脓肿更难和脓胸区分开,即使出现了气-液平面,对两者的鉴别也无太大帮助。因为不仅肺脓肿内可以有气-液平面,而且气-液平面同样可出现在脓胸的分隔内,这可能由于脓胸内的产气杆菌、以前未完全吸收掉的气胸、支气管胸膜瘘或胸腔穿刺等造成。胸部CT扫描对两者的鉴别价值较大。通常情况下CT显示,脓胸脓腔的弧度线和附近的胸壁吻合,也就是说近胸壁侧脓液的边缘线和附近的胸壁走行一致;且脓腔的垂直和水平尺度较横向大(图8-10)。典型的肺脓肿多呈球形,其形态与附近的胸壁不吻合,走向也不一致,并且其周围有肺组织感染造成的炎性表现(图8-11)。
表8-8 脓胸的诊断

【处理】
正常的胸膜腔有很强的抵御细菌入侵的能力。从胸腔积液发展至脓胸,往往预示着肺部感染或其他导致胸膜腔感染的因素未能得到很好控制。在脓胸的早期,若能及时地消灭感染源,充分的排出脓液,随着肺的复张,多能取得较好的脓胸治疗效果。若脓胸发现不及时,或即使早发现了,但由于处理方式、方法不当,或重复感染、异物存留等,随着病情的迁延,就逐渐进入了慢性脓胸阶段。
脓胸的处理流程简化如下(图8-12,图8-13)。
1.急性脓胸或过渡期脓胸的治疗 脓胸一旦诊断明确,治疗手段就要尽快跟上。急性期脓胸的处理现已形成了共识,其治疗原则是:查找病因,控制感染,合理应用抗生素;充分引流排出胸腔内积液;促使肺膨胀,消灭脓腔;支持治疗,包括营养和呼吸等。
当胸腔积液细菌培养出现阳性结果时,抗生素的使用就应根据培养结果的药物敏感性来决定,同时不要忘记做痰液的细菌培养。在胸腔积液细菌培养及药物敏感性结果出来以前,或胸腔积液培养出现阴性结果时,只能依靠临床经验来使用抗生素。对于感染的胸腔内局部应用抗生素,抗生素的浓度必须足够高,才能达到杀灭病原菌的目的,反之,则容易产生耐药性;故目前不主张采用小剂量抗生素冲洗胸腔的做法。全身抗生素的使用,在脓胸的渗出期(Ⅰ期)较易进入胸膜腔,但在纤维脓性期(Ⅱ期)和机化期(Ⅲ期)则效果较差。另外,抗生素的使用效果还和病原菌的毒性大小、患者的机体状态、脓胸的发展阶段以及脓液的引流程度有关。
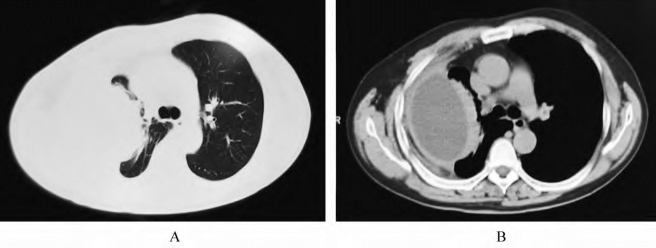
图8-10 脓胸的CT表现
A.肺窗;B.纵隔窗

图8-11 肺脓肿X线片和肺脓肿CT表现
A.X线片;B.CT(肺窗);C.CT(纵隔窗)

图8-12 肺炎等感染或肺部手术后脓胸的处理

图8-13 全肺切除术后脓胸的处理
急性脓胸处理的关键所在是脓液的充分引流。在急性脓胸的早期,若穿刺抽出草黄色、清亮或微浑浊的稀薄液体时,也就是渗出期(Ⅰ期)时,胸腔积液基本能被一次抽净,再加上合理的抗生素的使用,其疗效非常好,尤其是对儿童效果更佳。但也有学者提出异议,认为单纯胸腔穿刺完全治愈的概率很低,单独应用胸腔穿刺易导致脓液内大量分隔的形成,使充分引流更加困难,主张更加积极的外科手术干预。若穿刺抽出的胸腔积液为脓性,或胸腔积液量超过胸腔容积的50%以上,或经过穿刺24h后的胸部X线片证明胸腔积液量又有增加,且患者一般状况没有改善,就应该放置胸腔闭式引流。统计资料表明,经单纯胸腔穿刺后的患者,约46%还需要进一步的其他治疗。
通常根据先前的穿刺点和影像学资料来定位、放置胸腔引流管,常用28~36号粗管(儿童可细小),闭式引流瓶可接持续负压吸引(-20cmH2O),以使引流更加通畅,促使肺尽快复张,消灭脓腔(图8-14)。Colice在2000年发表的报道中谈到,即使这样处理的脓胸患者仍有9%的病死率,并且有40%左右的患者需要接受进一步处理,诸如另外再放置胸腔引流管等措施。近年来,CT引导下的脓腔穿刺置管,有替代传统胸腔闭式引流术的趋势,较传统置管,其优点是:对脓胸分隔区的定位精确,安全度高;可多分隔腔内穿刺抽吸胸腔积液、可置多根引流管;置入的胸腔引流管较细(12~16号),患者更易耐受。对此种细管的护理,建议用无菌生理盐水每天冲洗胸腔引流管,保持管腔通畅。

图8-14 可接负压的胸引瓶
在脓胸的过渡期,脓液的引流和肺的复张越来越困难,此时可考虑使用纤维蛋白溶解物链激酶或尿激酶,两者的作用都可溶解、打开纤维分隔,使引流更加彻底。Moulton在1995年报道,其溶解有效率可达到94%;在1997年,Bouros团队采用双盲实验的方法,对比分析了链激酶和尿激酶在治疗胸腔引流不畅患者过程中的作用,得出了如下结论:链激酶和尿激酶都能帮助增加胸腔积液的排出;尿激酶花费较高,但较链激酶的局部和全身不良反应小,这些不良反应包括发热、寒战、胸痛等。
纤维蛋白溶解物(链激酶或尿激酶)的使用,要根据置管后的胸腔引流量来决定。如果在置管后的前2d,胸内积液基本能被引流干净,且肺复张良好,则不必使用纤维蛋白溶解物;若胸腔内仍有大量积液存留,在判定无支气管胸膜瘘发生的前提下,推荐使用纤维蛋白溶解物。通常的用法是:尿激酶100 000U,或链激酶250 000U溶于250ml生理盐水中,每次取该液体75~100ml,通过胸腔引流管注入胸腔,注入后夹闭胸引管,同时嘱咐患者轴向翻身,以使药液充分混匀。在1~4h后,松开胸腔引流管,尽可能吸净胸内积液并记量。上述过程可在2h后重复进行,推荐每日3次。
拔除闭式胸腔引流管的指征是:①患者的临床症状改善,包括体温和血白细胞正常等。但若有明确的其他部位感染(如持续的肺炎)的存在,且胸膜腔引流已经非常满意的前提下,并不绝对要求血白细胞和体温必须正常才能拔管。②拔管前必须先做影像学检查,如果CT或胸部X线片等证实仍有积液存在,且临床症状改善不彻底,就不要拔管。③24h以上的胸腔积液引流量不超过20ml。
若胸腔闭式引流仍不能有效排出脓液,且CT检查示脓液稠厚、多发分隔、经皮无法充分引流时,就需要外科手术处理。常用的手术方法有肋骨切除引流术、开胸术、胸腔镜辅助下的胸膜剥脱引流术,以及时机成熟时行开放式引流术等。
(1)肋骨切除胸腔引流术:是指在全身麻醉下,在脓腔最低位置切除一小段肋骨,打开脓腔清除其内的所有分隔,吸净腔内脓液,冲洗胸腔,皮肤另处打孔放置胸腔引流管,有条件者可接负压吸引。胸管放置2~3周后,脓腔缩小,引流量逐渐减少,当每日引流量少于20ml,胸腔引流管内的液面波动幅度微弱,且将胸腔引流管打开暴露在空气中也不会造成气胸时,就可将胸腔引流管在距胸壁1cm处剪断,变成开放式引流,用安全别针和胶布固定胸管,以免胸管脱出或滑入胸膜腔,外覆盖较厚层的敷料,注意随时更换敷料。随着肉芽组织生长和纤维化填塞脓腔,胸管逐渐被推出,这样每周剪短数厘米,直至肉芽组织填满脓腔,胸引管完全被挤出体外,达到脓腔的完全愈合。在开放引流的过程中,可做脓腔造影,以了解脓腔的大小及愈合的快慢,不要强求快捷而盲目将胸管拔出,以免遗留残腔,造成日后脓胸再发。
(2)开胸术:在胸腔镜广泛应用之前,处理脓胸非常有效的方法之一就是胸腔切开术。开胸进行脓胸的清创和早期的胸膜剥脱治疗急性期脓胸,其高疗效和低死亡已被众多资料所证实。Mandal团队(1998)报道,在他们做的76例开胸清创并行胸膜剥脱治疗急性脓胸的病例中,治愈率为88%,病死率为1.3%。早期脓胸患者行开胸胸膜剥脱术的指征为患者一般状况尚可,能耐受全身麻醉,脓液已形成多房分隔,虽经胸腔引流术后肺组织仍然膨胀不全,此时仅行脏层胸膜剥脱就可使肺迅速膨胀,壁层胸膜自然就会变薄。
(3)胸腔镜手术(VATS):在20世纪90年代以后,胸腔镜手术作为治疗复杂性脓胸的手段逐渐推广开来。胸腔镜技术在治疗过渡期脓胸的粘连松解、分隔的清创中,比传统的小开胸具有更好的视野显露。在纤维板形成以前做胸膜剥脱以使肺复张,胸腔镜下也同样容易完成。尽管胸腔引流联合应用纤维蛋白溶解物能达到较好的治疗脓胸的效果,但与之相比,胸腔镜治疗的成功率更高、住院时间更短、花费更少。Wait的团队在1997年的报道中得出结论,对于胸腔引流联合应用纤维蛋白溶解物治疗脓胸失败的患者,胸腔镜手术可以作为一个常规的处理手段。胸腔镜手术的具体操作过程,参考其他章节,在此不再赘述。
2.慢性脓胸的处理 由于急性脓胸诊断较晚、急性期使用抗生素治疗感染不及时或不合理、脓胸引流不充分、肺部手术后胸腔感染,长期存在的感染源如支气管胸膜瘘、气管或肺内异物存留、膈下脓肿、肋骨骨髓炎等,以及一些特异性感染如结核或真菌感染等,均可造成慢性脓胸的发生。往往是在急性脓胸发作后6周左右的时间进入慢性脓胸期。
慢性期脓胸的治疗原则是:①改善患者的一般状况,提高患者自身体质,为进一步治疗做准备;②合理应用抗生素,控制感染;③消灭脓腔,尽可能促使肺复张。
慢性脓胸患者因长期感染和慢性消耗,往往营养不良、身体衰弱。为抵御感染、进行下一步的手术治疗,恢复、增强患者体质非常重要。具体措施包括鼓励患者下地锻炼,摄入高热量、高蛋白质饮食,必要时输入蛋白质和少量多次输血来纠正低蛋白血症和贫血,维持体内水、电解质平衡;加强呼吸道管理,改善肺功能;选用敏感抗生素,要考虑到特异性感染如结核或真菌感染等。经充分准备、条件成熟时,就可以考虑手术治疗。常用的手术方式有:胸壁开窗术、脓腔灭菌术、肌瓣移植填充术、脓腔切除胸膜剥脱术、胸廓成形术等。
(1)胸壁开窗术:对于一般状况较差不能耐受纤维板剥脱术、经闭合或开放式引流治疗不成功、伴有或不伴有支气管胸膜瘘的全肺切除术后的脓胸患者,可采用创伤较小的胸壁开窗皮瓣翻转引流术。此方法最早由Eloesser于1935年用于治疗急性结核性脓胸,之后经多次评价,认为此方法更适合治疗慢性脓胸。但当脓胸所处位置较高,如在腋窝区或高位椎体旁时,此操作较困难。胸壁开窗皮瓣翻转引流术的具体做法是:全身麻醉,双腔气管插管(针对支气管胸膜瘘),从脓腔最低处的肋骨为起点,向上做一纵向长为10~12cm,横向长为6~7cm的U形皮瓣,切除掉位于脓腔上的2根肋骨连带肋间肌、神经血管束以及壁层胸膜,打开脓腔予以充分清创,注意不要损伤脏层胸膜,更不要打开已经粘连封闭的脏壁层胸膜,然后将游离的皮瓣翻转缝到壁层胸膜上形成脓腔的衬里,进行持续引流(图8-15)。其优点是可以在直视下清除脓腔坏死物及纤维素条索,进行脓腔清洁消毒术(无菌残腔技术),随着脓腔的缩小变成无菌的干腔。经过长期的生长,少数脓腔不大的患者残腔可以完全消失并上皮化,仅在胸壁上留下瘢痕。然而多数患者因窗口太大而无法自行闭合,需要长期开窗或再次手术处理。胸壁开窗皮瓣翻转引流术的缺点是由于需要等新生的肉芽组织填塞残腔,故需要很长的等待时间;另外反复长期的换药也是一件非常麻烦的事情。
(2)脓腔灭菌术(无菌残腔术):基于胸壁开窗术基础上的脓腔灭菌术(无菌残腔术),是指每日用生理盐水或碘仿溶液(20∶1)或50%的Dakin液(次氯酸钠稀溶液)或其他灭菌液来冲洗脓腔,并用浸湿的敷料填塞脓腔,持续6~8周,使脓腔达到清洁无菌的目的。Clagett等在1963年报道了脓腔清洁消毒法治疗全肺切除术后脓胸患者,其一期采用开窗引流、脓腔清洁术;二期拆除皮瓣、切除开窗的边缘,腔内注满抗生素溶液,逐层缝合胸壁伤口。其后又见多组报道,总体来讲,采用上述方法治疗全肺切除术后脓胸,对不合并支气管胸膜瘘的患者,有效率为50%~70%;合并支气管胸膜瘘的患者,其有效率为5%~10%。此方法还可用于未做过全肺切除的病人。

图8-15 胸壁开窗术
(3)肌瓣移植填充术:鉴于治疗慢性脓胸的失败多与支气管胸膜瘘长期不愈或复发有关,Samson于1973年提出采用移植肌瓣加固闭合支气管胸膜瘘。Pairolero等在1992年报道了21例全肺切除后脓胸合并支气管胸膜瘘的患者,采用改良的Clagett术治疗,即在两期手术之间,缝闭支气管胸膜瘘,支气管残端用移植肌瓣缝合加固,其中20例(95%)获得了成功。肌瓣移植术消灭长期存在的脓腔以及在关闭支气管胸膜瘘后加固残端,已被广泛应用。移植肌瓣填塞术成功的关键是不仅要保留移植肌肉的活性(包括血液供应、神经分布等),还要考虑脓腔的位置、大小和形状。如果脓腔在胸腔上部,建议用胸大肌;在胸腔的后下方,最好用背阔肌或前锯肌。在术中还要使移植的肌肉填满整个脓腔,因为如有残腔存留,很易导致脓胸复发。对于支气管胸膜瘘的处理,过去的观点认为:若支气管胸膜瘘口直径<2mm则不必处理,大的支气管胸膜瘘应修剪后严密缝闭,最后用移植的肌瓣加固残端。现在部分学者认为,支气管胸膜瘘口无论大小,都应当直接缝合或用肌瓣(网膜等)覆盖闭合。术后脓腔引流要保留10~12d。Miller及其同事在1984年报道了移植大网膜充填残腔治疗全肺切除术后脓胸,也取得了非常好的效果。
(4)脓腔切除术和胸膜剥脱术:慢性脓胸的脓腔切除术是指将脓腔及其内容物完全清除;胸膜剥脱术是将增厚的限制胸廓和肺活动的纤维板剥除。两者的目的都是消灭残腔控制感染,促使肺复张,恢复肺、胸壁和膈肌的呼吸功能。
脓腔切除术是指保持脓腔囊壁的完整性,避免切开囊壁,这样既可以减少污染,又能完整切除脓腔。手术操作通常要去除部分肋骨,从壁层胸膜外沿着肋骨表面剥除囊壁,有时囊壁和肋骨之间没有明确的界限,甚至囊壁的纤维组织和肋间肌都分界不清,此时剥除既困难,又容易出血。当沿着壁层胸膜外剥除较厚硬的胸膜,遇到正常软薄度的胸膜组织时,就可从此处打开壁层胸膜进入胸腔。然后沿肺表面剥离脏层胸膜,此时在坚硬的囊壁和肺之间往往有较疏松的层面,剥离较容易完成,最后将脓腔完整剔除。
慢性脓胸的胸膜剥脱术只有在以下情况时才考虑进行:①增厚的胸膜已存在数周以上;②呼吸困难已影响到日常生活;③肺功能的受损是可逆性的。胸膜纤维板剥除术选后外侧切口,通常经第6肋间或第7肋间开胸(显露膈肌较好),因慢性脓胸患者的肋间隙变窄,为求更好的术野,通常去掉部分肋骨,先将切口两侧的壁层胸膜分离出数厘米,无脓腔时,用手术刀切开厚硬的纤维板直至脏层胸膜(有脓腔时可做脓腔切除术或切开脓腔清创术),通常在此交界区有一解剖平面利于游离,采取钝、锐性手段直到将肺与壁层胸膜分开,然后将肺从膈肌、心包、纵隔面上松解下来。通常情况下,肋膈角处的纤维板非常致密,剥离非常困难,有时不得不放弃。对于剥除壁层纤维板尚有争论,反对者认为,通过剥除脏层胸膜纤维板已经达到了使肺复张的目的,不必再增加较大的创伤去强求剥除。支持者认为,去除增厚的壁层胸膜对于胸廓运动功能的充分释放有益,能更好地改善肺功能。剥除的过程会造成许多肺裂伤,较大的裂伤一定要缝合。有时为了清除感染彻底,不得不切除邻近的肺段或肺叶,很少做全肺切除。术毕,最好放置2根引流管。
胸腔镜下的纤维板剥脱术,近几年来开展较多,主要还是适用于脓胸早期(过渡期)清除纤维分隔以及剥除尚不十分致密的脏层纤维板,具有创伤小、显露好、操作方便的优点;一旦脓胸发展到了机化期,胸腔镜的作用将十分有限。
胸膜纤维板剥脱术的并发症主要有出血、支气管胸膜瘘、细支气管肺泡漏气、脓胸或伤口感染等。因此,在操作过程中除要求具有专业知识外,还一定要细心加耐心,尽量避免并发症的发生。
(5)胸廓成形术:当脓胸患者经胸管引流后脓腔不能闭合且肺也不能有效膨胀来消灭脓腔,没有满意的肌肉瓣或网膜填塞残腔,或无法填充满残腔时,就需要考虑胸廓成形术。胸廓成形术就是通过去除肋骨造成胸壁塌陷并贴在肺表面上,从而消灭残腔的一种术式。但由于这种破坏性较大的残毁性手术往往让患者难以接受,且在过去一段时期内,胸廓成形术死亡率偏高,故在临床上的应用明显减少了。随着医学的进步和后人对此项术式的不断改进,胸廓成形术的技术逐步完善。现在应用的胸廓成形术的术式很多,如胸膜内胸廓成形术、胸膜外胸廓成形术、胸廓填充术、局限性胸廓成形术等。近年来的研究表明,对于有良好适应证的患者,实行胸膜外胸廓成形术,可以取得极好的治疗效果。Hopkins等在1985年报道了对经过选择的30例患者,施行了胸膜外胸廓成形术,其死亡率为10%,存活者中有82%患者的残腔达到了永久性闭合。Gregoire等在1987年报道了对17例全肺切除术后脓胸的患者施行Ⅰ期胸廓成形术,全组无手术死亡,15例(88%)患者取得了很好的疗效。以下分别阐述各种胸廓成形术式。
①胸膜内胸廓成形术。需切除多根肋骨,同时切除骨膜、肋间肌、肋间神经血管以及壁层胸膜,将留下的皮肤和胸部肌肉塌陷,消除残腔。
②胸膜外胸廓成形术。该术式由Alexander于1937年首创,后经多次改进,使此术式逐渐完善。该术式多采用胸壁常规后外侧切口,要求切除足够数量的肋骨,同时保留肋骨骨膜、肋间肌以及壁层胸膜。切除后肋时,内侧可达横突,以使脊柱旁的组织达到最大程度的塌陷。为了维持颈、肩带和上部胸廓的完整性,保留第1肋是必要的。当把骨膜从肋骨上剥离开来、使肋骨充分游离后,即可在胸膜外采用压迫的手段,将与肋骨分离开的软组织塌陷填塞残腔。术后2个腔隙都应放置引流,胸腔闭式引流一直要等到残腔完全闭合之后再拔除;而胸膜外引流管因是放在非感染性腔隙中,多在术后4~5d拔除。
③胸廓填充术。此术式不用去除肋骨,而是将肋骨与骨膜游离开后,使用一些填塞物,如有机玻璃(聚甲基丙烯酸酯)球、橡胶球、明胶、纱球等,充填在肋骨与骨膜及胸内筋膜之间,使骨膜、胸壁软组织及壁层胸膜受挤压塌陷,消除脓腔。但由于填充物容易造成感染,目前临床上已较少采用此术式。
④局限性胸廓成形术,是指切除少量的肋骨而使胸壁局部塌陷,达到消灭残腔的目的。
临床上较常采用的是胸膜外胸廓成形术,由于胸廓成形术破坏性较大,且慢性脓胸患者多有长期的消耗,因此做好术前准备非常重要,包括营养支持、纠正贫血、维持水电解质平衡、加强体质和肺功能锻炼等。
另外,胸廓成形术还用来治疗复杂的胸膜肺曲霉病,以及肺切除后余留残腔的处理上。对于全肺切除后脓胸患者,胸廓成形术较残腔填充术及无菌残腔术效果更好。胸廓成形术几乎从不用于治疗肺底部脓胸,因为在肺底部胸廓成形术使胸壁充分萎陷的可能性很小,很难达到消灭残腔的目的;对于此部位的残腔通常用胸廓开窗引流术或肌瓣(或网膜)填充术治疗效果较好。
胸廓成形术的并发症:术后并发症有心力衰竭、呼吸衰竭、感染、支气管胸膜瘘、残腔未闭合等,远期并发症可有胸廓畸形、脊柱侧弯、肩部活动受限、皮肤感觉异常等。这些并发症多可经术前充分准备、合理规划手术范围,术中仔细操作、术后康复锻炼等加以克服。
胸廓成形术的死亡率和预后:胸廓成形术的死亡率在0~10%;预后较满意,有80%~90%的患者残腔消失。
(李单青)
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。
















