标记免疫分析方法须具备3种基本条件,即标记抗原、未标记抗原和抗体。标记抗原的方式不同,免疫分析的方法就不同,关于这一点,我们将在后面进行详细介绍。
抗原(Antigen)是指能刺激机体产生(特异性)免疫应答,并能与应答产生的抗体或者致敏淋巴细胞发生特异性反应的物质。抗原的这种刺激机体产生特异性免疫应答的性质被称为抗原性或者免疫原性(Immunogenicity)。能与特异抗体作用并能引起免疫应答的物质被称为全抗原(Holoantigen);能与特异抗体作用但无免疫原性即不能引起机体免疫应答的物质被称作半抗原(Hapten)。
全抗原通常为蛋白质、多肽等分子量较大、化学结构复杂的物质。半抗原一般为分子量较小的多糖、脂类等非蛋白类物质,其本身不能引起机体的免疫应答,但是作为载体与蛋白质结合后,即可获得“免疫原性”而成为全抗原。如青霉素是一种半抗原,它本身没有免疫原性,在其进入体内后,如果其降解产物和组织蛋白结合,就获得了免疫原性,并刺激免疫系统产生抗青霉素抗体。当青霉素再次注射人体内时,抗青霉素抗体立即与青霉素结合,产生病理性免疫反应,出现皮疹或过敏性休克,甚至危及生命。此类小分子半抗原与大分子的载体蛋白结合后所形成的全抗原叫做人工抗原(artificial antigen)。人工抗原也具备免疫原性,能刺激机体产生免疫应答。
临床上应用的药物大部分为小分子的半抗原,因此必须结合相应的载体后才能成为人工抗原。其中,牛血清白蛋白具有较高的溶解度,免疫原性强,取材方便,是最常用的载体。除天然蛋白之外,还有一些人工合成的高分子化合物,如人工合成多肽同样可以用作载体。半抗原(待测药物)需要通过特定的官能团和载体相结合后形成人工抗原。常见的活性官能团包括羧基、氨基、酚羟基、巯基、胍基、咪唑基和吲哚基等,其中氨基、羧基和酚羟基最为常见。若待测药物中不包括活性基团,可以通过化学方法引入上述活性基团后再与载体相结合。半抗原或者引入活性基团后的半抗原通过共价键或者配价键与载体相结合形成稳定的半抗原-复合物。一般反应在较温和的条件下进行,以防止载体蛋白变性,通常反应在温度为37℃、pH接近中性的条件下进行。其次,为保持抗原的免疫特性,要特别注意半抗原和载体结合的位置,要使得反应后抗原决定簇尽可能暴露在外面而不被其他结构覆盖或者掩埋。
常见的半抗原和载体的连接方式有碳二亚胺缩合法、混合酸酐法、戊二醛法、二异氰酸酯法、过碘酸盐氧化法等。下面就这几种连接方式进行简单介绍。
(1)碳二亚胺缩合法:该法适用于药物本身结构上有羧基或者有引入羧基时,羧基可以和蛋白质载体上的氨基发生脱水缩合从而形成肽键。具体反应过程如下:
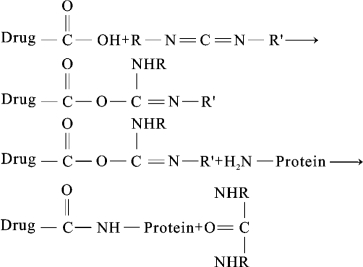
据碳二亚胺上两个取代基R和R’的极性差异,可以将其分为水溶性碳二亚胺和脂溶性碳二亚胺。其中水溶性的能使载体蛋白质和药物在水中短时间内反应,所以其应用更广泛。值得一提的是,反应完全后,应该将反应液中生成的药物-载体蛋白复合物纯化后冻干保存备用。
(2)混合酸酐法:混合酸酐法指的是以氯甲酸异丁酯作为缩合剂,先与含羧基的药物在碱性条件下生成混合酸酐后,再与载体蛋白上氨基缩合形成肽键的反应方式。该法得到的药物-载体蛋白复合物同样需要纯化后冻干保存备用。具体反应过程如下:

含羟基的药物通常通过特定的反应将羟基转化为羧基衍生物后再采用碳二亚胺缩合法或者混合酸酐法使之与载体蛋白上的氨基缩合。引入羰基的常见方法主要包括以下2种:
①琥珀酸酐法:琥珀酸酐法指的是采用琥珀酸酐在无水吡啶中与半抗原中的羟基转化为半抗原的琥珀酸衍生物,继而与蛋白质上氨基缩合的反应方式。具体反应过程如下所示:
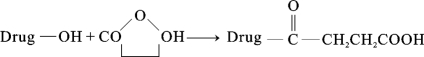
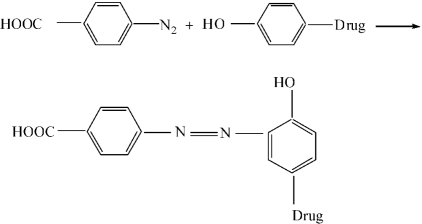
②重氮化的对氨基苯甲酸法反应:该法是用重氮化合物重氮化的对氨基苯甲酸作为反应原料,将药物分子R上的羟基羧基化。具体反应过程如下:
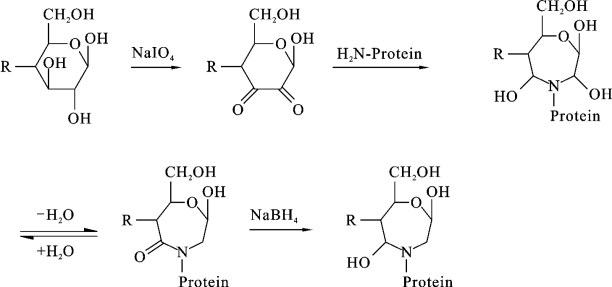
(3)戊二醛法:戊二醛法适用于半抗原中带有氨基的情形,原理是利用戊二醛上的2个活性基团将药物分子和载体蛋白上的氨基以共价键方式结合后在四氢硼钠的作用下形成完全抗原。其具体反应过程如下:

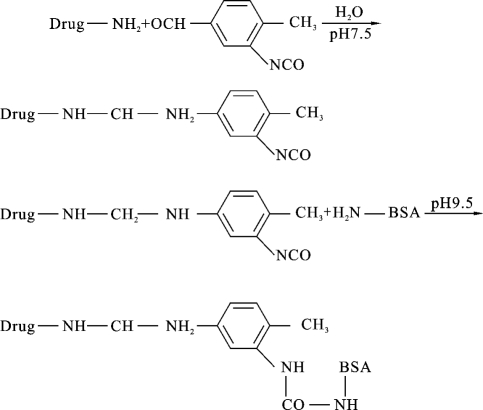
(4)二异氰酸酯法:此法也适用于药物分子中带有氨基的情况,原理是二异氰酸酯类双功能试剂中的2个异氰酸分子分别与2个不同分子上的氨基作用,然后以不同碳链长度的桥将两者偶联。具体反应过程如下:
(5)过碘酸盐氧化法:糖类或者含糖基分子中的邻二醇结构可被过碘酸钠氧化为醛基,继而再与载体蛋白上的氨基形成Schiff氏碱。具体反应过程如下:
除上述所介绍方法外,还有对-肼基苯甲酸法、O-羧甲基羟胺法等,在实际实验操作中,可根据具体的待测药物性质和实验条件进行选择。
非标记抗原即标准抗原,一般在免疫分析实验中用作标准物质。跟其他标准品类似,它是指由专业机构提供的,能达到相应纯度,其免疫活性和被测抗原相同的标准品。
一般来说,标准抗原应具有以下几点要求:标准抗原与被测物应属同一种物质;在与抗体发生反应时,应与被测物具有相等的活性和亲和力;高度纯化,通常使用的标准抗原纯度应该不低于90%,且杂质不影响免疫反应的进行和含量的测定;能够准确定量。
标准抗原可以划分为3种级别:质控标准、国家标准和药盒标准。质控标准指的是使用单位自行配置的标准品,其中抗原含量经过测定或用高级别的标准品校对过。国家标准是高度纯化的标准品,并与各国的标准及世界卫生组织(WHO)的标准进行过比对,作为国家的基准。药盒标准是一般纯化的标准品,应与国家标准进行比对。
抗体(Antibody)指的是抗原作用于机体后发生免疫反应所产生的能与该抗原发生特异性结合的免疫球蛋白。在免疫分析中所用到的抗体包括单克隆抗体(Monoclonal Abtibody,McAb)和多克隆抗体(Polyclonal Abtibody,PcAb)两大类。两类抗体的制备过程、自身特点和适用范围均有所差异。Kohler和Milstein在1975年首次利用B淋巴细胞杂交瘤技术制备出单克隆抗体,并因此获得1984年诺贝尔奖。单克隆抗体指的是由经过特定的抗原处理过的效应B细胞和骨髓瘤细胞杂交得到的杂交瘤细胞产生的具有特异性识别某抗原上的某一个特定抗原决定簇的抗体。由于是由单一杂交瘤细胞产生的纯抗体,故称单克隆抗体。而多克隆抗体指的是将抗原直接免疫实验动物所得到的抗体。由于每种抗体均能识别一种抗原决定簇,所得抗体实际上为多种抗体的混合物,故称多克隆抗体。
单克隆抗体的优势是针对性强,特异性好;劣势是其制备难度大,价格高,且使用过程容易受到目标蛋白降解的影响。与之相比,多克隆抗体制备较为简单、价格便宜、稀释度大,但是由于其化学结构随着免疫动物等因素变化而变化,使得它的特异性较差,并且易受结构相似的其他药物的交叉免疫干扰,为测定过程带来障碍。
单克隆抗体的制备过程主要包括:①致敏淋巴细胞的准备;②骨髓瘤细胞的准备;③细胞融合;④选择性培养;⑤抗体分泌细胞的筛选;⑥克隆化过程。具体操作过程如图7-2所示。
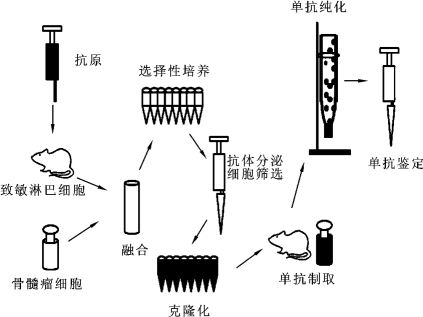
图7-2 单克隆抗体的制备过程
一般来说,多克隆抗体在免疫分析中应用更为普遍,下面将着重介绍多克隆抗体的制备。
(1)免疫动物的选择
供免疫用的动物主要为哺乳动物或者家禽,最好选用适龄的健康雄性动物。常用的包括绵羊、家兔、豚鼠、小鼠等。动物的选择常常要由抗体的用途决定。通常,如果要获得大剂量的抗原,多采用大型动物;若对抗原的纯度要求较高,则常采用纯系小鼠制备。
(2)抗原的免疫剂量
抗原的免疫剂量取决于免疫动物的种类、免疫方案及所需抗体的特征等因素。一般而言,小鼠的首次免疫剂量为50~400μg/次;大鼠为100~1000μg/次;家兔为200~1000μg/次。此外,注射途径也会影响免疫剂量,通常而言,静脉注射剂量大于皮下注射,大于趾内皮下注射。若要制备高度特异性的抗体血清,宜采用低剂量短程免疫法;若要制备高效价的抗体血清,则宜采用大剂量长程免疫法。
(3)佐剂的使用
为增强抗原的免疫原性或者改变免疫类型,常加入佐剂来增强机体内的免疫应答。常用佐剂有弗氏佐剂、脂质体、氢氧化铝佐剂、明矾、石蜡油等。其中弗氏不完全佐剂(Incomplete Freund Adjuvant,IFA)是油水乳剂佐剂,它是将羊毛脂和石蜡油按1 5比例充分研磨混匀制得的。弗氏佐剂的活性很强,应用较为广泛,但是副作用较大。弗氏完全佐剂(Freund Complete Adjuvant,CFA)的制法是取弗氏不完全佐剂10 mL,加入事先灭活的卡介苗10~200 mg,研磨至油包水状态后即可。与IFA相比,CFA的副作用较小,但是活性较低。氢氧化铝佐剂是常用的盐类佐剂,其制备方法是取5%的硫酸铝溶液250 mL,在强烈搅拌状态下加入5%氢氧化钠溶液100 mL,然后用生理盐水离心洗涤沉淀2次,再加入生理盐水至250 mL即得。该类佐剂对体液免疫的作用很明显,与抗原共同注射时,能显著增加抗体滴度而增强免疫应答,常用于制备生物制品。
(4)抗血清的制备
当动物体内抗体数目达到需要量时,应及时采血。大型动物如马、绵羊等常采用颈动脉分部采血;小鼠、家兔等小型动物则常采用一次性采血。放血过程中要严格按无菌要求进行。收集的血液置于室温下1 h左右使之凝固,置于4℃下过夜(切勿冰冻)析出血清,在4000~10000 rpm下离心10 min。然后在无菌条件下吸出血清,分装(0.05~0.2 mL),贮于-40℃以下冰箱或冻干后贮存于4℃冰箱保存。
评价抗血清质量的指标主要有滴度、特异性和亲和力。抗血清的滴度又叫效价,就是指抗血清中所含抗体的浓度或含量。滴度测定的方法常采用对所有的抗体均适用的放射免疫分析法。滴度以反应液中抗体(抗血清)的稀释度表示,稀释度越大表示滴度越高。下面简单介绍一下RIA法测定抗血清的方法:首先将抗血清用空白血清按规定比例稀释,精密吸取各稀释血清等量分别加入试管中,再将定量的同位素标记药物(假定放射性强度为T)加入各试管中。在适当湿度条件下育温一定时间,待标记物和抗体的结合反应达平衡时,加入分离剂,分离出与抗体结合的标记药物(位于沉淀层中),并测定其放射性强度(T),计算各管中的标记药物的结合率B/T(%),并以稀释度为横坐标,结合率B/T(%)为纵坐标得到抗血清学滴度曲线,如图7-3所示。
由图7-3可见,滴度曲线呈现“S”形。当抗血清的滴度足够低时,其结合率会趋于一极值,即为“过量抗体结合率”,此时标记药物全部处于结合状态,如图中AB段。随着抗血清的稀释倍数变大,标记药物结合率降低,而曲线上C点表示的是50%结合率时对应的稀释度,即为滴度(Titer)。滴度过高或者过低均会影响药品的测定,一般来说,实际工作中常采用50%结合率对应的抗血清稀释度作为工作稀释度。此外,抗血清的滴度越大,实验中需要的抗血清量就会相应减少,能够节约成本,好的抗血清的滴度通常大于10000倍。

图7-3 抗血清的滴度曲线
抗血清的特异性或称专一性是指抗血清对相应的抗原及近似的抗原物质的识别能力。特异性好的抗血清的识别能力强。通常,特异性是以交叉反应率来表示的,交叉反应率低,表示抗血清的特异性好,反之则特异性差。交叉反应率一般是用竞争抑制曲线来判断的。以不同浓度的抗原和近似抗原物质分别做竞争抑制曲线,计算各自的结合率,求出各自在IC50时的浓度,计算交叉反应率。
亲和力是指抗体与结合抗原体的活度或牢固度。抗体与抗原结合疏松,结合后会迅速解离,称为亲和力低;反之,亲和力高。亲和力的高低是由抗原分子的大小、抗体分子的结合位点与抗原的决定簇之间的立体结构型是否合适决定的。亲和力大小用亲和常数(affinity constant)Ka值来表示,Ka=k1/k2,一般要求Ka值为1010~1012 L/M,但也有高达1014 L·mol-1的。
Ag+Ab![]() Ag-Ab
Ag-Ab
亲和常数Ka的计算最常用的方法是标准作图法:即以B/F为纵坐标,以[B]为横坐标,得到一条直线,其斜率的负数即为Ka,图7-4所示为抗胃癌McAb3G9及3H11亲和常数Ka的测定及3H11亲和常数测定曲线。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。














