过去的30年中,许多心脏病包括急性心肌梗死、充血性心力衰竭和各种心律失常的治疗均取得了重要进展。然而,这些治疗进展,以及缺血性心脏病的一级预防取得的成绩,很快使大家注意到老年群体心脏病患病模式的变化。这些“新”的疾病包括显著的非收缩性(舒张性)心力衰竭,其与左心室肥厚、心房颤动易感性、主动脉狭窄和糖尿病心脏病相关。而且,慢性心肌缺血和收缩性心力衰竭的治疗进展使得“悲哀的幸存者”(sad survivor)明显增加:患者活着但有明显症状,生活质量严重受限。再血管化对减轻症状、改善预后的预期,特别是“绝望”的再血管化尤其需要我们重新审视医学治疗的观念。
一、心肌能量代谢损害:不止是局部冠脉灌注的问题
改善急性和慢性心脏病心肌能量代谢可能代表了一种有吸引力的治疗理念,可追溯到最初采用葡萄糖、胰岛素和氯化钾(极化液,glucose,insulin and potassium,GIK)治疗急性心肌梗死的观念。GIK治疗至今仍有启发意义:给予外源性的胰岛素可抑制心肌产生和摄取游离脂肪酸,因其对心肌有潜在毒性;增加葡萄糖供应和利用,使其成为心肌能量的主要来源,可能增加氧的利用率。急性心肌梗死时GIK的使用至今虽仍存在争议,但讨论的问题已是应如何根据心功能正常和异常、不同的心脏病和心肌代谢状态来选择治疗方法。
一个重要进展是建立了在动物和人体内评估心肌能量状态的方法。ATP产生主要来自线粒体内的氧化磷酸化,随后被转运到能量利用的部位,主要是肌原纤维,此过程需要通过生成磷酸肌酸(phosphocreatine,PCr)来实现(通过肌酸激酶催化)。PCr弥散于可重新形成ATP的肌原纤维中。能量需求增多会导致PCr/ATP比值减少,而不是ATP浓度的下降。因此,PCr/ATP比值可用于测量即刻的心脏能量状态。
31P磁共振波谱易化了心脏能量的测量。这种方法可用于离体的心脏、小动物模型和患者,也可与磁共振成像结合同时测量心功能。由于PCr/ATP比值可再现,因此这种技术代表了心脏的“能量窗口”。目前真正的困难在于如何评价不同部位能量状态的异质性,这种方法不能评价亚细胞水平的PCr/ATP比值,尤其是在内质网水平。
二、心肌代谢的生理和病理
1.脂肪酸代谢 正常成年人心脏中,线粒体的氧化磷酸化构成了能量的主要来源(95%)。60%~90%乙酰辅酶A来源于脂肪酸的β氧化,10%~40%则来源于丙酮酸,由氧化糖酵解和乳酸生成。游离脂肪酸被摄入心脏线粒体,然后进行β氧化。而长链脂肪酸的β氧化通过“肉毒转运体”易化:与线粒体外膜耦联,由抗肉毒碱棕榈酰基转移酶1(carnitine palmitoyl-transferase-1,CPT1)催化;然后到线粒体内膜由CPT2催化脱耦联,释放长链脂肪酸。丙二酸单酰辅酶A负反馈调控CPT1激活(图9-1),代表了心肌脂肪酸利用的主要调控因素。然而,如需合成相同数量的ATP,脂肪酸氧化比糖类需要耗费更多的氧。每个氧原子利用经游离脂肪酸途径可产生2.8分子ATP,经糖类途径则可产生3.17分子ATP。
2.糖类代谢 正常心肌中,糖类代谢代表了小部分的ATP来源,通过糖酵解,丙酮酸生成乙酰辅酶A,进入三羧酸循环。越来越多的证据表明葡萄糖氧化代谢由丙酮酸脱氢酶复合体(pyruvate dehydrogenasecomplex,PDC)调节,将丙酮酸催化为乙酰辅酶A。因此,调节长链脂肪酸的β氧化和葡萄糖氧化通过影响CPT1和PDC活性实现。过量的脂肪酸代谢使线粒体葡萄糖代谢失活,表明乙酰辅酶A浓度增加会间接抑制PDC活性。

图9-1 代谢模式:心肌的能量关联
心肌代谢的潜在治疗调节位点:1.脂肪酸生成(β-肾上腺素受体阻滞剂);2.CPT抑制(哌克昔林,胺碘酮);3.β-氧化(曲美他嗪,雷诺嗪);4.丙二酸单酰辅酶A稳定(MCD抑制药);5.药物直接激活PDC;6.药物的相互作用:AMPK激动药(二甲双胍),调节失耦联蛋白的表达,TXNIP的调节药(胰岛素)。AMPK,AMP蛋白激活酶;CPT,细胞肉毒碱棕榈酰转移酶;MCD,丙二酸单酰辅酶A脱羧酶
心肌能量代谢异常通常见于左心室肥厚、心肌缺血和心力衰竭后的适应不良。心肌肥厚时,葡萄糖酵解加速,但葡萄糖氧化率未增加,导致葡萄糖代谢的两种成分失耦联,质子和乳酸堆积在心肌中。在中度缺血时,尽管脂肪酸水平很高,心肌能量代谢会从游离脂肪酸向葡萄糖途径转化。然而,大部分动物模型中,丙酮酸氧化障碍也在逐渐加重。最终,轻度、中度心力衰竭与进行性下降的脂肪酸氧化相关,与收缩功能损害的严重程度相关,线粒体的氧化能力下降。葡萄糖氧化在心力衰竭的早期增加,以后伴随心肌葡萄糖转运机制下调而下降。早期从外科手术和心脏移植的心肌标本表明衰竭心肌ATP水平只有正常心肌的30%,证实了衰竭心脏的能量耗竭。
3.心肌缺血的能量转化 因为产生同样数量的ATP,脂肪酸比葡萄糖途径耗氧增加10%~15%。心肌缺血时,心肌能量代谢会从游离脂肪酸向优化能量代谢的葡萄糖途径转化(图9-2)。轻度心肌缺血时,心肌的主要能量仍来源于脂肪酸氧化代谢。在中度、重度缺血时,心肌葡萄糖代谢增加,但脂肪酸氧化始终是缺血心肌的主要能量来源。除了较葡萄糖代谢耗氧更多外,缺血时高水平的脂肪酸摄取和分解也对心肌有害。高水平脂肪酸通过直接抑制丙酮酸脱氢酶而抑制葡萄糖氧化,继而导致乳酸和质子在缺血心肌中蓄积,引起心肌细胞内pH下降。因为ATP不仅用于支持收缩功能,而且帮助恢复细胞内离子稳态。因此,心肌缺血时,β-氧化积聚的长链脂肪酸介导了室性心律失常的阈值下降和舒张功能失调。

图9-2 心肌缺血的能量代谢
左图为正常冠状动脉血流时的氧化途径;右图为心肌缺血时的氧化途径
4.心力衰竭中的酮体代谢 心力衰竭的代谢障碍类似于饥饿和糖尿病。饥饿时,肝将大量的脂肪酸转化为酮体(KBs)乙酰乙酸盐和3-羟基丁酸盐。心力衰竭促成肝酮体生成和血浆酮体水平增高。因为酮体可在心肌以浓度依赖的形式迅速转化为乙酰辅酶A,心力衰竭时血浆两倍增加的酮体表明线粒体中满布由酮体转化的乙酰辅酶A。实验研究表明,增加的酮体水平可阻滞三羧酸循环导致心功能障碍。酮体不但阻断心脏能量供应,减少葡萄糖代谢,还改变信号转导,导致胰岛素抵抗。肝肉毒碱棕榈酰基转移酶1为酮体生成最常调节的部位,其拮抗药可改善心肌能量供应。
5.心力衰竭中的代谢机制 虽然心肌代谢异常与心力衰竭相关,近期的研究表明心力衰竭本身也促进如胰岛素抵抗等代谢异常,形成互为因果的恶性循环:心力衰竭-代谢改变-心力衰竭,可能促成了心力衰竭的恶化(图9-3,图9-4)。
许多相互兼容的理论解释了代谢改变、胰岛素抵抗和心力衰竭的相关性。
(1)包括交感神经系统和肾素-血管紧张素-醛固酮系统在内的神经体液系统的激活。
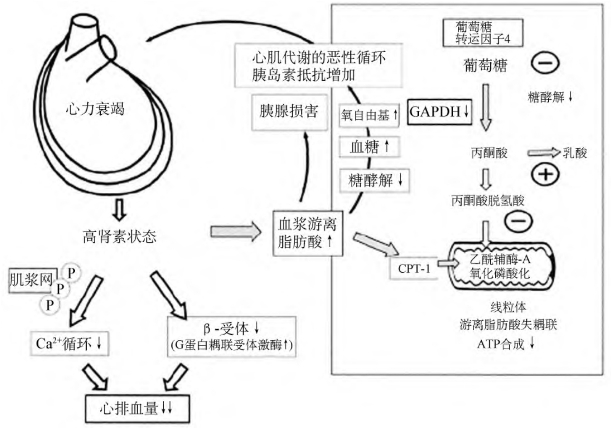
图9-3 心力衰竭引发代谢损害的恶性循环
(2)增加的肿瘤坏死因子和其可溶性受体水平放大了炎症反应。
(3)体能下降导致骨骼肌功能和质量下降。
(4)内皮功能失调。
(5)脂联素和瘦素等肥胖因子增加。
(6)胰岛素抵抗在药物(如利尿药)作用下恶化。其中关于神经体液激活因素的研究最多,在心力衰竭的代谢改变中起着最重要的作用。
心力衰竭和代谢损害的恶性循环:高肾素状态和血浆游离脂肪酸增加,导致胰岛素抵抗(IR)增加。游离脂肪酸抑制糖酵解、心脏和骨骼肌摄取葡萄糖,血浆中的葡萄糖增加(右侧),氧自由基的形成增加。氧自由基可抑制甘油三磷酸脱氢酶(GAPDH)。游离脂肪酸等多因素介致的胰腺损害和高血糖,导致了IR。心脏摄取的血浆游离脂肪酸由抗肉毒碱棕榈酰基转移酶1(CPT1)激活和转运进入线粒体,呼吸链失耦联和氧耗费。以上代谢缺陷加上高肾素状态的细胞水平改变,即肌浆网高度磷酸化和增加的G蛋白偶合受体激酶抑制肾上腺素受体,导致心排血量明显下降。P代表高度磷酸化。
6.能量代谢转化的结果 理论上,从长链脂肪酸利用向高效率的葡萄糖利用(无线粒体氧化磷酸化障碍)可使每个氧分子利用后的ATP生成增加。这种心肌代谢的重要转化可使效率提高13%。然而,葡萄糖利用增加可能会继发大量的代谢改变,包括对心肌AMP激酶(AMPK)活性潜在影响、失耦联蛋白的分泌、硫氧还蛋白相互作用蛋白的表达。以上因素的综合作用均会改变心肌代谢的效率。目前还缺乏足够的证据来评价调控心肌能量代谢的各种因素之间潜在联系和能量代谢转化后的影响。
总之,心肌肥厚、缺血和心力衰竭均与心肌各种ATP生成的机制障碍均有关,特别是心肌缺血和心力衰竭时,代谢倾向于从脂肪酸转化为葡萄糖利用。积聚的未代谢的脂肪酸、质子和乳酸,可能导致对心肌的毒性作用。

图9-4 心力衰竭时通过激活神经体液系统导致胰岛素抵抗
心力衰竭时,交感神经系统和肾素-血管紧张素醛固酮系统代偿性激活,血游离脂肪酸(FFAs)增多,进而抑制肌肉葡萄糖摄取和胰腺损害。血糖升高引发了胰岛素反应。然而,因为细胞因子如肿瘤坏死因子、血管紧张素Ⅱ和FFA介导的胰腺损害均使高血糖不能纠正,最终的结果是代谢紊乱和胰岛素抵抗。增加的血浆FFA和血糖使肝合成三酰甘油增加,血管紧张素Ⅱ水平增加,其反之又会增加肝合成的三酰甘油,损害了胰腺的胰岛素受体底物-1,进而增加了胰岛素抵抗。血管紧张素Ⅱ也促进了血管收缩,恶化了心力衰竭,使图9-3所示的恶性循环周而复始
生理、病理或治疗的方法抑制脂肪酸摄取或氧化均可增加心肌葡萄糖利用,治疗的目的在于增加葡萄糖代谢,使缺血性心脏病和心力衰竭患者获益。
三、心肌能量代谢的调节治疗
1.GIK GIK治疗最初的目的在于增加心肌葡萄糖利用,从而增加心肌能量产生的效率。不仅早期的荟萃分析表明此疗法可使急性心肌缺血的预后明显改善,而且糖尿病急性心肌梗死输注胰岛素-葡萄糖研究(diabetes mellitus insulin-glucose infusion in acute myocardial infarction,DIGAMI-1),在急性心肌梗死患者中输注胰岛素防止高血糖,也能改善预后。然而,近期评估急性心肌梗死治疗的大型多中心临床研究-estudios cardiologicos latinoamerica study显示,在20 201例患者中GIK不能使患者获益。关键是,此研究不能重现DIGAMI-1的结果,尤其是无必要用GIK预防高血糖。而且DIGAMI-2中,总体上GIK不能使急性心肌梗死患者获益。
近年来,用于治疗稳定型心绞痛大量新药通过调节心肌能量代谢,继而改善心肌能量供应而发挥作用。其中最有代表性的药物为哌克昔林和曲美他嗪。
2.哌克昔林 哌克昔林作为预防心绞痛药物已有近40年历史,但当时其作用机制并未真正得到了解,最初认为是冠状动脉扩张药,实际上其扩血管作用非常微弱,后来又归因于其弱的L型钙通道阻滞作用。令人难以置信的是,哌克昔林的抗心绞痛作用非常强,可以缓解许多顽固心绞痛患者的症状。重要的是,哌克昔林无明显的负性肌力作用,可用于心绞痛伴有左心室收缩功能失代偿的患者。
尽管哌克昔林有良好的抗心绞痛作用,由于其有短期或长期的毒性作用,导致了其从1980年开始临床应用减少。特别是长期经常使用哌克昔林导致肝毒性和神经毒性,只有在停止治疗后才能缓慢地逆转,这表明药物引起的磷脂化影响了肝细胞和雪旺细胞。此外,甚至短期的治疗也会导致恶心、眩晕,糖尿病患者用哌克昔林更易患低血糖。尽管有以上问题,哌克昔林的毒性可以预防,当血浆哌克昔林水平>600mg/ml时,长期和短期的毒性作用均可出现。因为哌克昔林的药理遗传学变异性很大,因此采用需要个体化的治疗剂量防止药物蓄积。采用滴定剂量,当药物达到稳定的血药浓度150~600mg/ml时,严重的毒性作用可以被预防。
这些研究结果提示,哌克昔林的治疗可能得到拓展,用于严重心绞痛,以及其他情况如心力衰竭和不能手术治疗的主动脉狭窄。此外,哌克昔林抑制CPT1(进而使CPT2减少),因此可解释其潜在的毒性,也是其抗心绞痛的作用,促使向葡萄糖利用转化。另一方面,哌克昔林增加心肌代谢的作用远不止CPT抑制,因此其他重要的生物化学效应还有待阐明。
3.曲美他嗪 曲美他嗪是一种衍生的他嗪,大量的临床实验显示其为有效的预防心绞痛药物。虽然曲美他嗪抗心绞痛的确切机制还存在争议,但其疗效不能仅归于血流动力学改变。研究表明曲美他嗪抑制了长链3-酮脂酰辅酶A硫解酶,导致其目前归类为一个脂肪酸氧化部分抑制药。近期的临床研究支持上述观念,表明曲美他嗪抑制了心肌的脂肪酸氧化,增加了葡萄糖利用。重要的是,曲美他嗪,虽然抗心绞痛的作用弱于哌克昔林,但无与组织磷脂蓄积相关的毒性作用。
许多其他药物也明显影响心肌代谢,然而目前尚不清楚其是否为此类药的抗心肌缺血机制。
4.雷诺嗪 雷诺嗪的结构类似曲美他嗪,也是一种脂肪酸氧化部分抑制药,有着类似曲美他嗪的抗心绞痛作用。雷诺嗪的抗缺血作用曾归因于晚钠电流阻滞,继发心肌钙内流减少所致。然而,目前还不能确定雷诺嗪的抗心绞痛作用不是部分脂肪酸氧化导致的能量代谢改变。
5.胺碘酮 胺碘酮目前主要的Ⅲ类抗心律失常药物,最初为抗心绞痛药物。实际上,胺碘酮明显抑制了CPT,虽然其效果弱于哌克昔林。胺碘酮的疗效不仅在于抗缺血,而且与组织磷脂化相关,如肝细胞的磷脂化。
6.β-肾上腺素受体阻滞药 许多研究表明,β-肾上腺素受体阻滞药与血浆中游离脂肪酸的减少相关,已有研究显示卡维地洛导致心肌脂肪酸摄取明显减少,但尚未见心肌葡萄糖利用改变。总体上至今尚未明确β-肾上腺素受体阻滞药在缺血和心力衰竭中的获益是否与推定的“代谢”影响相关。
四、展望:新药和新的适应证
许多已应用药物和新药均有改善心肌能量代谢的作用。二甲双胍是胰岛素增敏药,主要通过刺激磷酸腺苷活化蛋白激酶(AMP-activated protein kinase,AMPK)激活,理论上可以改善心肌的氧供。然而,至今尚无临床调查来验证这些可能的疗效。
与之相似的是,一氧化氮(nitric oxide,NO)调节线粒体的电子转移链:难以确定NO的效果在某种临床背景下,是原发于能量代谢改变,还是继发于前负荷和后负荷的减少。
近期的关注集中于调节组织丙二酰-CoA(malonyl-CoA)的浓度,CPT1主要的生理抑制药。抑制丙二酰-CoA脱羧酶(malonyl-CoA decarboxylase,MCD),分解代谢丙二酰-CoA,可能导致丙二酰-CoA浓度增加,从脂肪酸转化为葡萄糖代谢。虽然有一些MCD抑制药已经历了临床前期的研究,而且得到令人鼓舞的结果,但仍需要临床调查来证实。应用这类药物改善能量代谢失调的其他可能适应证,包括适应不良的左心室肥厚,如超高龄患者的主动脉瓣狭窄,肥厚型心肌病和非收缩性心力衰竭以及糖尿病心脏病。此外,这类药物经静脉注射可能重新验证极化液理论下的新假说:迅速优化心肌每分子氧利用生成的ATP可改善急性心肌梗死患者的预后。
治疗心力衰竭相关的代谢异常,目前尚无特异性治疗胰岛素抵抗的药物。虽然以下治疗已明确能改善代谢异常,但目前仍缺乏临床实验的证据(表9-1)。
表9-1 针对心力衰竭和胰岛素抵抗的相应治疗

五、结 论
心肌能量代谢紊乱与适应不良性肥厚、心肌缺血和心力衰竭相关,可能均导致了能量耗竭。在过去的5年中,“代谢类”药物,尤其是哌克昔林和曲美他嗪,应用于稳定的收缩性心力衰竭患者的调查研究增加,特别是在表现NYHAⅢ级的症状。无论是否用传统的药物治疗,这两种药物均可切实改善左心室功能,运动耐量和组织能量状态。因此,有望开展大型的研究,以评估这些药物对心力衰竭患者致残率和死亡率的影响。
(雷 寒 黄 玮)
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。
















