慢性粒细胞白血病(chronic myelogenous leukemia,CML,chronic granulocytic leukemia,CGL)约占白血病的20%,男性稍多于女性(1.4~2.2)∶1,发病年龄多在40岁以上。临床特点有PB白细胞数明显增高,且有幼稚细胞,嗜碱粒和嗜酸粒细胞明显增多,常有贫血和血小板增多,以及肝脾大。细胞遗传学研究表明,90%以上有Ph染色体t(9;22)(q34;q11),分子水平有BCR-ABL融合基因。病程可分慢性期(2~6年)、加速期(1~1.5年)和急变期(3~6个月)。20%~25%无加速期,患者由慢性期直接进至急变期,尤其是急性淋巴细胞急变。
(一)分期特点
按慢性期(CP)、加速期(AP)和急变期(BP)分述如下:
1.CP 亦称稳定期,起病缓慢,20%~40%可无症状,偶因其他原因如外伤性脾破裂,查血常规而发现。常见症状有疲乏无力、贫血、食欲缺乏、消瘦、腹部不适、左上腹胀满、盗汗、低热等。就诊时90%已有脾大,脾不大者可30%~50%,10%~ 40%有肝大,胸骨尤以下端压痛。少见但可以首发症状出现有急性痛风关节炎、脾梗死或脾周围炎所致左上腹或左肩部疼痛,高白细胞所致白细胞淤滞、耳鸣、昏睡、阴茎异常勃起、血管加压素反应性尿崩症。偶因嗜碱粒细胞增高引起的高组胺血症而有高组胺综合征(荨麻疹、哮喘、潮红、心动过速、胃酸过多、溃疡病等)。个别患者有发热性中性粒细胞性皮炎(Sweet综合征),典型表现有:发热,躯干、臂、腿、面部有疼痛性斑疹,结节状紫罗兰色皮损,活检示真皮血管周围有中性粒细胞浸润,对皮质激素反应好。病程中个别有血栓性微血管病,作为副肿瘤综合征或为羟基脲副作用或为向加速期转化的先兆,当血涂片中破碎红细胞>0.02(2%),网织红细胞>0.03(3%)应高度警惕。
血象显示白细胞增高,多>100×109/L,主要为中幼粒细胞以下各阶段粒细胞,嗜碱粒细胞和嗜酸粒细胞增多,单核细胞不增高,<1×109/L,可有少许有核红细胞,多无贫血,一般无泪滴状红细胞,30%~50%血小板增高,3%~7%就诊时以血小板增高为首发,少有血小板减低。
骨髓象显示有核细胞增生明显至极度活跃,以粒系增生为主,原粒细胞<10%,中幼粒细胞以下各阶段粒细胞增多,红系和巨核系减少,有时巨核系可增多,无或轻微病态造血现象。骨髓活检,30%在慢性期早期即有轻度网硬蛋白纤维化。30%骨髓中可见假性Gaucher(或Gaucher样)细胞,由于骨髓细胞转换增强,巨噬细胞葡萄糖脑苷脂酶活性虽正常不能分解过多的葡萄糖脑苷脂而积集所形成。10%可见海蓝组织细胞,这是由于巨噬细胞吞噬脂质经氧化多聚形成蜡样质色素,染色后呈蓝色之故。
中性粒细胞碱性磷酸酶积分(NAP,LAP)减低或为零,亦为CML-CP特点,在鉴别诊断中有意义。
Cohen等诊断CP的五项标准为:①PB与骨髓(BM)原始细胞<0.15(15%);②PB与BM原始+幼稚细胞<0.30(30%);③PB嗜碱粒细胞<0.20(20%);④血小板≥100×109/L;⑤除肝脾大外无其他髓外组织受累。Kantarjian等CP标准月与Cohen等一致,但无⑤。WHO对CML-CP未提出诊断标准。
CP一般2~6年,少数可长达10~20年或更久。CP<1年为慢性早期,>1年为慢性晚期。也有CP不足2年就转入加速期或急变期。
2.AP CML-CP经2~6年逐渐对以前有效的治疗反应差,羟基脲、白消安或其他有效治疗不能控制白细胞增高,不能再使血红蛋白接近或达到正常,也不能使肿大的脾脏缩小或反进行性增大提示进入AP。也有人认为AP是急变早期。至于AP的标准有多种,我国现行为具有下列二项可考虑为AP:①不明原因发热、贫血、出血加重,可有骨关节肌肉疼痛,抗感染及对症治疗无效;②脾脏进行性增大,与白细胞数不相称,加强治疗不能使之明显缩小,甚反继续增大;③对原来有效的药物羟基脲、白消安增加剂量也无效;④非药物相关性血小板减少或增多;⑤PB嗜碱粒细胞≥0.20(20%);⑥PB和BM原始细胞>0.10(10%)<0.20(20%),可有病态造血;⑦BM活检有显著胶原纤维化;⑧出现Ph染色体外的其他染色体异常如双Ph、-5、-7、i(17q)等。
也有患者临床表现不明显,无骨痛、发热、盗汗,仅有贫血加重,白细胞数增高或减低,血小板减少,脾脏进行性增大,甚至脾梗死。血涂片出现小巨核细胞或破碎巨核细胞,BM有明显一系、二系或三系病态造血现象。有人提出外周血三联征:①白细胞>50×109/L,②红细胞压积<25%;③血小板<100×109/L,治疗无效,可考虑进入AP。
Cohen等认为有下列一项即为AP:①PB和BM原始细胞0.15(15%)和<0.30(30%);②PB或BM原粒+早幼粒细胞≥0.30(30%)(原粒<30%);③PB嗜碱粒细胞≥0.20(20%);④血小板<100×109/L。O'dwyer等以符合下列为AP:①PB或BM原始细胞≥0.10(10%)<0.30(30%);②PB或BM原粒+早幼粒细胞≥0.20(20%);③PB或BM嗜碱粒细胞≥0.20(20%);④进行性脾大,4周内增至左肋下≥10cm或较前增大50%;⑤与治疗无关血小板<100×109/L;⑥除Ph染色体外其他染色体畸变。WHO规定符合下列≥1项即可:①PB和(或)BM原始细胞0.10~0.19(10%~19%);②PB嗜碱粒细胞≥0.20(20%);③与治疗无关的持续性血小板减少<100×109/L或持续血小板增多>1 000×109/L,治疗无效;④白细胞增高和脾增大治疗无效;⑤细胞遗传学有克隆性演变。此外,巨核细胞增生,明显网硬蛋白或胶原纤维化和严重粒系病态造血现象,应提示AP,但常与上述要点同存。
3.BP AP经1~1.5年进入BP。Cohen等诊断BP标准为:①PB或BM原始细胞≥0.30(30%);②除肝脾外的髓外器官受累。国内现行标准为符合下列之一即可:①PB或BM原始细胞(原粒、原单+幼单、原淋+幼淋)≥0.20(20%);②PB原粒+早幼粒>0.30(30%);③BM原粒+早幼粒>0.50(50%);④髓外原始细胞浸润,如中枢神经系统(CNS)、睾丸、浆膜、皮肤、软组织、淋巴结或其他部位,如血液学仍缓解,则为纯髓外急变。WHO提出BP标准为符合下列≥1项:①PB或BM原始细胞≥0.20(20%);②原始细胞髓外增殖,和或BM活检下有原始细胞聚集团,即使其他区仍在慢性期。提示BP的原始细胞灶应与CP骨小梁旁和血管周围区明显的早幼粒细胞和中幼粒细胞灶区别。国内执行标准与WHO标准基本一致。
急变的细胞类型,2/3~3/4为髓系急变,形态学为粒、粒-单核、单核、嗜碱粒、嗜酸粒、红白、巨核变等。巨核变者细胞形态似原淋或未分化细胞易有骨髓纤维化。1/3~1/4为淋系急变,多为B淋巴系,很少为T淋巴系。也可双表型,极少数为组织细胞变。染色体畸变可有双Ph、+8、+19、22q-、i(17q)。治疗反应差,多在3~6个月内死亡。也有经治疗而缓解或回至CP。BP的临床表现如发热、出血、贫血等较AP更为严重,也有表现轻微但血液学支持BP。
河北医科大学第二医院血液科于1994年报道117例CML,随访7年,23例(19.6%)BP,其中10例(43.5%)为急淋变,13例(56.5%)为髓系急变。并发现急淋变者骨髓原始细胞%高,PB白细胞数和血小板数较低,少有巨脾,无1例有AP,易有CNS白血病,治疗反应较好(10例中6例完全缓解,2例部分缓解);而髓系急变13例中6例有AP,多有巨脾,治疗反应差,仅4例完全缓解(CR),1例部分缓解(PR)。
Cervantes等(1998年)也观察到CML急淋变有以下特点:①多无AP;②肝脾大少;③PB嗜碱粒细胞较少;④BM原始细胞数较高;⑤无i(17q)或+8;⑥B淋巴系表型多,可有髓系抗原表达;⑦治疗反应较好。19例中6例CR,7例PR,中数生存12个月,而髓系急变中数生存4.7个月。
髓外急变的原始细胞很幼稚,形态学极易误诊为淋巴瘤或未分化癌,但免疫组化和细胞遗传学检查可以鉴别,髓外急变确切发生率不清。
Specchia等(1996)报道235例CML中91例(38.7%)急变。77例为髓系14例为淋系急变,其中15例(16.5%)有髓外急变,髓外部位13例为淋巴结,1例CNS,1例眼球后肿物。15例中11例(73%)为髓系急变(POX+、CD13+、CD33+),4例为急淋变,其中3例B淋巴(CD10+、CD19+),1例T淋巴(CD3+、CD7+),15例诊断CML至髓外急变中数24个月(1~105个月)。3例BM仍为CP,3例BM为CP,9例BM亦为BP。作细胞遗传学及分子检查4例(3例淋巴结,1例脑脊液),均有与BM一样的Ph染色体和M-bcr重排。急淋变者髓外急变多(4/14,28%)于髓系急变者(11/77,14.3%)。
因为BP预后差,结合文献及我们的经验出现下列情况要警惕急变前期,虽然血液学变化尚不足以诊断BP,也应积极治疗:①脾脏进行性肿大治疗无效;②PB贫血加重,血小板进行性减少或增多,白细胞进行性增高,幼稚细胞增多,病态造血明显,嗜碱粒细胞进行性增高;③BM出现明显病态造血,原始细胞增高;④在无感染和未用皮质激素,NAP积分从原来减低或缺如转为正常或增高;⑤血清乳酸脱氢酶和唾液酸增高,胆固醇减低;⑥血红蛋白F增高;⑦有条件做细胞遗传学检查有双Ph或其他畸变;⑧骨髓细胞培养CFU-GM增生、分化和成熟障碍,呈小簇生长,集落减少,分化差;⑨CP经化疗BM抑制,白细胞在短期内快速明显增高,而血红蛋白和血小板无变化或更低。
(二)细胞遗传学和分子检查
>90%CML-CP有Ph染色体或t(9;22)(q34;q11),且为唯一核型异常。此易位使22号染色体上BCR基因与9号染色体上ABL基因融合成BCR-ABL融合基因,有强烈酪氨酸激酶(TK)活性,为CML细胞转化、发病的重要因素,为CML特征染色体已共识多年。Ph染色体见于多能干细胞、粒系、红系、单核系、巨核系、B前体、T前体、T/NK前体细胞,故CML为多能干细胞病。约20%患者除Ph外,还可有-Y、+8、22q-以及其他异常核型。变异时,染色体畸变可有双Ph、i(17q)及其他更复杂的核型。5%~10%有典型CML特点但Ph-,分子水平1/3患者有BCR-ABL融合。
22号染色体上BCR断裂点有3个:M-BCR、m-BCR和μ-BCR分别与9号染色体上ABL外显子2结合使BCR-ABL融合基因大小及转化活性不同,分别转译蛋白P210、P190和P230。M-BCR外显子13或14与ABL外显子2或3分别形成b2a2(e13a2)、b3a2(e14a2)、b2a3(e13a3)和b3a3(e14a3),均转译P210蛋白,为典型CML型融合基因,>90%CML为M-BCR重排。也可有少量m-BCR(急淋型),也可同时有M-BCR和m-BCR。
Abazi分析182例Ph+-CML,6例(3.3%)为变异型Ph有22q11受累而不是经典t(9;22)(q34;q11)分别为:t(9;11;22)(q34;p11;q11),BCR重排为b2a2(e13a2),t(14;22)(q32;q11),分子水平为b3a2(e13a2);t(16;22)(q24;q11),分子水平为b3a2,t(14;22)(q32;q11)和多数异常,分子为b2a2;t(4;22)(p16;q11)未查BCR;t(9;15;22)(q34;q22;q11)亦未查BCR。
浙江医科大学第一医院分析236例CML,204(86.4%)Ph+,其中196例为经典Ph易位,8例为Ph复杂变异易位,52例(25.5%)还有其他染色体异常。
BCR断裂点不同,可影响临床及血液学表现,m-BCR转译P190蛋白,常致单核细胞增高。还有少数CML为e6a2编码P195蛋白,可有周期热,白细胞增高及髓外浸润。少数CML的BCR断裂点在μ区,编码P230,临床血液学特点与经典M-BCR重排不同,表现为:①脏器肿大不明显;②白细胞中等增高,多<50× 109/L,主要为成熟中性粒细胞;③PB幼稚细胞较少,0~7%;④血小板明显增高,可>1 000×109/L;⑤NAP积分低。也有Ph+-CML为e2a2融合,并有-7和双Ph,临床和血液学特点有:①脾大;②白细胞轻度增高<20×109/L,血小板正常,多见有核红细胞;③BM有巨核系增生,多见小巨核细胞,三系病态造血现象及弥漫性骨髓纤维化;④病程进展快,治疗反应差。
Castello等分析14例临床与形态学为CML,但Ph-。分子检查,7例为M-BCR重排,7例为m-BCR重排。Ph-/BCR+者年龄较轻,PB白细胞数较高,单核细胞、血小板数和嗜碱粒细胞均较高,BM红系较少,病变造血明显,NAP积分为零,急变较少。但也有的患者年龄较大,NAP积分较高,治疗反应差。
急变时常有M-BCR和m-BCR重排,m-BCR可促使转化多为急淋变,与P190蛋白引起B淋巴细胞增生有关。急变时除Ph染色体和其他染色体畸变外,一些基因也有变化如P53、Rb1、MYC、P16INK4a、RAS、AML1、EVI-1等,但这些基因在CML变异中的作用尚待阐明。
(三)诊断与鉴别诊断
CML诊断不难,发现有脾脏增大,PB白细胞明显增高,以中幼粒细胞以下各期为主,原始细胞<5%~10%,并有嗜碱粒细胞和嗜酸粒细胞增多,NAP积分减低或为零,BM象与血象相似,即可初步诊为CML。确诊CML必须作Ph染色体,若阴性应作BCR重排,特别对早期患者,仅有长期白细胞轻度增高,20×109/L左右,分类又无幼稚细胞者。如Ph和BCR重排均阴性可否定CML诊断。CML有二型:Ph+/BCR+-CML和Ph-/BCR+-CML。近来,发现有Ph+/BCR-ABL-的CML,这是由于BCR断裂点位多样,而ABL位点相对恒定,我国目前PCR检测都是针对典型BCR-ABL e13a2(e14a2)和e1a2分别转录p210或p190蛋白的,故可出现Ph+/BCR-ABL-的情况,如e15a2、e6a2、e8a2等。一般认为JAK2V617F在CML为阴性。
90%以上CML-CP,NAP积分减低或缺如。要注意低磷血症、阵发性睡眠性血红蛋白尿症、20%特发性骨髓纤维化以及用雄性素者NAP积分也低,在感染、炎症、皮质激素、CML治疗后或变为AP或BP、其他CMPD(PV、ET)、脾切除、妊娠期时,NAP积分均可增高。
AP及BP诊断已如前述。CML应与下列疾病鉴别。
1.与反应性白细胞增多,类白血病反应或PB幼红幼粒细胞反应相鉴别 这些血液学变化可因感染、炎症、骨髓转移癌或实体瘤的副肿瘤综合征所致,常有原发病存在。PB中性粒细胞有毒性颗粒、胞质空泡,幼稚细胞较少,NAP积分增高,Ph染色体和BCR-ABL融合基因阴性。骨髓转移癌时BM涂片或活检标本有异常细胞团簇,正常造血细胞减少或骨髓坏死等。不难与CML区别。
2.与Ph+或BCR-ABL融合基因阳性急性白血病(AL)区别 3%~5%儿童急性淋巴细胞白血病(ALL),20%成人ALL(40岁以上可高达40%)及2%急性髓系白血病(AML)可有Ph染色体或BCR重排,主要是成人ALL。少数Ph+-CML其CP不明显以急变就诊,造成与Ph+-AL鉴别困难。
一般言,Ph+-AL有下列不同于CML-BP的特点:①无CML特征如巨脾、嗜碱粒细胞增多或血小板增多;②无CMLBP常见的染色体异常如双Ph、i(17q)、+8、22q-等;③BCR断裂点在m区,编码P190蛋白;④于缓解后Ph染色体常消失;⑤多数Ph+-AL为杂合,正常核型与异常核型,髓系表型与淋系表型杂合,但不完全这样。2002年Dombret等分析154例成人ALL,其中110例(71%)为Ph+/BCR+;32例(21%)为BCR+(19例Ph-,13例未检核型),12例(8%)Ph+(未检PCR者5例,6例PCR失败,1例PCR阴性)。又进一步分析142例,其中31例(22%)只有Ph染色体,91例(64%)还有其他染色体异常,20例(14%)有双Ph;而且<45岁9%,≥45岁27%有双Ph;分子检查97例(68%)为m-BCR重排,40例(28%)为MBCR重排,5例(4%)为M/m-BCR重排。年龄<45岁,25%,≥45岁41%为M-BCR重排。经治疗81例完全缓解,以PCR法检测微小残留病变,仅13例(27%)为阴性。并发现白细胞数高和m-BCR重排者预后较差。其他资料儿童Ph+-ALL>90%为m-BCR重排,成人则为60%。以上说明Ph+-ALL有异质性,也更增加Ph+-ALL与CML急淋变鉴别的难度。有的为CP不明显的CML-BP,有的为真正Ph+-ALL。笔者意见如有CML特征如巨脾、嗜碱粒细胞增多和血小板增多,又为M-BCR重排,可以认为系CP不明显的CML急淋变;若无CML特征,又为m-BCR重排,可以为原发Ph+-ALL,实在不能区分,可诊为Ph+或BCR+-AL。若有CML病史而BP不宜诊为Ph+-AL。初诊有Ph+/BCR—ABL+的ALL除淋巴结肿大外,还有脾肿大,且PB中除原幼淋巴细胞外易见中、晚幼粒细胞,经治疗缓解后,BM中粒系中晚幼粒细胞较多,及较高的Ph+/BCRABL+细胞%,虽原、幼淋细胞<5%,甚至消失,极有可能为CP不明显的CML急淋变,以急淋变为首发的CML。
3.与Ph+或BCR重排血小板增多症相鉴别 1963年以来,CMPD如PV、ET、MF也可Ph+,尤其是ET可Ph+也可Ph-/BCR+。30%~50%CML-CP可有血小板增多,甚可>1 000×109/L。Ph+或BCR+血小板增多症为ET亚型或为CML亚型或为独立的CMPD尚无一致意见。
众所周知,CMPD为一组原因不明的多能造血干细胞克隆性疾病,增生细胞主要为成熟细胞有CML、PV、ET、MF等。BM细胞增生以某一系为主,其他系细胞亦可增生或减低。CMPD间可相互转化。CML除粒系增生明显外,常伴巨核系增生;ET以巨核系显著增生,粒系亦可增生,红系受累不显著;PV除红系增生外,其他血细胞系有不等程度增生;MF则为成纤维细胞大量增生,其他细胞在早期可不同程度先后增生。Bartl等分析CMPD的BM活检更支持CMPD各型间相互关连和变异。ET的BM病理组织学显示单纯巨核系增生及巨核系/粒系双系增生,巨核细胞形态可小或畸形;CML则45%为单纯粒系增生,巨核系减少,55%为粒系/巨核系双系增生,巨核系有病态,可有亚白血病血象,临床上很难诊为CML;PV更为复杂,可红系/粒系/巨核系三系增生,红系/巨核系或红系/粒系双系增生,也有纯红系增生,以三系增生多见。CML90%以上有Ph染色体,而PV、MF、ET甚至AL都可有Ph染色体,而不是CML或CML-BP。提示Ph染色体累及多能干细胞表示CMPD间的重叠。Ph+或BCR+血小板增多症可有与Ph+-CML一样的BCR重排。经典ET中有BCR重排者可达48%。可能Ph染色体易位分子水平BCR断裂点不同,形成BCRABL融合基因大小不同,编码不同蛋白,持续传导增生信号给不同细胞系,抑制其凋亡,致使某一系细胞增生,而有不同的Ph+白血病和CMPD。如粒系增生发生CML、AL,红系增生优势则为PV,巨核系增生为主则为ET或巨核细胞白血病,淋巴系增生为主而发生淋巴细胞白血病等。
Ph+或BCR+血小板增多症与经典Ph-/BCR-ET的临床表现无明显差异,均可无症状,偶因查体发现血小板增高,可有反复头晕、头痛、肢体末端烧灼、麻痛感,皮肤、黏膜出血、血栓栓塞等,但有以下特点:①几乎均为女性;②多无脾大,少数脾轻度肿大;③血红蛋白正常,白细胞数正常或轻度增高,一般<20× 109/L,分类常正常,可出现幼稚细胞,但明显少于CML所见,嗜碱粒细胞多不增多,血小板无例外增高,多>600×109/L而<2 000×109/L,形态无明显异常;④NAP积分多正常,亦可增高、减低或缺乏。Morris等报道的6例中3例NAP积分正常,2例减低,1例为零。另1组7例中5例NAP积分正常,增高和减低者各1例。另1组Ph-/BCR+血小板增多症12例,NAP积分均正常;⑤BM多纯巨核系增生,亦可巨核系/粒系双系增生,增生的巨核细胞形态可正常,多有小巨核或大而畸形巨核细胞,个别有网硬蛋白纤维化;⑥细胞培养显示CFU-GM和BFU-E与CML相似;⑦细胞遗传学无经典ET常见的20q-,而有Ph染色体或累及X染色体的Ph复合易位t(X;9;22)(q11;q34;q11);⑧分子水平有与CML一样的M-BCR重排,极少数为m-BCR重排;⑨可向AL转化。Stoll等6例中5例于4~7年内转化为AL,1例5年后仍为血小板增多。Morris等6例中1例于4年后进展为AL。另1组BCR+血小板增多症12例,随访22.5个月尚无白血病转化。有人认为白血病转化可能与烷化剂或32P治疗有关。
Ph+或BCR+血小板增多症和经典ET一样虽无CML样白细胞明显增高、巨脾等,但确有一些CML应有的表现和PB出现幼稚细胞、嗜碱粒细胞增高、NAP积分可减低、CFU-GM和BFU-E生长特点同CML,最终可转为AL,故多认为Ph+血小板增多症为CML早期或为血小板增多的CML亚型。Singer等检查31例经典ET(平均病程34月)、18例PV(平均病程71月)、6例MF(平均病程52月)有BCR重排者分别为7例(23%)、4例(22%)和3例(50%),甚至非恶性病对照,16% BCR-ABL阳性,认为不可能是CML的变异型,Ph/BCR仅代表向恶性转化的一次打击,还需要再次打击,进一步变异并有其他基因参与,才能发展为白血病。
所报道的Ph+或BCR+血小板增多症均符合PVSG对ET的诊断标准,只是细胞遗传学Ph+或分子水平BCR重排。因此,有人认为应作为ET亚型。有些表现确与CML伴血小板增多者不同:①前者几乎只见于女性,后者男性稍多;②前者多无脾大,后者常有巨脾;③前者血小板常>1 000×109/L,后者常<1 000×109/L,且可作为由CP向AP转化的一种表现;④前者PB白细胞<40×109/L,多<20×109/L,幼稚粒细胞很少或无,嗜碱粒细胞不增多,后者常>100×109/L,幼稚粒细胞多,嗜碱粒细胞增多,变异时更甚;⑤前者NAP积分多正常,后者几乎均减低;⑥前者BM以巨核系增生为主,后者以粒系增生为主。
无论Ph+或BCR+血小板增多症作为ET亚型,CML亚型或CMPD亚型都有一定理由。笔者倾向于Ph+血小板增多症,但其本质属于CMPD当无疑问。对Ph染色体的特异性似应重新认识。如有JAK2V617F阳性则血小板增多与CML无关为两种CMPD的混合,如JAK2V617F阴性,血小板增多可能为CML伴血小板增多,因一般认为CML为JAK2V617F-。
4.与特发性骨髓纤维化鉴别 30%CML-CP就有轻度网硬蛋白MF,而MF早期三系血细胞可不同程度先后增高,笔者见到一例特发性MF,曾先后诊断为PV、CML和ET,最后经骨髓活检和细胞遗传学检查始确诊为MF。CML与MF有下列不同:①CML白细胞数高常>100×109/L,幼粒细胞较多,很少有核红细胞;而MF白细胞很少>50×109/L,有幼红幼粒血象,泪滴状红细胞明显增多;②CML者NAP积分多减低或缺乏,MF则多正常或增高;③CML>90%为Ph+或BCR重排,MF则为阴性;④CML者JAK2V617F阴性,而IMF50% JAK2V617F阳性。
5.与慢性粒-单核细胞白血病(CMML)鉴别 CMML按FAB分类属于骨髓增生异常综合征(MDS)范畴。有病态造血现象,PB单核细胞增多>1×109/L,BM原始细胞5%~20%,PB白细胞≥13×109/L,CMML为增殖型,<13×109/L为增生异常型。由于CMML有MPD和MDS双重特点,WHO将其列入MDS/MPD类中,PB单核细胞持久>1×109/L至少3个月,原始细胞<5%,BM原始细胞<10%为CMML-1,PB原始细胞5%~19%,BM中<20%或PB与BM原始细胞均<20%,而Auer小体阳性则为CMML-2。Ph和BCR重排均阴性。一般CML单核细胞不增高(m-BCR重排者,单核细胞可增多),Ph+和或BCR-ABL融合基因阳性有助于鉴别。
6.与不典型慢性髓系白血病(aCML)鉴别 临床上aCML酷似CML,不同处在:①PB嗜碱粒细胞较少<0.02(2%);②PB幼稚粒细胞少0.10~0.20(10%~20%),原始细胞<0.02(2%),有病态造血,单核细胞0.03~0.10(3%~10%);③血小板低;④Ph和BCR重排都阴性,可有t(8;9)(p11;q32),故不难与CML区别。
7.与慢性单核细胞白血病(CMoL)鉴别 CMoL少见,WHO关于CMPD分类中无。临床特点有:①发病年龄30~80岁,男性多于女性;②发热、疲乏、左上腹疼痛、肝脾大;③轻度贫血,血小板正常或减低,白细胞增高、正常或减低,分类单核细胞增多,常>1.5×109/L;④BM增生以成熟单核细胞为主,可高达50%,可吞噬红细胞,病态造血不明显;⑤中数生存25个月,多转为急性单核细胞白细胞;⑥Ph染色体和BCR-ABL融合基因阴性,等有别于CML。
8.与幼年型慢性髓系白血病(JCML)鉴别 儿童CML应与JCML区别,JCML特点有:①主要发生于婴儿和儿童;②皮肤病变,多为湿疹样皮疹;③肝脾、淋巴结肿大;④白细胞数增高,胎儿血红蛋白(HbF)增高,血小板减少,如累及单核系,常有单核细胞增多;⑤常伴神经纤维瘤和黄色瘤;⑥NAP积分减低;⑦无Ph染色体和BCR重排,多有IgH J连接区(Jh)重排;⑧30%有N-ras基因突变;⑨体外培养可自发形成巨噬细胞为主的集落;⑩进展快,化疗反应差。
由于JCML、婴儿-7综合征(IMo7)和儿童CMML临床和血液学特点基本相似,1994年国际粒-单核细胞白血病工作组建议统称为幼年型粒-单核细胞白血病(JMML)并提出诊断标准:①PB白细胞>13×109/L,单核细胞绝对值>1×109/L,并出现幼稚粒细胞(原粒、早幼粒和中幼粒细胞);②BM原粒细胞>30%;③无Ph染色体和BCR重排。因此,与CML区别当不难。
9.与慢性中性粒细胞白血病(CNL)鉴别 CNL曾作为CML亚型,WHO将其列为CMPD实体。Ito等提出CNL诊断标准:①PB中性粒细胞持续增高;②BM粒系增生,无病态造血现象;③NAP积分增高;④血维生素B12、尿酸增高;⑤无感染、肿瘤或其他引起类白血病反应的疾病;⑥无Ph染色体和BCR重排。Ito等还发现1例CNL有意义不明的单克隆Ig增高,肝脾大,白细胞42.2×109/L,90%为成熟中性粒细胞,NAP积分增高,BM髓系细胞增生,无病态造血现象,无Ph染色体和BCR重排,IgGκ1 269mg/dl。随访12年CNL自然缓解,白细胞10×109/L,肝脾大消失,但IgG更高达3 000mg/dl,认为CNL为单克隆Ig病的类白血病反应。文献中CNL有单克隆Ig增高者35%,有的CNL在前,多数同时发生,少数在后。λ型多于κ型,中数生存5年,故在单克隆Ig增高时,诊断CNL应慎重。Zoumbos等报道4例CNL有MDS特征,NAP积分低者2例,增高与正常各1例,随访4个月至7年,病态造血现象加重,2例转化为AML-M1,其中1例先演变为κ轻链多发性骨髓瘤,白消安与长春新碱治疗无效,4个月后转为M1。
近年,发现CNL可有Ph染色体,BCR重排在μ区,形成BCR-ABL融合基因(e19a2),编码P230蛋白,临床和血液学特点有:①中度非进行性中性粒细胞增高;②PB中幼稚粒细胞少,无中幼粒细胞峰,无明显嗜碱粒和嗜酸粒细胞增多;③BM成熟粒细胞增多;④NAP积分正常或增高;⑤无或轻度脾大;⑥无引起类白血病反应的病因;⑦有Ph染色体,BCR断裂点在μ区。因此,也容易与CML区别。WHO认为,此种Ph+,BCRμ区重排的CNL应诊为CML,不应诊为CNL。
(四)预后分期
按预后不良因素分
1.Sokal预后危险性分类系统 早在1984年,Sokal以813例CML按年龄、脾大小、血小板数及PB原始细胞数,提出预后危险性分类公式如下:0.011 6(年龄-43.4)+0.034 5(脾大-7.51)+0.018 8[(血小板数/700)2-0.562]+0.088 7(原始细胞-2.10),当<0.8为低危,0.8~1.2为中危,>1.2为高危。
2.Kantarjian等CML预后分期系统 分4期,前3期相当CP,第4期相当AP。按下列预后不良因素:①年龄≥60岁;②脾大左肋缘下≥10cm;③PB和BM原始细胞分别≥3%和≥5%;④PB和BM嗜碱粒细胞分别≥7%和≥30%;⑤PB血小板≥700×109/L。具备0~1项者为1期,2项为2期,3项以上为3期。AP为4期,不管其CP项数,具有下列之一即为4期:①细胞遗传学克隆性演变;②PB原始细胞≥15%;③PB原粒+早幼粒细胞≥30%;④PB嗜碱粒细胞≥20%;⑤血小板<100× 109/L。
3.意大利协作组按 ①脾大左肋缘下≥15cm;②肝脾大右肋下≥15cm;③血小板>500×109/L;④白细胞数≥100×109/L;⑤PB原始细胞≥0.01(1%);⑥PB早幼粒+中幼粒细胞≥0.20(20%)。具有0~1项为Ⅰ期,2~3项为Ⅱ期,≥4项为Ⅲ期。
4.Cerventes等根据 ①脾大左肋缘下>0cm;②肝大右肋缘下>0cm;③BM原粒细胞>0.05(5%);④PB有核红细胞≥0.01(1%)。有0~1项为Ⅰ期,2项为Ⅱ期,≥3项为Ⅲ期。
5.Hasford危度分级系统 年龄≥50岁为0.666,0.042×脾大cm,血小板≥1 500×109/L为1.095 6,原粒细胞%× 0.058 4,嗜碱粒细胞>3%为0.203 99,嗜酸粒细胞%×0.041 3,以上6参数之和乘以1 000,≤780为低危,781~1 480为中危,>1 480为高危。
CML可按临床、实验室和治疗相关性等因素来判定预后,不良临床因素有:老年、确诊时有症状、明显体重减轻、肝大、脾大、黑人、生活质量差。不良实验室检查结果有:贫血、血小板减低或增高、PB和BM原粒细胞或原粒+早幼粒细胞增多、PB或BM嗜碱粒细胞增多、BM巨核细胞减少和网硬蛋白或胶原纤维化3~4级,多项染色体畸变。不良治疗相关因素有:白消安治疗达到血液学缓解的时间长,完全缓解期短,第1年控制白细胞的白消安或羟基脲总剂量大,强烈化疗或IFNα治疗Ph染色体无明显减少,STI 571治疗反应差等。
(五)治疗
治疗CML不能满足于取得血液学的完全缓解,应取得细胞遗传学和或分子水平的缓解,即达到Ph染色体和BCR-ABL融合基因转为阴性。完全细胞遗传学缓解指Ph+细胞消失,部分细胞遗传学缓解时Ph+细胞1%~34%,微小细胞遗传学反应为Ph+细胞为35%~90%或更多,无效则为Ph+细胞100%或治疗前后无变化或更多,主要细胞遗传学反应指完全+部分。此外,应按CML分期给予不同的治疗。常规用于治疗CML-CP的白消安和羟基脲可使80%左右患者达到血液学缓解,一般不能消灭Ph染色体和BCR重排。
用治疗AML的联合化疗方案可使80%左右患者达血液学完全缓解,27%~53%患者有细胞遗传学反应。干扰素α的应用使60%~80%患者取得血液学完全缓解,20%~35%有主要细胞遗传学反应。干扰素α5MU/(m2·d),(1MU为100万U)和阿糖胞苷[10mg/(m2·d)]可使95%CML血液学完全缓解,78%有细胞遗传学反应,其中30%Ph+细胞消失,成为治疗CML-CP的标准方案。在CML-CP进行造血干细胞移植可使70%患者消灭Ph+细胞,生存期>10年,50%可治愈,仍有5%~20%复发。近年来,在白血病治疗上有举世目睹的突变。如果说全反式维A酸(ATRA)和亚砷酸(ATO)治疗急性早幼粒细胞白血病是一次突破,那么伊马替尼(STI 571,格列卫)治疗CML也是一次革命。
根据我国现状,造血干细胞移植治疗尚难普及,相当一段时间化疗仍然是治疗CML的主要手段。
1.白消安 为治疗CML-CP常用药物之一。剂量一般为4~6mg/d[0.1mg/(kg·d)],随细胞数而调整。当白细胞数下降>50%,减量50%,降至(20~30)×109/L可暂停药,停药后白细胞可继续下降2~3周,或改为维持量2mg,1周2~3次。80%左右可达血液学缓解,不能消失Ph+细胞。偶由白消安继发性再生障碍贫血恢复后Ph+细胞可消失而长期缓解,也有于再生障碍后反促发急变。副作用有类肾上腺皮质功能减退综合征(发热、无力、皮肤色素沉着、腹泻)、夜盲、白内障、干燥综合征、重症肌无力、不育、肺综合征(发热、咳嗽、肺浸润、呼吸衰竭)、肺纤维化和心内膜纤维化等。
2.羟基脲(HU) 抑制核糖核苷酸还原酶,干扰DNA合成。起效快,毒副作用轻,80%血液学缓解,25%可有细胞遗传学反应。已取代白消安成为治疗CML-CP首选口服药物。常用剂量2~3g/d[40mg/(kg·d)]。当白细胞降至20×109/L,减量1g/d,维持量0.5~2g/d或隔日,使白细胞维持在<10× 109/L,如<5×109/L应暂停药。主要副作用有一过性可逆性骨髓抑制或巨幼细胞贫血、口鼻溃疡、恶心、呕吐、腹泻、指甲营养不良,妊娠早期应用可致畸胎。偶可引起血栓性血小板减少性紫癜样发作,预后严重。经治疗Ph染色体消失者,有的分子检查仍有BCR重排。近来,有主张先用HU使白细胞下降至正常后加IFNα,可使CP延长,急变较迟。
3.IFNα 作用机制有:①促进NK细胞的细胞毒性;②调节局部旁分泌生长因子,增加抑制性细胞因子巨噬细胞抑制蛋白;③选择性刺激树突状细胞,加强刺激T细胞;④上调Fas/FasL凋亡系统。用于治疗CML多有细胞遗传学反应。疗程长,剂量大者较好,一般需用12个月。CP早期、CP晚期、AP和BP用IFNα治疗完全血液学缓解和主要细胞遗传学反应,分别为60%~80%和20%~35%,40%~60%和<10%,20%~30%和0%以及<10%~20%和0%。虽然在CP期尤以早期疗效较好,治疗6个月未达完全血液学缓解,12个月无细胞遗传学反应者宜停药。
一般用量5MU/d(3MU~9MU/d),sc或im。Ph+细胞减少越多生存期越长。Ph+细胞较原来减少50%,5年生存90%。需长期维持(3MU~9MU,sc,每周2~3次)。对血小板增多或骨髓移植后复发也有效。较小剂量和短程治疗也有效。河北省白血病协作组单用IFNα-2b3MU,sc,每周2~3次,连用2~3个月,治疗CML-CP13例,2例血液学完全缓解,9例血液学部分缓解,未能检测细胞遗传学和分子变化。
山西省人民医院血液科以IFNα(3MU,sc,隔日1次)和HU(0.5~3g/d)治疗14例,除3例于3年后急变死亡,余11例已生存2~8年。北京宣武医院以IFNα-2b(3MU,隔日1次)和HU(1.5~4g/d)治疗12例,均达血液学缓解,1例Ph/BCR转阴,1例Ph+细胞由治疗前60%降至45%,1例于31个月后急变,其余仍维持在CP。
意大利CML协作组以IFNα9MU/d,至少14个月,16%有完全细胞遗传学缓解,而且用白消安或HU者无一达此,但Ph染色体稍有减少,仍>50%。
IFNα与阿糖胞苷联合治疗疗效较好。IFNα[5MU/(m2· d)]和阿糖胞苷[15mg/(m2·d),7d,每28d重复],可使完全血液学缓解84%,细胞遗传学反应64%,其中完全反应20%,5年生存78%。也有用IFNα[5MU/(m2·d)]和阿糖胞苷(10mg/d)者,血液学完全缓解95%,细胞遗传学反应78%,其中完全反应30%。阿糖胞苷每日应用较每28天用7天者好,尤其是细胞遗传学反应。
IFNα[5MU/(m2·d)]、高三尖杉酯碱[2,5mg/(m2·d),×5d]和阿糖胞苷[15mg/(m2·d)]治疗,完全血液学缓解95%,主要细胞遗传学反应50%。
也有用IFNα-2b(5MU/d,sc,×28d)和阿糖胞苷(20mg/d,sc,×14d),12个疗程治疗65例,39例(60%)完全血液学反应,15例(23%)部分血液学反应,11例(17%)无效。有细胞遗传学资料29例中3例(10%)完全反应。3年生存77%,5年生存55%。
副作用有发热、寒战、食欲缺乏可能与白细胞释出白三烯(LT)C4有关。迟发副作用有疲乏、体重减轻、神经毒、抑郁、嗜睡、脱发、自身免疫性疾病(自身免疫性溶血性贫血、免疫性血小板减少、血管炎、肾病综合征、甲状腺功能减退等)、血管痉挛、雷诺现象、冠状动脉病变、心律失常和心力衰竭等。有自身免疫现象、心脏及神经毒性应停药,有自身免疫性甲状腺功能减退,可不停药加用甲状腺素。IFNα还有致畸作用,妊娠早期禁用。Kuroiwa等认为IFNα-2a不通过胎盘,不抑制DNA合成,可安全用于妊娠CML。一例Ph+-CML于妊娠8周开始用IFNα- 2a,3MU/d,其后白细胞增高而增量至6MU/d,在37周自然分娩,顺产健康男婴,血象正常,脐血无BCR-ABL mRNA,产妇Ph+细胞由原来100%降至45%,该婴儿30个月时发育正常,血象正常。
IFNγ疗效不如IFNα。IFNα和小剂量阿糖胞苷在国外曾作为治疗CML-CP的一线方案。对血小板增多者疗效甚好。
4.格列卫(gleevec,glivec) 昔称CGP57148B,亦称STI571、甲磺酸伊马替尼(imatinib mesylate),为白至棕黄色结晶性粉末,分子式为C29H31N7O·CH4SO3,分子量589.7,在低pH(<5.5)水溶良好,在中性或碱性pH中不溶或微溶,特异性结合BCR-ABL融合基因的酪氨酸激酶区,降低其活性,导致CML细胞凋亡。1998年以来,用于治疗CML-CP、AP、BP甚至经异基因造血干细胞移植复发者,取得令人振奋的结果,为CML治疗史上一次突破。已成为治疗CML的一线药物,国内条件许可也应首选。
Beham-Schmid等用格列卫400mg/d,12周治疗IFNα耐药的CML-CP 9例,都达到完全血液学缓解和主要细胞遗传学缓解;又以600mg/d治疗8例AP,其中6例(75%)取得完全血液学缓解和主要细胞遗传学缓解;又以600mg/d治疗BP 6例,仅2例(33%)达血液学完全缓解。
Sawyers等以600mg/d治疗一个月血液学反应改为800mg/a,分二次,疗程24周治疗229例CML-BP(初治148例,复治81例),39%有完全血液学反应。初治组和复治组的完全细胞遗传学反应分别为8.1%和6.2%,主要细胞遗传学反应分别为15.5%和17.3%。
Kantarjian等用400mg/d治疗耐IFNα的CML-CP 261例,94%取得完全血液学缓解,45%取得完全细胞遗传学缓解。Braziel等用300~600mg/d治疗19例IFNα难治或不能耐受CML-CP。其中15例只有t(9;22)(q34;q11),3例还有其他畸形,1例还有t(7;8)。用药后2周有血液学反应,4周可达完全血液学缓解,一般在2个月内有白细胞下降正常,嗜碱粒细胞和血小板下降至正常,血红蛋白轻度下降。BM反应迟于PB。用药2个月17例血象完全缓解者12例,BM仍为CML到8~11个月才增生正常或稍低,无CML形态学依据。治疗5~8个月Ph+细胞消失者6例(32%),另6例细胞遗传学部分缓解,其中5例在14个月时Ph+细胞渐增多。
Talpez等比较400mg/d治疗CML-AP 62例和600mg/d治疗CML-AP 119例,结果完全血液学反应分别为17例(27%)和44例(37%);回到CP分别为17例(27%)和25例(21%);完全细胞遗传学反应分别为7例(11%)和23例(19%);部分细胞遗传学反应分别为3例(5%)和10例(8%);1年生存率分别为65%和78%,提示格列卫600mg/d治疗AP比400mg/d好。他们又比较600mg/d和IFNα加阿糖胞苷(羟基脲或6巯嘌呤)治疗AP结果总血液学反应分别为71%和20%~60%,主要细胞遗传学反应分别为28%和<5%,说明格列卫治疗CML-AP的优越。
一组IFNα治疗无效CML-CP 532例、AP 235例、BP 260例治以格列卫,完全血液学缓解分别为95%、34%和7%;完全细胞遗传学反应分别为41%、17%和7%;主要细胞遗传学反应分别为60%、24%和14%。异基因造血干细胞移植后复发28例(其中13例输注过供体淋巴细胞无效),其中CP 5例,AP 15例,BP 8例,格列卫治疗完全血液学缓解分别为100%、83%和43%;主要细胞遗传学反应CP和AP为63%,BP为43%,均支持在CP用药疗效好。
格列卫治疗CML-CP剂量一般为300~400mg/d,AP和BP为600mg/d,甚可增至800~1 000mg/d,疗程至少12周。如与聚乙二醇化IFNα2a(pegylated,peg IFNα2a)90μg每周1次合用,遗传学与分子学缓解高于格列卫±阿糖胞苷。
格列卫耐药问题:用格列卫可以发生耐药。目前,国际上通用的格列卫耐药标准,有原发耐药和继发耐药。前者指:①格列卫≥300mg/d,3个月未达到血液学完全缓解;②格列卫≥400mg/d治疗3个月,Ph+细胞不<65%,治疗6个月Ph+细胞不<35%,治疗12个月未达到Ph+细胞为0%。后者指血液学复发,Ph染色体重现,间隔≥3个月,Ph+细胞增加≥30%,出现新Ph+克隆,BCR-ABL比值上升≥1个对数级或同时Ph+。耐药机制可能与:①BCR-ABL基因扩增或其酪氨酸激酶活性再激活;②BCR-ABL激酶区点突变,不能与药物结合;③CML-CP时PB和BM都能检出处于细胞周期G0静止期的CD34+Ph+白血病干细胞,对格列卫高度耐药,而且耐药细胞内γ-谷氨酰半胱氨酶合成酶和谷胱甘肽增高。Roche-Lestienne等观察5例(2例CP,3例AP)用格列卫400~800mg/d,1~12个月,均无细胞遗传学反应,3例无血液学反应,2例分别在用药3个月和18个月有血液学反应,3例为Thr 315Ile突变,Phe 311Ile突变和Met 351Thr突变各1例,均无BCR-ABL基因扩增;④高表达多药耐药MDR基因,抗凋亡BCL-2等;⑤低表达人有机阳离子转运子1(hOCT1)。发生耐药时可采取:①格列卫增量;②改用或加化疗;③加IFNα或亚砷酸(三氧化二砷,ATO)以下调BCR-ABL加强格列卫作用;④加维生素C(1g/d)可降低谷胱甘肽逆转耐药,且可增加ATO的疗效;⑤热休克蛋白90(Hsp 90)能稳定BCR-ABL融合基因,加用Hsp 90抑制药Geldanamycin(GA)或17-allylaminogeldanamycin(17-AAG,毒性较GA小),可介导BCR-ABL蛋白降解。GA和17-AAG不但抑制突变的BCR-ABL也可抑制野生型BCR-ABL,对突变型抑制活性更强;⑥应用新一代ABL激酶抑制药达沙替尼或尼罗替尼;⑦加抗氧化剂维生素E,BCR-ABL可使线粒体产生反应性氧引起DNA氧化损伤,修复异常易突变耐药;⑧高三尖杉酯碱为多激酶抑制药1.25mg/m2,sc,2/d,7~12d,每28d为一疗程,对耐格列卫甚至T315I突变也有效,T315I突变对格列卫、达沙替尼、尼罗替尼全耐药;⑨丙戊酸钠5~10mg/(kg·d)±全反式维A酸45mg/(m2·d),28d;⑩法尼基转移酶抑制药,mTOR抑制药,去甲基化剂均可加用; 异基因造血干细胞移植。
异基因造血干细胞移植。
用格列卫时要注意:①格列卫不能透过血脑屏障,要防治CNS白血病仍应鞘内注射甲氨蝶呤、阿糖胞苷(环磷酰胺)和地塞米松(氟美松),特别对急淋变;②格列卫的配伍禁忌有:地塞米松、利福平、苯巴比妥可减低格列卫血浓度,而钙拮抗剂、双氢吡啶、扑热息痛、辛伐他丁、红霉素、环孢素、酮康唑、伊曲康唑等增加格列卫血浓度。格列卫与上述药物配伍时应适当增减剂量以免疗效减低和易发生毒副作用;③格列卫除CML应用外,对Ph+-AL、MF、ET等亦可应用,对血小板源生长因子受体(PDGFR,C-kit,CD117)也有作用故可用于治疗CD117+-AML和肥大细胞增生症。C-kit酶位突变者,格列卫无效,调节型突变者有效;④与干扰素α、柔红霉素、阿糖胞苷、足叶乙苷、ATO合用有协同作用;⑤有效者停药后仍可复发,需维持治疗;⑥有t(9;21)(q34;p1)引起ETV-6-ABL融合基因,其信号传导途径与P210BCR-ABL相同,格列卫治疗也有效。可用于t(9;21)(q34;p1)AML。
格列卫虽对CML有特异性,对正常具有酪氨酸激酶活性和信号传导蛋白的细胞活动都有影响。为此,副作用是多系统的,常见有疲乏无力、消化不良、食欲缺乏、恶心、呕吐、亦可胃出血、腹泻、皮疹、重可剥脱性皮炎、肌痛、肌痉挛、骨关节疼痛、水肿、浆膜腔积液、骨髓抑制(中性粒细胞<1×109/L,血小板<50×109/L)。此外,可致心力衰竭、肾功能衰竭、肝毒性可致转氨酶和胆红素增高,重者有多灶性肝坏死,胆管周围纤维化,不育,动物实验可致畸。剂量≥600mg/d,半数患者可因副作用而减药或停药,42%BM有良性淋巴细胞积聚,47%有海蓝组织细胞。
5.达沙替尼(dasatinib)和尼罗替尼(nilotinib) 为二代ABL激酶抑制药,其活性分别比格列卫强300倍和30倍,但对T315I突变均无效。用于治疗格列卫耐药或不能耐受的CML。所谓格列卫不能耐受指≤400mg/d或≥400mg/d,发生药物相关性毒副作用,不能耐受而停药者。达沙替尼常用量为70mg,2/d。治疗一个月未达血液学完全缓解,治疗3个月或更长而未达完全遗传学缓解,或治疗一个月相隔一周两次血象原始细胞增多,应增量至100mg,2/d。Cortes等以此剂量治疗CML髓系急变74例,随访6个月完全血液学缓解24%,主要遗传学反应20%,而CML急淋变42例也随访6个月,两参数分别为26%和42%。另一组186例耐格列卫的CML-CP,90%取得血液学完全缓解,52%取得主要遗传学缓解。副作用最常见为胃肠道反应,水肿、胸腔(含心包)积液、厌食、肝酶升高、关节痛、低白蛋白血症、皮疹等。可有不等程度的骨髓抑制,血细胞减少。也有用达沙替尼100mg/d,上述副作用减少且轻。达沙替尼还有优点为可通过血脑屏障,而且不受药物摄入人有机阳离子转运蛋白1(human organic cation transporter1,hOCT1)表达高低的影响。用达沙替尼有NK/T大颗粒淋巴细胞增多者细胞毒性增强,取得疗效较好,但可抑制CD4+CD25+调节性T细胞。
尼罗替尼常用量为400mg,2/d,Kantarjian等治疗耐格列卫或不能耐受的CML-CP280例,总完全血液学缓解74%,快者1个月即可达到。经6个月治疗,BCR-ABL有突变者完全血液学缓解为61%,主要遗传学缓解42%,(完全为23%);而BCRABL无突变者三参数分别为83%和51%(35%)。如治疗3个月无血液学反应,6个月无遗传学反应,剂量增至600mg,2/d。副作用常为皮疹、头痛、恶心、水肿、胸腔积液和血细胞减少等。
BCR-ABL激酶域突变不下数十种,对格列卫、达沙替尼、尼罗替尼的敏感度不同,若有条件应检测其点突变,以选用适合的药物。对格列卫不敏感的突变有Y253F、Y253H、E255K、E255V和T315I;对尼罗替尼不敏感的有T315I;对达沙替尼不敏感的有T315I和T315A。有的药物对T315I突变起作用。如:酪氨酸激酶抑制药SGX393、ONO12380,Aurora激酶抑制药MK-0457(VX-680),其他sorafenib、WP1130以及法尼基转移酶抑制药、mTOR抑制药(雷帕霉素)和组蛋白去乙酰基酶抑制药(丙戊酸钠、SHAH,belinostat或PXD-101)等均在临床试用中。多蛋白酪氨酸激酶抑制药高三尖杉酯碱可抑制JAK2-STAT5磷酸化激活BCR-ABL融合基因亦可用于治疗耐格列卫的CML。
总之,如条件许可,治疗CML一线药物为格列卫,其次为干扰素加高三尖杉碱或阿糖胞苷,再次之为羟基脲加干扰素α(甲氧基聚乙二醇干扰素α)。
6.亚砷酸(三氧化二砷,As2O3,ATO) 众所周知,ATO常用于治疗ATRA难治及复发的急性早幼粒细胞白血病(APL,M3)。ATO作用是多方面的:①较高浓度(0.5~2μmol/L)可致线粒体跨膜电位蹦解,释放细胞色素C激活caspase 9和3,引发细胞凋亡,而较低浓度(0.1~0.5μmol/L)可使细胞分化;②引起PML-RARα降解,用于治疗APL;③可抑制血管内皮生长因子VEGF和血管新生;④下调抗凋亡蛋白bcl-2、bcl-XL、XIAP;⑤下调并降解BCR-ABL蛋白,明显抑制其酪氨酸激酶活性;⑥抑制细胞核因子κB(NFκB)。用于治疗多种恶性血液病和实体瘤。
Chen等用ATO[0.15mg/(kg·d),iv]治疗7例CML,中数治疗40d,3例血液学完全缓解,4例部分缓解。1例于18个月后复发,再以ATO治疗又完全缓解,细胞遗传学无好转。
O'Dwyer等发现CML-CP患者CFU-GM以格列卫或ATO处理,分别有25%和10%抑制,两药联合,抑制作用加强,60%可被抑制。
哈尔滨血液肿瘤研究所用ATO 10~15mg/d治疗CMLCP 29例,19例(65.6%)血液学完全缓解,4例部分缓解。又治疗BP 26例,仅10%缓解。ATO与格列卫联合治疗CMLBP18例,15例完全缓解和部分缓解,已有5例生存>22个月,未提及细胞遗传学反应。ATO加高三尖杉碱(2mg/d)和阿糖胞苷[25mg/(m2·d)]治疗21例BP,8例完全缓解,4例回至CP。
Mauro以ATO[0.25mg/(kg·d)×5d,改为0.25mg/kg,每周2次]和格列卫(400mg/d)治疗CML6例,2例血液学完全缓解。
苏州大学附属第一医院发现ATO和另一种酪氨酸激酶抑制药木黄酮(genistein)可抑制CML细胞系K562增殖并促发凋亡。又以ATO10~15mg/d,治疗CML-AP7例,3例完全血液学缓解,4例部分缓解,但细胞遗传学及分子水平无变化。
ATO副作用一般较轻,常不需中断治疗,常见有胃肠道反应、水肿、骨关节疼痛、皮疹、周围神经病、电解质紊乱(低钾血症、低镁血症)、高血糖、肝酶增高、Q-T间期延长及房室传导阻滞,重则可致室性心律失常,甚至猝死。血液学毒性有血小板减少或增多,白细胞减少或增多,血栓栓塞等。药物相关性BM抑制少见。ATO治疗APL所发生的维A酸样综合征(APL细胞分化综合征、发热、呼吸困难、水肿、体重增加、胸膜或心包膜渗出、肺浸润、肾功能减退等),在CML治疗中少见,笔者曾会诊2例有冠心病CML-BP患者用ATO 10mg/d,分别于第10天和第21天发生室性心律失常,停药后对症治疗而恢复,再用ATO 5mg/d再未发生心律失常,而部分缓解。为此,对有心脏病患者应用ATO应加强监护。又有1例CML-CP于用ATO 10mg/d,2日后有重度水肿、呼吸困难,疑为维A酸样综合征,停ATO用地塞米松20mg/d,2日后恢复。还有1例用ATO 1周后出现红斑性肢痛,双侧膝腱反射减弱,双下肢袜套样感觉减退,停药并用B族维生素和二巯丁二钠等治疗而好转。
7.联合化疗 用治疗AML方案如HA、DA、HAD、MEA等治疗CML-CP,取得血液学缓解时间比单用白消安或HU短,并有细胞遗传学反应,1/3患者Ph+细胞可减少80%~100%,但对中数生存期延长和减少AP不明显。
O'Brien等以高三尖杉酯碱2.5mg/m2,持续静脉滴入,14d,达到血液学完全缓解后以2.5mg/m2,静滴,每月7d维持,治疗CML-CP 58例,42例(78%)血液学完全缓解,16例有细胞遗传学反应,完全性反应5例,部分反应2例,微反应9例。值得注意此58例中41例对INFα耐药。
Merante等以去甲氧柔红霉素12mg/m2,po,第1~7天,阿糖胞苷300mg/(m2·d),sc,第1~14天,如用过阿糖胞苷疗效不佳,改用HU 0.5~1g/d,治疗6例均有效。
Handa等以4C-193B方案:阿糖胞苷20mg/m2,2/d,第1~14天,第28~41天,HU 0.5/d,第1~14天,第28~41天,顺式维A酸100mg/m2,第15~25天,INFα5MU/(m2·d),sc,第15~25天,缓解后以阿糖胞苷20mg/m2,一日2次,第1~7天,第28~34天,HU 0.5/d,第1~7天,第28~34天,顺式维A酸100mg/(m2·d),第8~25天,INFα5MU/d,第8~25天维持,治疗15例CML-CP,12例完全缓解,3例部分缓解,8例有细胞遗传学反应,治疗前均为Ph+细胞100%,治疗1个月后4例Ph+细胞为18%~50%,4例为60%~95%。
联合化疗治疗CML-CP并无标准金方案,可根据药源、经济状况自行组合。
8.白细胞单采 适用于高白细胞综合征,可快速降低白细胞,减轻白细胞淤滞症状。妊娠CML者早期进行单采可避免化疗对胎儿的不良作用。单采虽可快速降低白细胞,为时短暂,最好与化疗合用。
9.脾放射治疗 一般适用于化疗难治,脾脏特别巨大,影响胃肠道或脾周围炎剧痛者。患者多处于AP或BP,脾放疗为姑息治疗,疗程短。亦可作为造血干细胞移植前预处理。
10.脾脏切除 脾脏切除不能延长CP,推迟AP,不能增加对化疗敏感,但对症状性血小板减少,脾急剧增大,可选择性切脾。切脾后0.2%~6%可发生血栓栓塞并发症,死亡率可高达75%,尤以血小板增多者。Lee等报道1例血小板增多Ph+-CML,因脾梗死切脾,脾病理显示白血病细胞浸润,多灶性脾梗死。切脾后3周突发上腹疼痛,血小板高达1 225×109/L,用HU后上腹疼痛加重,CT检查有门静脉、肠系膜上静脉、脾静脉血流中断。ATⅢ正常,APS阴性,PC和PS稍低。自肠系膜上动脉插管注入尿激酶25万U,随之10万U/h,未行系统溶栓,次日腹痛缓解,已有血液流入肠系膜上静脉,第5日门静脉有血流。改用肝素和华法林5d,再以华法林和阿司匹林治疗维持3个月,复查门静脉、肠系膜静脉血栓几乎完全消失。
11.血小板增多的治疗 血小板多随治疗CML白细胞下降而下降。有时白细胞数控制良好,但血小板仍持续增高。血小板单采可快速下降血小板数,不能降低BM中巨核细胞。氯米喹酮(anagrelide)选择性降低血小板也不能抑制巨核细胞生成,仅抑制其成熟和血小板形成,对其他血细胞无影响。一般2mg/d,用药一天可使血小板降低50%,当血小板降至<450× 109/L,改用0.5~1mg/d维持。副作用有药物扩血管作用引起头痛、心动过速、腹痛、腹泻、水肿及偶可贫血等。停药后血小板在短期内快速回升。也可用塞替派75mg/m2,iv,每2~3周1次,血小板降至<450×109/L,,以25mg/m2,iv,每周1次维持。瘤可宁6mg/(m2·d),用2~6周可维持血小板数正常。若有血栓形成可用甲基亚硝脲150mg/d治疗,有一定疗效。也可用干扰素α。
12.AP和BP治疗 AP和BP可用格列卫600mg/d和(或)ATO 10mg/d治疗有较好疗效,已如前述。也可按细胞类型采用相应AL治疗的联合化疗方案,请参阅急性白血病治疗节。
13.造血干细胞移植 条件许可,可在CP行异基因造血干细胞移植,AP或BP作移植疗效不好(表2-1)。
表2-1 欧洲骨髓移植组(EBMT)对CML移植危度积分

(六)疗效标准
1.国内疗效标准
(1)完全缓解
①临床:无贫血、出血、感染及白血病细胞浸润表现。
②血象:血红蛋白>100g/L,白细胞总数<10×109/L,分类无幼稚细胞,血小板(100~400)×109/L。
③骨髓象:正常。
(2)部分缓解:临床表现、血象、骨髓象三项中有一或二项未达完全缓解标准。
(3)未缓解:临床表现、血象、骨髓象三项中均未达完全缓解标准及无效者。
2.国际疗效标准
(1)完全缓解
①白细胞数<10×109/L,分类正常,无幼稚粒细胞(原始、早、中、晚幼粒细胞)。
②血小板计数正常或不超过450×109/L。
③此病的临床症状、体征消失(如脾大消失或刚触及)。
(2)部分缓解
①白细胞计数降至治疗前50%以下,及至少<20×109/L。
②外周血白细胞计数正常,但仍存在幼稚细胞及脾大。
(3)无效:不能达到部分缓解者。
细胞遗传学反应:
①无细胞遗传学学反应:Ph1染色体持续在所有分裂相中存在。
②微小细胞遗传学反应:Ph1染色体被抑制至占分裂象的35%~95%。
③部分细胞遗传学反应:Ph1染色体被抑制至占分裂象的5%~34%。
④完全细胞遗传学反应:Ph1染色体阳性细胞消失。
国外用格列卫400mg/d治疗CML-CP疗效标准
血液学反应(HR)
完全血液学反应(HCR)
白细胞<10×109/L分类无幼粒细胞,嗜碱粒细胞<5%。
血小板<450×109/L。
脾不能触及。
无效:治疗3个月无HR。
治疗6个月达不到HCR,PH+细胞>95%,任何时间失去HCR。
细胞遗传学反应(CyR)
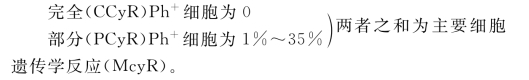
微(mCyR)Ph+细胞为36%~65%。
极微(miCyR)Ph+细胞为66%~95%。
无效:治疗6个月Ph+细胞>95%。
治疗12个月Ph+细胞未达PCyR。
治疗18个月Ph+细胞未达CCyR。
任何时间失去CCyR。
分子学反应(Mo1R)
完全(CMo1R):BCR-ABL转录阴性或微量不能定量。
主要(MMo1R):BCR-ABL转录≤0.1。
反应不佳:治疗3个月未达到HCR;
治疗6个月未达到PCyR;
治疗12个月未达到CCyR;
治疗18个月未达到MMolR。
任何时间失去HCR、CCyR、MMo1R,Ph+细胞有其他染色体异常为疾病进展。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。
















