分析阶段指的是从标本合格验收到分析测定完毕的全过程。这个阶段应该做好标本的验收和预处理,建立稳定可靠的测定系统,实施完善的室内质控和室间质评程序。为此,还要做好大量的质量管理层面和技术管理层面的准备工作。
一、质量控制的概念和历史
检验结果是临床医生诊断疾病、观察疗效、判断预后的重要依据,检验结果的可靠与否直接影响医疗质量。1947年Rclk和Sundeman首先发现同一份标本在不同实验室之间有惊人的差异。1950年Levey和Jennings将工业生产中控制产品质量的方法应用到实验室。1958年Freier和Rausch将这些方法应用到每天的常规工作。20世纪60年代以后则已发展成为全面质量管理(total quality control,TQC)。近年来,临床检验的分析过程质量控制发展飞速,实验室的质量管理体系不断完善,日趋成熟,具体表现在以下方面。
1. 试剂厂商研制了相似于患者标本的稳定质控品,并广泛应用在临床检验中。
2. 对质量控制方法的性能特性有了更深的理解,由此精心设计了诸如多规则方法去评估和解释控制数据。
3. 提出了高效率的质量控制的概念。现在普遍认为,以往的Levey-Jennings的控制技术和Westgard的多规则控制技术,都是以检验实际操作具有的误差水平为控制目标。与手工操作技术配合的控制技术是Levey-Jennings控制图,这是第一代的临床检验质量控制技术。这代质量控制技术对误差的控制水平受临床检验方法的限制,从现在的眼光来看控制水平是很低的。
当检验进入自动化时代后,检验操作质量有了极其显著的进步,检验操作速度是以往无法比拟的。针对这样的操作技术水平,希望能有效地提高检验效率的同时,还必须保证检验结果的可靠,要求质量控制技术对失控误差的检出具有高特异性和高灵敏度。Westgard的多规则技术经多年磨炼在1979年诞生了,这是高效率质量控制的第一步,也是第二代临床检验质量控制技术。但是应注意的是,Westgard多规则仍然以检验实际操作具有的稳定误差水平为它的质量目标;随着自动化技术的不断完善,使用自动分析仪操作结果的重复性得到了最大的提高。国内外的检验界同道都已经感到,再以分析仪操作水平为质量控制目标的做法已经不能满足临床检验的要求。
1990年以后,出现了第三代质量控制技术,它以临床允许误差为质量目标,由实验室选择合适的控制规则和确定每批做几个控制样品,建立自己的控制方法,使检验的质量真正符合临床要求。为保证检测结果的准确性和一致性,ISO 15189:2003《临床实验室——质量和能力的专用要求》要求临床实验室的检测系统和参考物设定值可溯源到可能的参考方法和(或)可能的高一级参考物质,以使常规的检测系统对患者样本的检测,在计量单位一致的前提下,得到和参考系列相同的检测量值。那就是通过一条具有规定不确定度的不间断的比较链,使测定结果或标准值能够与规定的参考标准(通常是国家标准或国际标准)联系起来的特性,称为量值的溯源性(traceability)。溯源顺序通常采用溯源等级图来描述。要求校正常规方法的参考物必须溯源到国家或国际规定的参考方法上,最好是溯源到SI(国际单位制),SI单位表示了该物质量值的准确性达到计量基准,它具有非常小的不确定度。
除了保证参考物的溯源性外,临床实验室和生产厂商必须对检测系统各组分(仪器、试剂、参考物和操作程序)实行严格的标准化程序,才能实现患者检验结果的溯源性。
4. 计算机的广泛应用推动了质量控制技术的发展。现在几乎所有自动分析仪上都配备计算机,它们在实施统计控制方法时进行必要的计算,绘制控制图,运用合适控制规则自动作出判断,储存数据并对确属失控的问题提出警告等。
二、室内质量控制的统计学基础
一件工业产品可以用物理的直观的指标去评估质量是否合格。临床实验室的分析项目结果多为数据,无法判定某一个数据是否准确。但是可以根据与这个数据有关的一组数据去判断它的质量,这里应用的是统计原理,主要是正态分布和抽样误差的理论。
(一)总体和样本
研究对象的全体成分称为总体,总体的范围可以非常大,实际中往往无法取得,所以是个理论上的概念。与总体相对的是个体即组成总体中的每一个单位,实际工作中只能从某个总体中取得一部分个体,后者称为样本。应用正确的统计方法可以通过样本推断总体的情况。
(二)均数、标准差、变异系数和概率
1. 样本均数 常用x表示,是最常用的一个统计数,能集中反映一个样本的特性。一般有算术均数和几何均数两种,生化检验中常用的是算术均数。即将样本中所有个体的值计总和后除以个体数。可以用计算器或电脑很方便地求得。
2. 标准差 现以s表示,也是一个基本的统计数,是表示变异的指标,反映样本中各个个体的离散程度。
3. 变异系数 变异系数是标准差相对于平均数的大小,缩写符号为CV,也是表示变异的指标,在生化检验中指示不精密度,十分常用。
4. 概率 以符号P表示,反映某一事物发生的可能性大小的量,必然发生的事件其P值为1,必然不可能发生的事件其P值为0,绝大多数情况下P值介于0和1之间。常用的两个判别指标是0.05和0.01,P<0.05一般指示发生的可能性很小,当P<0.01时,可以说发生的可能性几乎没有了,在做抽样误差分析时,对应这两种情况的统计学术语是“差别有显著性意义”和“非常显著性意义”。
(三)正态分布原理
正态分布又称高斯分布,表现为一条呈对称的钟形曲线。当一个样本作重复测定后,所有的数据不会全部是一样的,正常时这样一组数据的分布就呈正态的形状,可以得到一个平均数(x)和标准差(s),以x为中心,左右一个s(即±1 s)范围内正态曲线下所包含的面积约为全部面积的68%,也就是x±1 s的数据点约占全部数据点的68%。x±2 s的范围内包含约95%的数据点,x±3 s的范围内含约99.7%的数据点。在这个正态分布曲线图上,均数x的大小不同,仅影响曲线顶部的位置,而标准差s的大小影响曲线的宽度,所以不同x和s形成的正态曲线的陡峭或平坦的程度是不一样的,但是上述的规律却是一定的。我们正是在这一基础上进行室内质量控制工作的。
(四)抽样误差原理
对同一个质控品作多次重复测定所得到的结果肯定不会都相同,也不会一定都与平均值相同,这个不同就是由抽样误差所引起的,即在同一个样本中抽样,会因抽样而致某种误差。抽样误差是事物固有的误差,不是人们可以消除的。所以如果得到一个质控结果与平均值(或靶值)不一致,就要判别所发生的误差是抽样误差还是其他误差,例如系统误差或随机误差。如果是由抽样误差所致,可以将这个结果判为在控,如不是抽样误差所致,就要判为失控。这个判别要由一个“无效假设”来做。就是先假设某一个质控结果与靶值的差异仅是由抽样误差引起的,而不是由其他真正的操作误差所引起,但这还仅仅是一个假设。接下来就要根据统计学的原理来判断这个假设是否成立。如果判断这个“无效假设”成立,那么这个质控结果虽与靶值有差异但还是在控;如果判断引起差异的不是因为抽样误差,则这个“无效假设”不能成立,就要判为失控。如何判断呢?我们看这个质控值与靶值的差异有多大,如果差异>± 1 s,但<±2 s,根据正态分布原理,则有约32%的可能性是抽样误差所致,这是一个很大的概率,所以这个无效假设成立,可将这个结果判为在控。如果差异>±2 s,但<±3 s,无效假设成立的可能性大约是5%,这个概率可以说是个临界概率,一般还是将这个差异判为抽样误差所致,否则会有较高的假失控可能性。当一个差异>± 3 s时,抽样误差所致的可能性<0.3%,这时应该有很大的把握推翻无效假设,判断这个差异不是由于抽样误差所致,而是真正因为其他如系统误差等原因所致,可以判为失控。
三、质控品的选择和应用
(一)质控品的定义和种类
国际临床化学学会(IFCC)对质控品的定义为:专门用于质量控制目的的标本或溶液,不能用作校准。选择什么类型的质控品是质控工作首先要解决的问题。质控品有多种分类方法,若根据血清物理性状可分为冻干质控血清、液体质控血清和冷冻混合血清;根据有无靶值可分为定值质控血清和非定值质控血清;根据血清基质的来源可分为含人血清基质的质控血清、动物血清基质的质控血清、人造基质的质控血清等。市场上有各种进口或国产的质控品可供挑选,实验室可根据自己的实际情况认真选择。
(二)质控品选择使用时应注意的几个问题
1. 质控品的基质效应 在对某一分析物进行检验时,处于该分析物周围的其他成分的组合,是该分析物的基质。由于这些组合成分的存在,对分析物的检验可产生“基质效应”。质控品一般为来自人或动物的血清经过处理,添加了无机或有机化学品、生物体的提取物、防腐剂等制备而成。它对分析来说,就是“基质”,能产生“基质效应”。
(1)理想的情况下,质控品应与患者标本具有相同的基质状态,这样,质控品与患者标本具有相同的表现。若从基质差异考虑,强调用人血清。从价格和来源考虑,则选用动物血清。而从检验人员自身防护免受来自质控品内传染性病原体的危害考虑,近来又重视使用动物血清。
(2)质控品的生产加工处理过程可以改变基质的性质:如为了达到特定的浓度而加入添加物的来源和性质与人血清标本的差异,添加的稳定剂本身也是改变基质的原因之一,将产品制备成冰冻或冻干状态又使质控品在物理和化学表现上发生变化。
(3)某些检验方法可影响对质控品的选择:例如用染料结合法测定人血清清蛋白,无论是溴甲酚绿或溴甲酚紫,都对人白蛋白有强烈的特异性,但与牛血清清蛋白结合却很差,特别是溴甲酚紫。因此,使用溴甲酚紫的实验室就不能选用牛血清为基质的质控品。
2. 质控品的稳定性 严格地讲,任何质控品都会有变化,是不稳定的。所谓不变化、稳定只是相对的。认为质控品很稳定,是因为它的变化很缓慢,甚至用检验手段无法反映出其变化。认为其不稳定,是因为它的变化太快。生产定值质控品的厂商在其产品说明书上提供的预期范围很宽,其实是包含了质控品的缓慢变化使实测值有偏离初始均值的倾向。好的质控品应该在规定的保存条件下,至少稳定1~2年。
3. 质控品定值与非定值
(1)正规的定值质控品在其说明书中有被定值的各分析物在不同检测系统下的均值和预期值范围,用户可从中选择与自己相同检测系统的定值作为参考。但须注意不能误将其预期值范围当作控制的允许范围。
(2)不定值质控品的质量与定值质控品并无不同,只是生产厂商没有邀请一些实验室为其产品作定值。从用户的角度讲,不定值质控品要比定值质控品便宜许多。
(3)不论是定值还是不定值质控品,在使用时,用户必须用自己的检测系统确定自己的均值与标准差。只是定值质控品有一个预期范围供用户参考,但即使用户的均值与厂商提供的均值相似,并不说明用户的检测结果准确,不相似也不说明用户的准确度有问题。
4. 质控品的瓶间差
(1)日常工作中,质控品检验结果的变异是检测不精密度和更换各瓶质控品间差异的综合反映。只有将瓶间差异控制到最小,才能使检验结果间的变异真正反映日常检验操作中的不精密度。
(2)良好的质控品在生产时要极其注意均匀混合,并用称量法控制分装时的重复性。用户对冻干质控品复溶时要严格控制操作的标准化,尽可能避免和减少操作不当造成的瓶间差。
(3)已有市售的液体质控品,它消除了分装和复溶时引入的瓶间差。只是这类产品价格较高,且含有防腐剂类添加物,可能对某些检验方法会引起基质差异的误差。但液体质控品的稳定期长,消除了瓶间差和复溶时的操作误差,已为不少实验室采用。
5. 质控品的分析物水平(浓度) 日常工作中若只做一个水平的质控品检测,其反映的质量是整个可报告范围中的“一点”的表现,只说明在该控制值附近的患者标本检验结果符合要求,难以反映较高或较低分析物水平的患者标本是否也符合要求。若能同时做2个或更多水平的质控品检测,则所反映的质量是一个范围内的水平,其效果更好。因此,在选择质控品时,应该有2个或更多水平的控制物。通常挑选的是医学决定水平的、可报告范围的上下限值的质控品浓度。
(三)质控品应具备的特性
作为理想的生化检验质控品,至少应具备以下特性。
1. 人血清基质。
2. 无传染性。
3. 添加剂和抑菌剂(防腐剂)的含量尽可能少。
4. 瓶间变异小,酶类项目的瓶间CV应<2%,其他分析物CV应<1%。
5. 冻干品复溶后的稳定性,2~8℃时不少于24 h,-20℃时不少于20 d。某些不移定成分(如胆红素、碱性磷酸酶)在复溶后的前4 h的变异应小于2%。
6. 到达实验室的有效期应在1年以上。
(四)质控品的正确使用与保存
1. 严格按质控品说明书操作。
2. 冻干质控品复溶时要确保溶剂(试剂水)的质量。
3. 冻干质控品复溶时,所加溶剂的量要准确,并尽量保持每次加入量的一致性。
4. 冻干质控品复溶时应轻轻地摇匀,使内容物完全溶解呈均一态,切忌剧烈振摇。有些质控品瓶塞不紧,为防止瓶口泄漏,也不宜颠倒混匀。
5. 冻干质控品复溶后宜在室温放置30 min,待其内容物稳定后再开始使用。
6. 质控品应严格按使用说明书规定的方法保存,不能使用超过保质期的质控品。
7. 质控品应与患者标本在相同的条件下进行测定。
四、质控图的选择和应用
室内质控的目的是监测测定过程中出现误差时,能有适当的质控方法警告检验人员。通常采用的方法是将质控品与患者标本放在一起测定,将质控品测定结果标在质控图上,然后观察质控品测定结果是否超过质控限来判断该批患者标本的结果是在控还是失控。可供应用的质控图有多种,如Levey-Jennings质控图、Z-分数图、Youden图、Westgard质控图、Monica质控图、累计法质控图等,可根据需要选用。这里分别介绍常用的5种质控图。
(一)Levey-Jennings质控图
此图即通常所称的常规质控图、x-s质控图。20世纪50年代由Levey和Jennings引入临床检验中,60年代以后被普遍应用。其方法是建立在单个质控品做双份测定值的均值(x)和极差(R)的基础上。此图的优点是可以观察批内误差(R)和批间误差(x的变化)。在问题出现以前去发现预示性迹象,便于尽早采取措施以防止发生误差。目前大家所熟悉的Levey-Jennings质控图是经Henry和Segalove修改了的图。它以20次单份质控品的测定结果计算均值和标准差,定出质控限(以x±2 s为警告限,x±3 s为失控限),每天随患者标本测定质控品1次,将所得的质控品测定结果标在质控图上。这个经过修改的图就是单值质控图。制作方法如下。
1. 数据收集和处理 选择合格的质控品,测定其在最佳状态下的变异(OCV)和常规条件下的变异(RCV)。以RCV所得均值、标准差制图。目前生化实验室广泛应用自动分析仪,因而OCV与RCV的区别已经不明显。目前的做法是,对新批号的质控品,在常规条件下测定20 d或更多天(批),作统计处理,剔除超过3 s的数据后得均值和标准差。此均值作为暂定均值,也即为质控图上的中心线(暂定中心线)。暂定均值和标准差作为下1个月室内质控图的均值和标准差进行室内质控,1个月结束后将该月在控结果与前20个质控品测定结果收集在一起,重新计算均值和标准差,此为累计均值和标准差,以此累计均值和标准差作为下1个月的质控图的数据。重复上述操作,连续3~5个月。这3~5个月的累计均值和标准差即可作为质控品有效期内的常规均值(常规中心线)和标准差。并以此作为有效期内室内质控图中的数据。对个别在质控品有效期内其浓度水平容易变异的项目,则需视具体情况对均值进行多次的调整。准备更换新批号质控品时,应在旧批号质控品用完之前,将新批号与旧批号质控品同时进行测定,重复上述过程,建立新批号质控品均值和标准差。在确定均值和标准差后,如果测定方法处于稳定状态,就能对其后的观察值(患者标本测定值)的范围作出统计学上的预测。“稳定”是指均值和标准差保持基本恒定。若均值偏移或标准差增大,就可能来源于额外的测定误差,说明实际测定已偏离了原有的稳定状态。质控方法应该能够检出这些额外的测定误差。质控品预期值范围的确定建立在置信区间概念的基础上。假定均值代表质控品的“真值”,标准差可用来表示实际测定值的正态分布,可接受的预期值范围可用均值加减标准差的若干倍数的方式表示。通常规定95%或99%(实际上应为95.45%或99.73%)作为统计学上的可接受置信区间,相当于质控测定值应落在x±2 s或x±3 s的范围内。在此范围内,则应认为该批测定在控。
2. 制图 取一张Levey-Jennings质控图,在图上方的各项目中填上单位、日期、试验项目、测定方法等有关内容,仔细填上均值(或靶值)、标准差,同时在图的纵坐标x及±1 s,2 s,3 s等处标上相应具体的数值。用蓝笔在x±2 s处画线,为警告线;用红笔在x±3 s处画线,为失控线。
3. 应用 质控图制好后,可以开始将日常工作中该质控品每天(批)测定结果值点于图中,并将相邻的点用线连接。画上连线是增强视觉效果,便于观察,容易发现问题。在图的下方逐日记录日期、校准液吸光度、质控血清吸光度和操作者标志,如有特殊情况可记录在备注栏中。每个项目只做一个数据,并逐日将各个质控点以直线相连,形成质控曲线图。应每天及时将质控数据点到图上,而且要注意观察有无发生失控的情况,如果质控结果提示有失控的情况,即应进入处理失控的程序,并正确处理临床检测结果报告单的签发。在1个月末,应及时对本月的质控情况作出小结,统计出当月的x,s和CV,对本月的质控情况进行一简要明确的回顾,分析与记录所有值得重视的情况,对失控及采取的措施、采取措施后的效果等情况也应在小结中记录。
(二)Z-分数图
日常工作中如果每天使用高低不同浓度水平的几个质控品,要在同一个质控图上点出这些质控品的测定结果就有所不便。可采用各个质控品测定值的“Z-分数”的方法解决这个问题。某质控品的“Z-分数”是该质控品的某次测定值与其均值之差,除以该质控品的标准差。
![]()
例如,某质控品均值为140,标准差为5,某次测定值为145,则Z-分数=(145-140)÷5=+1;若测定结果为130,则Z-分数=(130-140)÷5=-2。因此,Z-分数质控图中的值和正负号表示的是质控品值偏离其均值的标准差的倍数和方向。Z-分数质控图的刻度一般从-4到+4,其间为±1,±2,±3的质控限。
(三)Youden图
1967年Youden提出了此质控图。这是双值质控图,同时测定低值及高值两个质控品,将结果点入图内,可以区分系统误差和随机误差,也可以应用于室间质量评价的统计分析。
(四)Westgard质控图
Westgard质控图的图形本身基本上和Levey-Jennings质控图十分相似,不同之处,主要在于Levey-Jennings质控图仅在图上考虑“单个”质控规则,而Westgard质控图考虑的是“多个”质控规则(详见Westgard多规则质控程序)。
(五)Monica质控图
Monica质控图是另一类被许多实验室常用的质控图,采用定值质控血清和以选定变异系数(choose coefficient variance,CCV)为控制线。因此,Monica质控图制作方便,启用新批号质控品时可以立即开始进入质控程序,平行重复的2个质控值可以反映操作的精密度,又因使用定值质控血清,一般认为也可反映准确度。原来认为还有另一个优点是本法使用CCV为控制限,所以可以将室内质控的情况与室间质量评估联系起来。但目前认为CCV的性质是反映众多实验室在室间调查时所有结果的离散度与评价准确度的指标,将CCV作为室内质控中的允许误差显然是不妥的。以定值质控品的定值数据直接作为室内质控的靶值,不经过实验室自己定值,也不太适宜。
五、室内质控方法的设计和质量评价
室内质控(IQC)不单纯是操作方法,也是质量管理中的一个内容,临床实验室要保证质量,应该实施总体质量管理(TQM)原则。开展室内质控先要有一个质量计划,定出一个试验的质量要求,在确定分析方法的不精密度和不准确度的同时,确定质控方法(规则),以保证达到预期的质量要求。实验室采用何种质控方法不是随意决定的,应使质控有效,能真正达到控制的目的,而且所用的质控方法是最经济的。
所有不同的分析项目由于其方法的不精密度与不准确度不同,若采用同一种质控规则,所起到的控制作用不一致,即所达到的控制质量不同。从质量管理要求来说,这个新的观点更加全面,将方法的不精密度和不准确度都与质量控制(QC)相联系,全面考虑这3个关键因素的相互关系。
质控方法本身也应有质量指标。评价质控方法质量的指标主要为误差检出概率和假失控概率,这也是选择质控方法或规则时的依据,或是预先确定的质量目标。
因此,检测项目选择质控方法不能随意决定,要有一定依据,事先经过仔细地选择,并经常对质控方法进行质量评价。每个项目的质控方法或控制规则不一定都是统一的,而应该在简便适用、确保质量的基础上实施个案化的质控方法。
功效函数图和操作过程规范图是室内质控方法设计和评价的工具,两者相比,后者简化了设计质控方法的过程,不需要计算临界误差并减少了不必要的操作,只要将测定方法的不精密度和不准确度标记在操作过程规范图上,就能直接选择合适的质控方法,保证质控工作的质量。下面介绍操作过程规范图。
(一)操作过程规范图的简介
操作过程规范(operational process specifications, OPSpecs)图的基础概念是对某项操作不仅应知道做什么,还要知道做得好不好。OPSpecs图可用于证实当前所用的统计质控方法是否合适,或选择新的控制方法是否能达到分析质量要求。
一张OPSpecs图包含了质量要求类型、实际质量要求、不同质控方法所允许的不精密度和不准确度等信息,还包括控制规则及质控测定数目,以及质控方法的误差检出率和假失控率等信息。
1. 标题 表明本项目的分析质量要求是以医学决定水平的10%为允许的总误差(TEa),能达到90%的误差检出率Ped作为分析质量保证(AQA)。
2. 坐标轴 ① y轴是允许的不准确度,以偏差%表示;② x轴是允许的不精密度,以标准差(s)%表示,等同于变异系数CV。“操作点”表示一种测定方法的实际操作,根据方法的偏差和CV定出坐标。
3. 控制线 表示不同质控方法的控制限:①图中最高的斜线表示测定方法非常稳定时的控制限,相当于以bias+2 s为总误差,方法的初次评价或确认时常以此作为可接受的标准;②其他的线对应一定的控制规则和质控测定的数目。
4. 右边方框列出各个质控方法的细节 方框中的第一列是控制规则,缩写为AL,A是规则符号或控制测定的数目,L是控制限。第二列是假失控概率Pfr,这一指标如<0.05是理想的,使质控的假报警降至最小。N是每一分析批次中质控测定的总数,N=2可以是一个质控测定2次,也可是2个不同质控物各测定1次。R是应用控制规则的批次的数目,一般是1批,但在多规则质控中有的规则如41s和10x分别要在连续几个批次中应用。
(二)OPSpecs图的应用步骤
以胆固醇测定为例。
确定质量目标 这是设计质控方法的起点。质量目标可以用允许总误差(TEa)表示。根据美国CLIA’88能力验证计划的评价限,概括了常用检验项目的允许总误差、不精密度、不准确度,供设计过程中应用,见表3-4。表中胆固醇的TEa为10%。
表3-4 常用检验项目的允许总误差、分析不精密度、不准确度
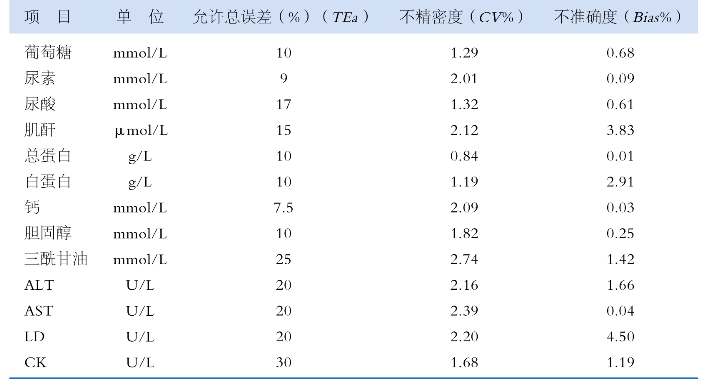
2. 确定质控的质量要求 即误差检出能力,一般选用90% AQA,并先要选用N数较小的质控方法,使质控成本降低。
3. 根据方法实际的不精密度和不准确度,在图上标出操作点 即以标准差或CV%为x坐标,以偏差%为y坐标。标准差或CV的数据可来源于室内质控或RCV,偏差的数据可来源于室间质评。
4. 确定实验室的首选质控方案 在操作点上方的控制线所代表的质控方法均可以采用,选一种最简便有效的。
如果所有的线均在操作点的下方,说明这些质控方案均不能满足质量要求,应该选另外的OPSpecs图,有较高的N或较低的误差检出率[如50%AQA(SE)],或改用其他精密度和准确度更好的方法,重新定操作点。
如果应用OPSpecs图软件,上述操作就十分方便,输入有关的数据后,自动生成OPSpecs图,随意选择质控规则用来观察和比较。
(三)OPSpecs图评估分析质量改进的作用
每当测定方法改变后都应重新检查质控计划,如果方法改进了,就有可能减少质控测定数目,采用较简便的质控方法,如果方法恶化,就有必要增强质控,或是增加N数,或是改变质控的规则,采用多规则质控。
在上面胆固醇测定的例子中,如果偏差从2.0%降低为0,CV仍为2.0%,在OPSpecs图上画出新的操作点,可以看到由于准确度的提高,可以采用N数为2(原来N=4)的12.5 s单规则质控,或13 s/22 s/R4 s的多规则质控。
如果OPSpecs图表明现有的质控方法可以达到90%误差检出率,实验室只要严格执行统计学质控就可以保证质控的效率。如现有的方法只能达到50%误差检出率的目标,则同时还需加强非统计学质控的方法,包括仪器的维护、操作人员的培训等,即通过加强全面质量管理,保证检验的质量。
六、质控规则
(一)Levey-Jennings质控图的质控规则
1. 一般将±2 s线作为警告线,±3 s线作为失控线 因为质控测定值的分布是符合正态分布规律的,所以有95%的结果应落在x±2 s范围内,有5%的结果可在x±2 s外,但在x±3 s内,不应有数值落在x±3 s以外。因此当质控值超过±2 s但< ±3 s时要引起注意,但不作为失控处理。质控值超过±3 s提示失控,暂时不能发出临床检测结果报告,进入失控处理程序。本规则主要是发现随机误差。
2. 当质控图形出现某种规律性或趋势性情况时,应分析是否发生了系统误差 因为在正态分布中均值两侧的数据分布几乎相同,不应有连续5次以上结果在均值的同一侧,或5次以上数值渐升或渐降,不应有连续2次结果在x±2 s以外。如质控曲线出现向上或向下的“漂移”现象(有明显分界的位移),则提示存在系统误差,准确度发生了突然的向上或向下的改变;出现渐进性的走高或走低(向上或向下的趋向)的趋势性变化,表明检测的准确度发生了逐渐的变化。出现上述情况时,纵使质控值还在±3 s的范围之内,也应引起注意,分析原因,采取正确的措施,使质控值回复到符合统计原理的随机分布状态。
3. 如采用以±2 s为失控线 虽然提高误差检出概率,但假失控概率亦较大,需要经过仔细评价。若以±2.5 s为控制线常可获得较好的控制效果。
4. 室内质控主要是控制精密度 所以如果采用的是定值质控血清,并且x与该定值(靶值)有较大差异时,应以本室的x标图,对质控效果不会有不良影响。否则可能会出现质控值分布在均值线一边的情况。
5. 按照Levey-Jennings质控图的原意 使用2个控制品时以13 s为失控规则,只要有质控值超出x±3 s的,就定为失控;使用1个控制品时,以12 s为失控规则,只要有质控值超出x±2 s的,就定为失控。若仅以13 s为控制规则,对误差识别的灵敏度不够;因此,这2种规则无论单独使用或联合使用时,均应小心判断。
6. R4s 只用于每批做2个或2个以上水平质控品时。在一批内,一个质控品的测定值超出了x +2 s限值;另1个质控品测定值超出了x-2 s限值,是失控规则。这个“范围”规则对分布宽度的变化很敏感,所以对检测系统的精密度变化或随机误差的增大,有很好的指示作用。
(二)Westgard多规则质控程序
临床检验中最简单和最常用的是Levey-Jennings质控方法,其质控规则主要为单独的12 s或13 s(即以x±2 s或x±3 s作为控制限)来判断该批测定在控或失控。它方便易行,却相对较简单粗糙。生化检验进入自动化阶段后,面对众多控制结果,原先的手工绘图和单规则质控方法显得落后了。Westgard于1980年提出的多规则程序是针对各个控制规则的特性,将它们组合起来,以计算机作逻辑检索,借此提高控制效率的一种质控方法。Westgard多规则控制程序(以下简称多规则)要求受控项目每次使用2个水平的质控品。1个水平的质控品亦可以,但观察误差的敏感性就差。手工绘制多规则质控图的基础仍是Levey-Jennings质控图,只是控制的规则变了。
Westgard多规则的主要特点是:① 它在Levey-Jennings方法的基础上发展起来,很容易与Levey-Jennings质控图进行比较并涵盖了Levey-Jennings图的结果;② 具有低的假失控或假报警概率;③ 失控发生时能确定产生失控的测定误差的类型,以帮助确定失控的原因,便于寻找解决问题的办法。也可以认为Westgard多规则是第二代的质控方法。常说的Westgard多规则即12 s、13 s、22 s、R4 s、41 s、10x 共6个质控规则,用12 s/13 s/22 s/R4 s/41 s/10x 表达。分述如下:
1. 12 s 为警告规则,不是失控规则。若本批控制结果没有超出±2 s限值线,表示本批结果没有问题,在控,可以发出报告。若本批检验有一个控制结果超出(不包括正好在限值线上的结果)±2 s,表示本批结果可能有问题,是一个警告,但不能肯定是失控,需要作进一步分析,若再符合以下任何一条规则,才能判为失控。
2. 13 s 如这个控制值不仅超出±2 s限值线,还超出了3 s控制线,判为失控。
3. 22 s 可有2种表现,同批2个质控品结果同方向超出+2 s限值;或同一控制品连续2次控制结果同方向超出-2 s限值。后者要将连续2次的质控结果结合分析。这一条属系统误差失控。
4. R4 s 在同一批测定中,两个控制结果级差超出4 s范围,例如其中有一个超出了+2 s限值,另一个超出-2 s限值,或一个超出了+2.5 s,另一个超出了-1.5 s时,属随机误差过大,属失控。
5. 41 s 有2种表现:① 同一质控品连续前3次结果和本次结果在同方向超出1 s范围;② 2个质控品的前1次结果和本次结果,均同方向超出+1 s或-1 s范围。属系统误差表现,失控。
6. 10x 本次结果与前4次结果连续分析,2个质控品5次结果连续在均值的同一侧。或一个质控品连续10次结果在均值的同一侧。属系统误差表现,失控。但是,若出现12 s警告结果的这个控制品,仅是这一次在均值的某一侧,正好另一个控制品有连续9次结果在均值的同一侧,这不是10x 的表现:若出现12 s警告结果的这个控制品,连续共有9次在均值的某一侧,另一个控制品这一次也在同侧,但前一次在另一侧。这亦不是10x 的表现。
上述由6个规则组合的多规则,是1980年Westgard提出的经典的Westgard多规则。其他常用的规则还有如 8x 规则、12x 规则、2/32 s规则、6x 规则、9x 规则、7规则等。
7. 多规则质控检索逻辑 以12 s规则作为警告规则启动13 s/22 s/R4 s/41 s/10x 系列质控规则的逻辑示意图。如果没有质控数据超过x±2 s控制限,则判该批结果在控,可以报告该批患者检测的结果。如果一个质控测定值超过x±2 s,则由13 s、22 s、R4 s、41 s和10x 质控规则来进一步检验质控数据。如果没有违背这些规则,表示这次12 s的出现也许是属于正常的波动,不是失控,不要作任何失控处理,可以报告患者结果。如果违背其中任何规则,说明确实为失控,拒发患者报告。在实践中13 s或R4 s规则常检出随机误差,而22 s、41 s、10x 质控规则是检出系统误差。当系统误差非常大时,也可由13 s质控规则检出。
(三)真失控和假失控
研究质量控制方法的性能时着重在两个方面,即真失控检出的可能性和假失控误报的可能性。每个控制规则都有检出2种误差的可能性。对真失控检出的可能性大了,假失控误报的可能性也增加了;反之,真失控检出的可能性减小了,假失控误报的可能性也小了。只是每个质控规则的真失控检出可能性和假失控误报可能性可随规则而变化,所以在使用单个控制规则做质量控制时,更要注意对控制规则的选择。各实验室应重视和熟悉各个质控规则的特性,结合实验室自身要求或临床的允许误差要求,制订出自己的分析过程的控制方案,即设计本实验室的质控方法,并不断提高质控效率。
七、失控后的处理
对失控情况采取正确的措施也是质控工作的一项重要内容。分析阶段质量控制的工作流程,是在患者标本检测前和检测中测定质控品,记录控制值绘制于质控图中。控制值在控,患者标本可以检测和报告;控制值失控,停止患者标本的检测,拒发检验报告,寻找原因,解决问题。再重新开始检测,并对失控时的患者标本重做。目前不少实验室的质量控制常常不遵守这个流程。先前对失控(即出现失控信号)时的纠正措施指导意见常常建议先重做质控品或再试一个新的质控品,以查明是否有人为误差或偶然误差,或者查明是否“质控品坏了”。新近有观点认为失控后简单地重测质控品或再试一个新的质控品以判断究竟是否失控或失控是否因为质控品的问题,是不正确的做法。因为不分析误差的原因就机械地重测质控品,无论测定的结果是在控还是继续失控实际上对失控的判别意义不大,反而可能延误了解决误差的时机,把问题留给了以后。问题既有可能是因假失控概率加大而表现的失控,也有可能因降低误差检出概率而使得严重的系统误差情况均不能检出。所以不应提倡在分析失控原因之前就复测质控品,而应先分析失控原因。
对失控原因的分析和排除是质控程序中最关键的,但又没有固定的模式,大概的方法参阅下面所述。
(一)失控处理程序
发生失控情况后,立即向专业组长、科室和质量负责人报告,该分析批次的患者标本结果报告暂时不发,根据失控表现仔细分析原因并作纠正和排除后,再复测质控品直至回到控制状态,必要时复测部分或全部待测标本,然后发出正确的检验报告。以上整个过程应有详细文字记录并保存。
(二)失控原因分析和排除
失控信号的出现受多种因素的影响,这些因素包括操作上的失误,试剂、校准物、质控品的失效,仪器维护不良以及采用的质控规则、控制限范围、一次测定的质控标本数等。失控信号一旦出现就意味着同批测定的患者标本检验结果可能作废,但也可能没有发生真正的误差而仅是一种假失控。因此,首先要尽量查明导致失控的原因,采取适当措施,消除后,再随机挑选出一定比例(如5%或10%)的待测标本进行重新测定,最后根据既定标准判断先前的测定结果是否可接受,对失控作出恰当的判断。如判断为真失控,应该对相应的所有失控待测标本和质控标本进行重新测定,并且质控标本结果应该在控。如失控信号被判断为假失控时,常规测定报告可以按原先测定结果发出,不必重做。无论是真失控或假失控都应该记录分析原因的全过程。一般可以采用如下步骤寻找原因:
1. 检查质控图或控制规则以确定误差类型 区分是随机误差还是系统误差,不同的控制规则有不同的检测误差类型的能力(敏感度)。例如13 s和R4 s规则通常指示随机误差,22 s,41 s和10x 规则通常指示系统误差,检查质控图上的质控点的分布情况也可提供类似的信息,质控曲线的突然变化或较大幅度的波动应多考虑随机误差,而趋向性的现象多为系统误差。
2. 认识与误差类型有关的一些因素 由于随机误差和系统误差有不同的原因,因此从不同的误差类型较易追查有关误差来源的线索。导致系统误差的因素比引起随机误差的因素多见,一般也较容易解决。
引起系统误差常见原因有:试剂批号改变、校准物批号改变、校准物定值错误、不适当配制试剂、试剂变质、校准物变质、试剂或校准物的不适当储存、由于移液管的误调或未校准引起标本或试剂的体积变化、孵育箱和反应盒的温度变化、分光光度计的光源老化以及操作人员的更换等。
随机误差的常见原因有:试剂和试剂通道中的气泡、混合试剂不恰当、温度和孵育不稳定、不稳定的电压以及在吸量、定时方面的个体操作变异等因素。
3. 对于手工法操作的项目 应认真回顾操作的全过程,有无换人,有无操作及结果计算上的失误,然后依次确认标准品、试剂、反应温度、比色计等是否正常。
4. 对于生化自动分析仪测定者 首先应该分析在质控品失控之前有无改变分析系统的状态,如分析仪硬件的更改(包括光路部件的更换),化学反应参数的更改,标准品的变更、试剂的变更,质控品变更等。对于更改过的部分应仔细确认其更改的正确性。同时区分是个别项目质控品失控还是多个项目失控。个别项目失控,可以基本确定分析仪工作是正常的。重点确认该项目的试剂有无受污染、久置变质、位置错位,确认校准品是否正常,确认质控品中该项目是否分解失效,如葡萄糖、某些不稳定的酶、胆红素等。多项目失控,处理问题的步骤首先应针对这些试验的共同因素,如都是一些脱氢酶反应的项目(丙氨酸氨基转移酶、己糖激酶法葡萄糖测定等)失控,共同的特点是都以340 nm为测定波长,就很有可能比色灯泡340 nm光能量明显下降或该波长滤色片损坏;如都是一些氧化酶反应的项目(葡萄糖、三酰甘油、总胆固醇、尿酸等)失控,则最有可能受到维生素C、胆红素等物质的污染和干扰,或是500 nm光路有异常。找不出明显共同因素的多项目甚至是全部项目的失控,很可能是仪器的故障、质控品变质等所致。
5. 分析与新近改变有关的原因 系统误差大多数常与试剂或校准问题有关。突然漂移通常由更换试剂、新的校准或校准品批号改变所引起。当查找漂移的原因时,操作者应检查试剂、校准,并且做好记录,以便为解决问题提供线索。
趋向性的问题可能比单纯的漂移难解决,因为趋向性发生与发展的过程较长,常见的原因有试剂逐渐变质、校正值漂移、仪器温度改变、滤光片或灯泡老化等,查找时应逐个分析确认。
查找和解决导致随机误差增加的问题更为困难,因为随机误差不易分析或量化。
如果上述几个步骤均未能得到在控结果,可能是仪器或试剂的内在原因,只有与仪器试剂厂家联系,请求他们的技术支援。
6. 解决问题并记录处理结果 检查出问题的原因后,针对这个原因采取纠正措施,这时可以重新测试所有的质控品,一旦在控,应将失控批次的待测标本部分或全部重新测定。另外,应该将失控事件以及具体的处理过程详细记录下来。
八、室内质控数据的管理
室内质控是长期的日常工作,要将每天累积下来的大量数据,除了在每月结束时作小结和分析外,应该作为实验室重要的资料予以长期妥善的保存。
(一)每月室内质控数据统计处理
1. 每月结束时,应将各个分析项目的质控数据作回顾分析,观察每一张质控图的总体情况是否正常,所有的异常情况尤其是数据连续分布在均值一侧、渐进趋向性的现象等是否已作处理等。也要注意质控图的细节,如操作者的标志是否完整,数据点的标记是否规范,所有发生的事件的记录是否完整等。在回顾性分析质控图中发现的问题也应作记录,并告知有关的人员,或在科室业务讨论中通报,以期不断地提高全科室人员质控意识和工作质量。
2. 统计计算每张质控图的当月x、s和CV,并与以前的数据作比较,尤其是与本室的OCV与RCV作比较。如整个控制系统没有大的变动,这三个数据也应呈一定的稳定性,任何一个数据出现明显的波动一定是有原因的,一定要仔细分析。
3. 室内质控应用电脑越来越普遍,每月的统计小结可由电脑自动完成,但上述两点中的分析和讨论不能省去。
(二)每月室内质控数据的保存
1. 每月的室内质控数据和资料,包括质控图、失控情况记录、失控处理措施、每月分析小结等,都应装订成册,加上标志明显的封面,由质控负责人归档保存。
2. 应用电脑的实验室,可以将上述室内质控数据和资料以电子档案的形式作出备份,备份可以放在专用电脑的硬盘中,也可以光盘或其他电子存储介质保存,可以适当加密以保证资料保存的可靠性。
3. 地区临检中心有要求时,可随时将每月的质控资料上报给临检中心。
4. 关于质控数据的取舍与修改问题。室内质控是监测日常工作质量的一种手段,出现失控情况完全是正常的,质控图有时不很漂亮也不能据此认为质控做得不好,实验室如果为了追求形式上的效果,将失控的数据不作记录,或将数据进行人为的修饰,拿出无可挑剔的质控图,是毫无意义的,对室内质控工作只有害处而无任何帮助。重要的是使质控真正发挥控制的作用,切实起到促进和提高实验室技术和管理水平的效能。
九、室间质量评价
在临床实验室质量管理体系中,室间质量评价(简称室间质评,EQA)是重要的组成部分。室间质量评价是由多家实验室测定同一个样品并由外部独立机构收集和反馈各参与实验室上报的测定结果,来评价实验室检测水平的过程。室间质量评价也被称作能力验证,根据ISO/IEC导则43:1997的定义,能力验证是通过实验室间的比对,判定实验室的校准/检测能力的活动。它是为确定某个实验室某些特定校准/检测能力以及监控其持续能力而进行的一种实验室间比对。
国际上实验室间的质量评价可以追溯到20世纪30年代,我国的室间质评则起始于20世纪70年代末。经过20多年的发展,已在全国范围内形成一个临床检验质控网络,为推动我国检验医学的进步和发展作出了贡献。
(一)室间质评的目的和作用
室间质评作为质量控制的手段可帮助参与实验室提高质量、改进工作、减少差错、避免可能出现的医疗纠纷和法律诉讼,建立各实验室间检验结果的可比性,最终使参与实验室能作出准确的检验结果。
1. 识别实验室间差异,评价实验室检测能力 室间质量评价报告可以帮助实验室发现其与其他实验室检测水平的差异,客观地反映该实验室的检测能力。
2. 识别问题并采取相应改进措施 室间质评结果可帮助实验室发现问题和采取相应措施。如果本实验室结果与靶值有显著差异,就需要认真分析找出原因并加以改进。常见的原因如检测仪器未经校准或缺少维护、试剂质量不稳定、检验人员能力不能达到要求、未做室内质控或室内质控失控、对调查样品处理不当、调查样品本身存在质量问题、上报检验结果时计算或抄写错误或者质评组织者确定靶值不准等。
3. 改进分析能力和实验方法 如果实验室拟改变实验方法和选购新仪器时,可以通过室间质评资料的综合分析找到更准确、更可靠、更稳定或者更适合本实验室的实验方法或仪器。
4. 实验室质量的客观证据 室间质评结果可以作为实验室质量稳定与否的客观证据。新的医疗事故处理条例实施后,实验室可以以获得满意的成绩证明自己检测系统的可靠性。即使成绩不理想,但已根据质评结果找出原因,有了改进并有文字记录,也可以作为质量保证举证的有力证据。
5. 增加实验室用户的信心 多次满意的室间质评成绩可以鼓励实验室(实验数据)的用户即医生和患者充分信任实验室提供的数据信息,应用于诊断和治疗。
6. 支持实验室认可 室间评价结果可以作为实验室认可的重要依据,ISO 15189,IDT《临床实验室——质量和能力的专用要求》提到的“能力验证”就包括室间评价。
7. 实验室质量保证的外部监督工具 我国虽然尚未出台类似美国CLIA’88的相关法律,但室间质评成绩可作为卫生行政主管部门和医院管理者对实验室质量实施监督管理的重要工具。
8. 确定重点投入和培训需要 室间质评可以帮助实验室确定哪个项目需要重点投入和加强培训。如哪些项目、哪些环节的成绩不理想,问题较多,就需要医院和实验室给予更多的关注和投入,以期尽快扭转局面。
(二)室间质评调查样品的检测
1. 室间调查样品必须按实验室常规工作,与待测患者样品同样的方式,用实验室常规检验方法,由进行常规工作的检验人员检验。
2. 检测调查样品的次数必须与检测患者样品的次数一样。
3. 在规定回报调查样品检测结果给质评组织机构截止日期之前,不得进行关于调查样品检测结果的实验室之间的交流。
4. 不能将调查样品或样品的一部分送到另一实验室进行检测。
5. 实验室对调查样品进行检测时,应将处理、准备、方法、审核、检验的每一个步骤和结果报告及有关人员签字等作好完整记录,形成文件化格式,并妥善保存。
(三)室间质评成绩评价方法
1. 调查样品的定值 确定调查样品的定值非常重要。定值准确才能对各参与实验室提高准确度起指导作用,如果定值不当反会影响全局。目前确定靶值常用2种方法。
(1)由各个参考实验室用参考方法将调查样品的各种成分进行定值,作为靶值,参考实验室可在质评活动中发现和培育。
(2)将所有参与实验室的结果按测定方法不同算出总均值,反复剔除>±3 s的数据后再算出方法均值(xm )作为靶值。参与的实验室越多,所得结果越趋向于正态分布,则xm也越接近真值。
2. 变异指数得分法评价 变异指数得分(VIS)是目前常采用的方法,由Whitehead教授提出,并被WHO推荐。计算方法:
![]()
式中:V为测定值与靶值偏离百分数(变异百分率),x为实验室测定值,T为靶值,若x=T,则V=0
再计算变异指数(VI):

式中:CCV为选定的变异系数。
1985年,卫生部临床检验中心召开的质控会议确定将上述公式修改为:
![]()
式中:D为靶值。
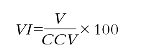
当VI≤400时,VIS=VI;当VI>400时,VIS=400,主要目的是防止出现因个别过大的偶然误差造成对检测水平全面评价的假象。VIS在计算时只计整数,且不带正负符号。
我国的评分标准:VIS≤80为优秀,VIS≤150为及格,一般认为VIS>200,表明结果中有临床上不允许的误差。
表3-5为卫生部临检中心选用的部分生化检验项目的CCV值。
表3-5 卫生部临床检验中心选用的CCV值

3. 偏差%评分方法评价 以测定结果偏离靶值的距离确定每一分析项目的正确结果,即对每一项目确定了靶值后,通过使用基于偏离靶值的百分偏倚的固定准则或标准差进行评价。卫生部临床检验中心推荐使用的准则是美国CLIA’88中的能力比对试验(PT)对分析质量的要求(表3-6)。
具体地说,某项目的测定值距离靶值的偏倚%若在可接受范围内,则PT得分为100,若超出可接受范围,则PT得分为0。
表3-6 美国CLIA’88能力比对检验的分析质量要求

(续表)

免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。
















