重金属污染
在日常生活当中,金属时时与我们相伴;我们做饭用的勺子,电饭锅,铲子等等都是由金属材料制成。我们家中用的热水器,防盗门,合金窗户等,还有航空航天、工业制造等方面,可以说金属渗透到我们生活的每一个角落。为我们的生活、学习、工作带来了很大的帮助。同时随着社会的进步与人类的发展,金属的用途会更加广泛。另一方面随着全球经济的迅猛发展,人类之手疯狂的伸向自然界,自身的发展与工业的发达造成了今天严重的环境污染,其中我们“可爱的”重金属一族成了人类可怕的一角。因为重金属的污染问题空前严重,成为全世界人民不可忽视的话题。
重金属是构成地壳的元素,在自然界的分布非常广泛,在地壳中的含量虽低于0.l%,但广泛存在于各种矿物和岩石中,经过岩石风化,火山喷发,大气降尘,水流冲刷和生物摄取等过程,构成重金属元素在自然环境中的迁移循环,使重金属元素遍布于土壤、大气、水体和生物体中,与人工合成的化合物不同,它们在环境的各个部分都存在着一定的本底含量。
重金属作为有色金属,在人类的生产和生活方面早就得到广泛应用,这使得环境中存在着各种各样的重金属污染源,由于人为活动使环境中某些金属积累,改变环境的本底浓度。采矿和冶炼是向环境中释放重金属最重要的污染源。向环境中排放大量废气、废水和废渣的重金属工业企业不计其数,其次是化石燃料(煤、石油)的燃烧也是重金属的主要释放污染源。在局部地区甚至可能出现高浓度重金属严重污染。
重金属大多属于周期表中的过渡元素。过渡元素的原子在化学反应时,不光外层电子参与,次外层、外数第二层电子也可以参与,因此,过渡元素一般都具有多种价态,能在较大范围内发生电子得失的氧化还原反应。在天然水体中,有富氧的氧化性环境和缺氧的还原性环境,就使得重金属在不同的水体环境中可能以不同的价态存在,重金属的价态不同,其活性和毒性效应也就不同。
重金属在水环境中可以经过水解反应生成氢氧化物,也可与一些无机酸(如H2S、H2CO3)反应,生成硫化物、碳酸盐等,而这些化合物的溶解度都比较小,易生成难溶的沉淀物。这一特性使重金属污染物在水体中容易沉积、扩散范围有限,这是有利的一面。但是大量聚积于排污口附近底泥中的重金属污染物,将成为长期的次生污染源,一旦环境条件改变,会重新形成可溶性物质而释放到水体中,这显然对水体污染防治来说是一个值得引起注意的问题。
重金属具有潜在危害性。重金属可以通过多种途径(食物、饮水、呼吸、皮肤接触等)进入人体,还可以通过遗传和母乳侵入人体。重金属不仅不能被降解,反而能通过食物链在生物体或人体内富集。与生物体内的生物大分子如蛋白质、酶、核糖核酸等发生强烈相互作用,造成急性或慢性中毒,危害生命。
重金属在工厂、矿山生产过程中随废水排出,进入水体后不能被微生物降解。经食物链富集,能逐级在较高级生物体内千百倍地增加含量,最终进入人体。1955-1972年日本富士山县神通川蜮,日本三人金属矿业公司锌铝冶炼厂排放含镉废水,污染神通川。两岸居民和矿工使用含镉废水,并用河水灌溉农田,使粮食中重金属含量增高。1955年后,当地出现怪病,患者腰、膝关节疼痛,随后遍及全身,最后骨骼萎缩,饮水不进,在衰弱中疼痛而死亡。
所谓重金属污染主要是指的汞、镉、铅、铬以及类金属砷等生物毒性显著的重金属。重金属在人体内能和蛋白质及各种酶发生强烈的相互作用,使它们失去活性,也可能在人体的某些器官中累积,如果超过人体所能耐受的限度,会造成人体急性中毒、亚急性中毒、慢性中毒等危害,严重的可以导致死亡。
一、铅(Pb)
重金属元素铅位于元素周期表的第四主族,第六周期。约占地壳质量的1.6×10-5,排在元素含量的第35位。铅容易富集形成硫化铅矿PbS,即方铅矿,其他的还有白铅矿PbCO3和硫酸铅PbSO4。此外,铅还存在于各种铀矿和钍矿中,许多天然放射性元素如铀、钍、镭、锕、钫、砹、钋等最终都要蜕变成稳定的铅。天然铅有四种稳定同位素:铅204、206、207和208,还有20多种放射性同位素。
铅是带蓝色的银白色重金属,熔点601K,沸点2013K,密度很大,为11.35g·cm-3,莫氏硬度为1.5,质软,强度不高。铅的层性相当好,可以轧成极薄的铅箔。但铅的延展性并不好,用拉伸法制铅丝,只能伸到直径大于1.6mm,再细的铅丝只能用挤压法生产了。铅还有一个独特的长处,就是具有极高的锻接性能,新切开的铅表面在室温下用不太高的压力,就能迅速地锻接在一起。所以用它来做绝缘电缆的包皮,操作简单方便,效果还好。
1.铅的化学性质。铅是两性金属元素,它的主要氧化数为+2和+4。
(1)室温下,铅即与空气中的氧、水和二氧化碳作用,表面生成一层致密的碱式碳酸铅的保护膜而失去金属光泽。
4Pb+2O2+2CO2+2H2O══2PbCO3·Pb(OH)2↓
(2)加热时,铅能与氧、硫、卤素等非金属直接反应生成氧化物、硫化物和卤化物。
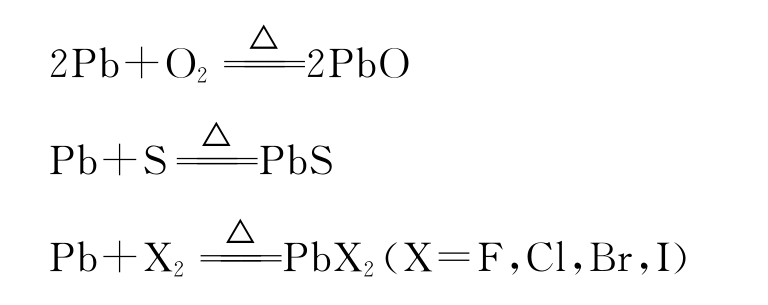
(3)在空气存在下,铅能与水缓慢反应生成氢氧化铅:
2Pb+O2+2H2HO══2Pb(OH)2
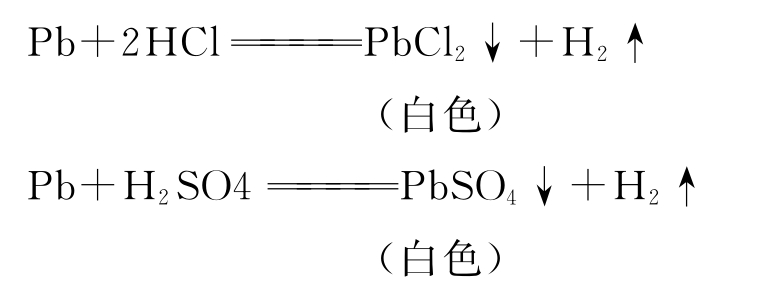
(4)铅与酸反应都生成Pb(Ⅱ)化合物。
①铅与稀盐酸或稀硫酸作用,因生成难溶的PbCl2和PbSO4而使反应终止:
②铅溶于热的浓盐酸或浓硫酸:
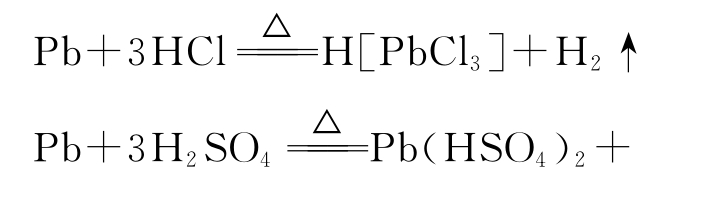
SO2↑+2H2O
③铅不与浓硝酸作用,与稀硝酸反应生成可溶的硝酸铅:
3Pb+8HNO3══3Pb(NO3)2+2NO↑+4H2O
④在有氧存在的条件下,铅可溶于醋酸,生成易溶的醋酸铅,这就是醋酸从含铅矿石浸取铅的原理:
2Pb+O2+2H2O══2Pb(OH)2
2Pb(OH)2+2HAc══Pb(Ac)2+2H2O
Pb(Ac)2是一个假盐,因为在水溶液中它不能像其他的盐一样有单独的Pb2+和Ac-离子,它是Ac-离子与Pb2+生成的配合物:
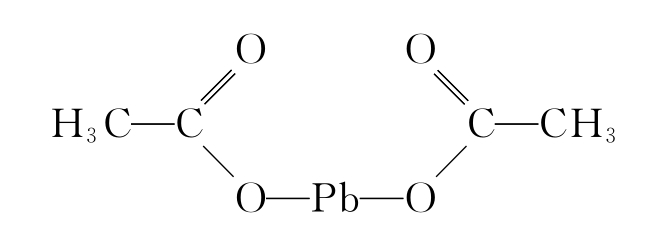
⑤在强碱溶液中,铅能缓慢溶解,生成亚铅酸盐:
Pb+2NaOH══Na2PbO2+H2↑
或写成Pb+NaOH+2H2O══Na[Pb(OH)3]+H2↑
2.铅的制备方法。工业冶炼铅的过程是先把矿石煅烧,使硫化铅变成一氧化铅:
2PbS+3O2══2PbO+2SO2
再用焦炭还原PbO,即可得粗铅:
PbO+C══Pb+CO
用废铁还原PbS矿也可得粗铅:
PbS+Fe══Pb+FeS
粗铅通过电解可得纯铅
3.铅的应用与毒性。铅主要用于制造蓄电池中的多孔极板和合金。铅、锡和锑合金可铸铅字,利用锑有热缩冷胀的特点,铸出的铅字特别清晰。铅、锡合金可做焊锡,在电子、电器等行业大显身手。铅还是放射性的防护材料,连X-射线,γ-射线等都不能穿透它,所以在使用X-射线,γ-射线以及原子能工业都离不开铅。
铅在为人类服务的同时,也给人类带来许多麻烦,它污染人类的生活环境,危害人们的健康。
铅是一种积累性毒物,它很容易被胃肠吸收,其中一部分破坏血液使红血球分解,一部分通过血液扩散到全身器官和组织,并进入骨骼。
沉积在内脏器官及骨髓中的铅化合物从体内排出的速度极慢,逐渐形成慢性中毒。慢性中毒最初只是疲倦,食欲不振,体重减轻。严重时呕吐、腹泻,并出现末梢神经障碍,造成桡骨神经麻痹及手指震颤症。再严重时导致铅毒性脑病,有机铅急性中毒会神经错乱,因急性脑病而死亡。
现在,人们正在用无铅汽油代替含铅汽油,并且研究开发新的能源来减少以至消除铅对环境的污染。
随着都市化、工业化的发展,环境污染程度日益严重,其中铅是最主要的污染源。例如,超标农药的运用,加重了土壤对农作物、植物中铅污染;含铅汽油燃烧后,有85%的铅排放入大气中;房间内墙壁、家具、玩具上的油漆可散发出含铅气体;一些化妆品、染发剂、电池、釉彩碗碟、含铅铝煲等日用品也含铅;家庭烧火用的燃煤可产生铅;食品生产加工过程中机械、容器、管道都含铅,典型的如含铅生铁铸成的炉膛制作爆米花,含铅原料制成的皮蛋;自来水管有些用铅制成,水中的铅含量虽然不高,但其生物利用度往往较高。
热水龙头放出的水,较冷水龙头含铅量高。这些铅毒,通过皮肤、消化道、呼吸道进入体内与多种器官亲和,对神经、血液、消化、心脑血管、泌尿等多个系统造成损害,严重影响体内新陈代谢。它堵塞金属离子代谢通道,造成低钙、低锌、低铁,且导致补充困难。体内的铅靠自身排除是很慢的,在不继续接受铅污染的条件下,骨骼内的铅要经过20年才能排除一半。因此铅中毒损害机体器官是终身的,不可逆的。
4.铅污染的来源。
(1)大气污染。据测定,金属冶炼厂附近及汽车来往频繁的马路边,空气中铅的含量超过国家允许的标准。国内行驶的汽车,绝大多数由于汽油中加入一种含铅的物质作为抗震剂,所以汽车的尾气中含铅较多。
(2)室内吸烟。香烟燃烧时,烟雾中含有极为微量铅颗粒,虽然其量很少,但长期吸入,也会引起蓄积中毒。
(3)室内某些装饰品。如用颜料、白漆修饰墙壁,婴幼儿无知,常扯下及用手抠挖墙壁上的“皮”吞吃,以致中毒。此外涂有色彩的玩具,印有彩色画的图书,搪瓷等均含有铅,儿童可因吞食彩色油墨书报,牙膏皮及含涂料的生活用品等而引起慢性铅中毒。
5.铅污染对人体健康的危害。工业生产和生产用品中的铅主要以粉尘和烟雾的形式通过呼吸道和消吸道进入人体。经呼吸道吸收较快,大约有20%~30%吸进血液循环;经消化道呼收的约为5%~10%。铅吸收后即进入肝脏,一部分由胆汁排到肠内,随粪便排出体外:另一部分进入血液。血液中铅初期分布在各组织里,以肝肾含量最高,以后以不溶的磷酸铅沉积在骨头和头发等处。急性铅中毒临床表现为恶心、呕吐、腹绞痛和便秘等胃肠道症状。工业生产及生活中主要是馒性铅中毒。患者早期症状是乏力,口中有金属味,肌肉、关节酸痛,接着发生腹痛和神经衰弱综合征,随着病情发展,还可出现运动和感觉神经传导速度减慢、贫血、腹绞痛、腕下垂、尿蛋白和肾功能改变等。
二、汞(Hg)
汞是一种化学元素,又称水银,位于元素周期表的第八副族,第六周期。汞有7种稳定同位素:汞196、198、199、200、201、202、204。
汞是银白色易流动的金属,为常温下唯一呈液态的普通金属,最大特点是在室温下呈很重的液体,凝固点-38.87℃,沸点358.58℃,相对密度为13.5939g·cm-3(20.4℃)。汞有良好的导电性,热膨胀率相当大,在0℃~300℃,膨胀系数与温度之间呈很好的线性关系,这一性质被利用来制造温度计。汞在地壳中的含量为5×10-5%,它是一种很不活泼的金属,因此自然界中存在着游离状态的汞,它们常与汞矿伴生。汞的矿物有辰砂(三方晶系的HgS),黑辰砂(等轴晶系的HgS)、硫汞锑矿(HgS·2SB2S3)、亚黝铜矿(2Cu2S·HgS·Sb2S3)。
1.汞的化学性质。汞的化学性质很不活泼,在空气中不被氧化。如果金属汞中含有少量铅或锌,长期暴露在空气中,表面上形成含氧化铅和氧化锌的灰色浮渣。汞在加热至沸腾时与氧作用,生成红色的氧化汞。汞能直接与硫、氯、溴、碘作用,生成硫化物和卤化物。汞不与稀盐酸和稀硫酸作用,但溶于热的浓硫酸和硝酸中,汞也不溶于碱。
汞能溶解许多金属(如钾、钠、金、银、锌、镉、锡、铅)形成汞齐,它可以看成是一种合金。汞的氧化态为+1、+2,+1价者常被称为亚汞盐或亚汞化合物。+1价汞的化合物不稳定,容易发生歧化反应:
Hg2Cl2——Hg+HgCl2
在二价汞盐溶液中加入氢氧化钠溶液,如果两种溶液都是冷的,生成的氧化汞是黄色的;如果溶液都是热的,则生成橘色的氧化汞;如果汞在空气中加热或将硝酸汞热分解,则生成鲜红色的氧化汞,三种氧化汞的晶体结构并无区别。氧化汞溶于酸,不溶于碱。
汞和汞盐都有毒,特别是氯化汞(HgCl2)是一种剧毒物质,致死量为0.3克。汞慢性中毒会出现牙床红肿出血、手发抖、耳聋、消化系统失调等症状,汞中毒最典型的实例是日本熊本县水俣湾的受汞污染的鱼被食用后,引起水俣病。由于汞的挥发性大,操作时要注意通风,不使汞洒落地面。
2.汞的制备方法。汞矿冶炼工艺很简单,先将辰砂在空气中灼烧,转变为氧化汞,它会立即分解成汞,冷凝后在水下收集,可用滤布过滤除去一些杂质。提纯的方法是用5%硝酸将杂质铅、铜、镉等溶解,再用蒸馏法提纯以除去金、银等杂质。金属汞的用途不多,少量用于制造温度计、气压计、压力计和用于真空泵。汞齐用于从矿石中提取金和银以及补牙。钠汞齐与水作用缓慢,在有机合成中用作还原剂,比金属钠好。钠汞齐还用于电解食盐制氢氧化钠。汞化合物还用作颜料、催化剂等。
3.汞的应用与毒性。汞广泛用于制作温度计、压力计、电学仪器和各种控制器;汞和汞的化合物还用于制作红色颜料、整流器、镜子等;汞204是优良的载热剂;汞198发射的波长为5.461埃的绿线,被定为波长的标准;汞的放射性同位素在化学研究中用作示踪原子。汞和汞盐都有毒,在使用的时候要多加注意。
4.汞污染来源
(1)化妆品。化妆品汞对皮肤有一定的漂白作用,因此,具有漂白、祛斑作用的化妆品多含有汞。国家规定在化妆品中的汞含量不得超过1mg/kg,但2002年,广西壮族自治区对祛斑类化妆品的汞含量进行专项抽查的结果表明,在50种祛斑类化妆品中,有16种汞含量严重超标,其中最低超标480倍,最高超标达6.7万倍。2003年春节前,福建省工商局在商品质量监督抽查中发现,在5种汞超标的化妆品中,超标最高者达2.6万倍。
(2)来自照明用灯。照明用灯目前普遍使用的室内荧光灯、室外高压汞灯、五彩缤纷的霓虹灯等,都需要汞作放电气体。这些灯报废后,一旦破碎,所含的汞将全部进入环境。我国现在每年生产荧光灯约10亿支,按每支灯管含汞量为30毫克计,每年用于荧光灯的汞约30吨。一支在常温下打碎的40W荧光灯,可在瞬间使周围空气中的汞蒸气浓度高达10~20mg/m3,超过国家大气质量标准中对汞最大允许浓度0.01mg/m3的1000~2000倍
(3)来自齿科材料。齿科材料目前充填龋齿的主要材料是银汞合金。苏格兰的研究人员对180名牙医进行调查研究后发现,在这些牙医的尿液和指甲中,汞的含量是正常人的4倍。与一般人群相比,牙医出现肾脏疾病和记忆力损伤的可能性更大。补牙时,银汞充填物产生的汞蒸气,对患者同样有害。
(4)来自燃煤。燃煤研究表明,燃煤是全球最大的汞的人为排放源。
(5)来自水生生物。持久性、易迁移性和高度的生物富集性,使得汞成为目前全球最引人关注的环境污染物之一。汞在36℃就开始蒸发,温度越高,蒸发越快。汞蒸气可以随着大气环流迁移到很远的地方,甚至人迹罕见的北极。汞及其化合物很容易溶解在脂肪类物质中,沿着食物链(更多的是沿着水生生物的食物链)逐级浓缩,最终造成水生生物体内汞的含量远远高于环境水体中的汞浓度,可高达20万倍!
20世纪80年代,我国对黄河宁夏段五种经济鱼类的监测结果表明,鱼体汞超标率达100%。美国食品药品管理局公布的资料显示,多种海鱼上了“水银鱼”的黑名单,如金枪鱼、鲈鱼、鳕鱼、比目鱼、旗鱼、鲨鱼、黑斑鳕、鳟鱼、剑鱼、鲭鱼、马林鱼、梭子鱼、白口、狭鳕、方头鱼等。
5.污染对人体健康的危害。金属汞中毒常以汞蒸气的形式引起。由于汞蒸气具有高度的扩散性和较大的脂溶性,通过呼吸道进入肺泡,经血液循环运至全身。血液中的金属汞进入脑组织后,被氧化成汞离子,逐渐在脑组织中积累,达到一定的量时,就会对脑组织造成损害。另外一部分汞离子转移到肾脏。
因此,慢性汞中毒临床表现主要是神经系统症状,如头痛、头晕、肢体麻木和疼痛、肌肉震颤、运动失调等。易兴奋是慢性汞中毒的一种特殊的精神状态,表现为易激动、口吃、胆怯、焦虑、不安、思想不集中、记忆力减退、精神压抑等。此外胃肠道、泌尿系统、皮肤、眼睛均可出现一系列症状。急性汞中毒其症候为肝炎、肾炎、蛋白尿、血尿和尿毒症。金属汞被消化道吸收甚微,一般不会引起中毒。
三、镉(Cd)
镉位于元素周期表的第八副族,第五周期;在元素周期表中,镉与锌是同族元素。在天然矿物中,镉与锌、铅、铜、锰等元素共生、主要以硫化镉和碳酸镉的形式存在于锌矿中。锌矿一般都含镉0.1%~0.5%左右,有的甚至高达2%~5%。因此在锌等金属冶炼过程中,就有镉化物排出,造成污染。
镉不是人体的必需元素。镉的毒性很大,可在人体内蓄积,主要蓄积在肾脏,引起泌尿系统的功能变化。水中镉0.1mg/L时,可轻度抑制地表水的自净作用。镉对白鲢鱼的安全浓度为0.014mg/L。用含镉0.04mg/L的水进行灌溉时,土壤和稻米受到明显污染;农灌水中含镉0.007mg/L时,即可造成污染。日本的痛痛病即镉污染所致,我国也有受镉污染稻米的报道。镉是我国实施排放污染总量控制的指标之一。
绝大多数淡水含镉量低于1μg/L,海水中镉的平均浓度为0.15μg/L。镉的主要来源有电镀、采矿、冶炼、染料、电池和化学工业等排放的废水。
土壤中镉的浓度一般约为0.4ppm左右,受镐污染的土壤中含镉量可高达几十个ppm。
同其他重金属污染物一样,水溶性的镉在土壤环境中的行为受土壤pH值和氧化还原电位等因素的制约。在不同的pH值和氧化还原电位的条件下,镉的溶解度是不断地变化的。一般水溶性镉的溶解度随土壤悬浮液中的氧化还原电位的增大而增加,并且随pH值的降低而相应地增加。镉的这种行为,可能是由于在低氧化还原电位的条件下生成硫化镉沉淀物所引起的。
土壤悬浮液中氧化还原电位的高低不仅影响镉等重金属的溶解度,而且还影响到植物对镉的吸收。例如,当土壤中的氧化还原电位在+200~+400毫伏和pH值在5~8的条件下,总的说来,水稻的总镉吸收情况是随氧化还原电位的增大和pH值的减小而相应地增加。镉在水稻中是很容易迁移的。如果镉被水稻的根组织吸收,镉能很快地从根部迁移到幼苗。水稻吸收的镉大部分积累在幼苗中,这可能是由于水溶性的镉容易随水分移动的缘故。
镉在地壳中的丰度为0.2ppm左右,海水中镉的丰度约为0.11ppb。在大部分地面水体中,镉的浓度约为1微克/升。某些地方的自来水也含有镉,甚至达到几十个ppb水平,这是由自来水管道含有的镉污染引起。
镉同汞和铬一样,在水体中的迁移转化行为依赖于水体的pH值,胶体颗粒物对镉化物的吸附作用,水体的氧化还原电位特性等因素的影响。如水体中镉化物浓度的变化,在很大程度上受水体中各种氧化物、碳酸盐、硫酸盐和硫化物的溶解度的制约。特别是镉的络合和螯合作用使镉化物溶于水中,提高了镉在水中的溶解度。此外,土壤微粒、各种氧化物和氢氧化物形成的胶体颗粒物以及有机物腐植酸,都对水体中的镉化物有很强的吸附作用。显示出三氧化二铝(Al2O3)与二氧化硅(SiO2)对镉的吸附状态。
当水体的pH降到一定范围时,三氧化二铝和二氧化硅对镉呈负吸收状态,这表明,被这些氧化物吸附的镉在降低水体pH值的情况下,解吸而重新溶解到水体中。
水体中的有机物腐植酸对镉的吸附作用随着水体pH值的增加而加强,腐植酸对镉的吸附能力与含有羧基的合成吸附剂的吸附能力相似。
镉在水体中的状态分布也受水环境氧化还原电位的影响。如吸附在沉积物表面的镉化物,随着水体氧化性增强,会逐渐解吸而释放在水体中,从而增加了水体中镉的浓度。与此相反,如果水体的还原性增强,则有利于沉积物对镉的吸附。
1.镉的应用与毒性。的毒性很强,而且很容易在人和动物的肾脏、动脉和肝脏内积聚,严重危害健康,甚至导致死亡。镉是一种毒性很大的重金属,其化合物也大都属毒性物质。镉用途很广,镉盐、镉蒸灯、颜料、烟雾弹、合金、电镀、焊药、标准电池、冶金去氧剂、原子反应堆的中子收棒等,都要用到镉。如颜料镉红即为硫化镉、硒化镉和硫酸钡组成;镉黄为硫化镉与硫酸钡组成。
镉在自然界中相当稀少,常伴生于硫化铅、锌矿特别是闪锌矿(ZnS)之中。金属矿的开采和冶炼、电镀、颜料等是镉的主要人为污染源。粗磷肥中含镉可达100毫克/公斤、普钙含镉可达50~170毫克/公斤;汽车废气中也有镉。资料表明,交通频繁的公路两旁土壤和草的含镉量,近处明显高于远处。烟草中也含有一定量的镉。
2.镉污染的来源。大气中镉的污染主要来自锌冶炼厂的废气。煤和燃料油的燃烧也是大气污染的来源。煤中含镉量1~2ppm,柴油、燃料油含镉0.1~0.5ppm。镉尘由于自然沉降和雨水的冲刷而降到地面,并富集于土壤中。
水中镉的污染来源主要是含镉工业废水,其次是含镉矿碴的污染。污染地区地下水镉含量可高达0.2~3mg/L,日本神通川河水中含镉量为0.5~0.7mg/L。我国某些地区的河水也发现有镉的污染。
土壤镉污染主要有三种类型即气型污染,水型污染(通过污水灌溉农田)和肥料污染。
镉在土壤中具有一些特点。在相同的pH条件下,镉比锌、铅、铜的溶解度大。土壤对镉有很强的吸附力,特别是粘土和有机质多的土壤吸附镉的能力较强,容易造成镉的富积,而且多蓄积于土壤表层。同时,作物也对镉有较强的富集能力,而且在上述重金属中,土壤中镉的污染溶纳量最小。这些都为产生有毒的“镉米”创造了有利条件。
3.镉对人体健康的危害。镉化物是毒性很大的物质。水中含镉浓度达0.2~1.1毫克/升时,就可使鱼类死亡;即使饮水中镉浓度低至0.1毫克/升,也能在人体组织内积累,并导致疾病。我国规定,在工业车间排水口,镉及其无机化合物的最高容许排放浓度不得大于0.1毫克/升,而且不得以稀释方法代替必要的处理。
1944年前后,在日本富山县神通川流域发现一种奇怪的“疼痛病”,后来患病的人逐渐增多。患者多为老年妇女,病状惨不忍睹。起初,患者开始腰痛、下肢肌肉痛,继则浑身骨节疼痛,稍受碰撞或咳嗽打喷嚏就可导致骨折,甚至呼-吸都剧痛不已,到后来骨骼严重变形,在剧痛中悲惨致死。起初有人认为这可能是铅中毒引起,后来又认为是风湿病、骨软化、重金属慢性中毒症等。直到1968年,日本才确认“骨痛病”是镉中毒引起的一种公害病。
镉主要通过饮水和食物摄入人体。在日本富山县骨痛病病区,井水中含镐0.001ppm,河水中含镉0.001~0.009ppm,河流底质中含镉在0.16~5.0ppm范围。患病的妇女每日经消化道摄入的食品含镉达0.6毫克,从饮水摄入的镉达1~1.4毫克。镉也可经吸入而摄入人体,并且吸入后的吸收比食入后的吸收大得多,吸入的毒性比经口摄入的毒性大约60倍之多。
从这点看,应当注意职业性的防护。此外,香烟也是人体摄入镐的重要途径。每支香烟含镉在1微克以上,有的高达30微克,据估计,每天吸20支烟的人吸入镉约14~16微克,而一般人经饮水摄入的镉量在0~20微克,因而吸烟的摄入量不可忽略。
在生产中,吸入大量镉尘或镉蒸气后,会引起急性中毒,表现为口干、头痛、眩晕、呼吸道刺激引起急性肺炎、肺水肿等,死亡率达15%~20%。食入大量镉亦会引起中毒。
长期吸入低浓度的镉可导致慢性中毒。镉被吸入后,在肺细胞中沉积,然后通过血液进入肝和肾,引起肺气肿、肾功能损害、支气管炎、高血压、贫血等。镉的慢性中毒能在门牙和犬齿的根部出现黄色的“镉环”。经口长期摄入,也可在体内蓄积,引起中毒。上述的日本发生的“骨痛病”就是长期食入含镉的米与饮用含镉的水逐渐蓄积的结果,其潜伏期达10~30年。
此外,还发现镉有致癌、致畸和致突变作用。有调查发现,生产镉电池的工人易发生前列腺癌。有人指出,肾癌与接触镉密切相关。动物实验证实,氯化镉可引起大鼠胎仔的畸变。对骨痛病患者进行的研究亦表明,镉能引起人的染色体畸变。这些研究表明,镉除能引起骨痛病一类的慢性中毒症外,对人类还有更大的潜在性的危害。
四、铬(Cr)
铬位于元素周期表的第四周期,第六副族;是地壳元素之一,占地壳总量的0.02%,广泛地存在于土壤、大气、水和动植物体内。密度为7.20g·cm-3,熔点为2176K,沸点为2945K,电离能为6.76eV。铬有四种稳定的同位素:53 Cr,4.355%;54Cr,83.779%;51Cr,9.501%和53Cr,2.365%。此外,铬能产生5种放射性同位素,但只有51 Cr的半衰期为27.8天,并广泛应用于生命科学中作为示踪原子;其他几种放射性同位素的半衰期都小于1天。铬在自然界的行为受氧化还原作用的制约较大。自然界中的铬主要有两种价态,其中正三价最稳定。
在自然界中,氧化环境和还原环境的交界线具有重要的地球化学意义。由于这里的氧化还原电位发生剧变,使铬在环境中的行为也发生剧变,在这些地方常可形成铬的富集地带。如有六价铬的电镀废水排入富含有机污染物的水中时,,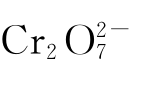 便被。迅速地还原为Cr(Ⅲ)而被吸附生成沉淀因而不能迁移。
便被。迅速地还原为Cr(Ⅲ)而被吸附生成沉淀因而不能迁移。
铬是生物体所必需的微量元素之一。铬的毒性与其存在价态有关,通常认为六价铬的毒性比三价铬高100倍,六价铬更易为人体吸收而且在人体内蓄积,导致肝癌。因此我国已把六价铬规定为实施总量控制的指标之一。但即使是六价铬,不同化合物的毒性也不相同。当水中六价铬浓度为1mg/L时,水呈淡黄色并有涩味;三价铬浓度为1mg/L时,水的浊度明显增加,三价铬化合物对鱼的毒性比六价铬大。
铬的污染来源主要是含铬矿石的加工、金属表面处理、皮革鞣制、印染等行业。
1.铬的化学性质。
(1)铬的氧化还原性。铬原子的基态电子构型为[Ar]3d54s1,原子中的6个价电子都可以参加成键,从-2到+6的氧化态都有,但是,最常见的氧化态是0、+2、+3和+6。Cr(Ⅱ)离子是强还原剂。在空气中,二价铬相当不稳定,能迅速地氧化成三价铬,因此,Cr(Ⅱ)在生物体内极少可能存在。不过,也有人认为生物体内含有大量还原能力较强的有机化合物,在这种环境中有可能使得微量Cr(Ⅱ)在体内存在,并有可能在体内生成Cr(Ⅱ)的中间产物,它对具有生物活性的Cr(Ⅲ)配合物有催化作用。
六价铬离子具有较高的正电荷和较小的半径(52pm),因此,不论在晶体中还是在溶液中都不存在简单的Cr(Ⅵ)离子,而总是以酸根阴离子的形式存在。其中,六价铬主要是与氧结合成铬酸盐(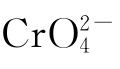 )或重铬酸盐
)或重铬酸盐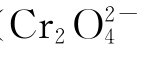 ),是一个很强的氧化剂。在酸性溶液中,这些离子很容易还原到Cr(Ⅲ)。
),是一个很强的氧化剂。在酸性溶液中,这些离子很容易还原到Cr(Ⅲ)。
三价铬是最稳定的氧化态,也是生物体内最常见的一种。但是,Cr(Ⅲ)在碱性溶液中却有较强的还原性,较易被氧化。
(2)铬的配位化合物。三价铬形成配位化合物的能力很强,并且所形成的配位化合物中,最主要的是六配位的化合物,其单核配位化合物的空间构型为八面体,Cr(Ⅲ)离子提供6个空轨道,形成6个d2sp3杂化轨道。Cr(Ⅲ)配位的化合物是常见的,它可形成配阴离子或配阳离子或中性配合分子。在水溶液中,这些配合物具有相对动力学惰性的特征。例如,在配体取代反应中,反应的半衰期仅在几小时范围内。因此,铬不可能处于酶的活性部位作为金属酶的催化中心,因为在酶的活性部位交换的速度必须迅速,所以,象这样的相对动力学惰性的铬配合物只可能作为结构成分来发挥作用。例如,在酶或者在蛋白质或核酸的三级结构中,键合的配体以适当的排列取向起催化作用。
在水溶液中,Cr(Ⅲ)和H2O配位形成正八面体的六配位水合离子,即[Cr(H2O)6]3+。这种六配位的水合离子也存在于盐(如[Cr(H2O)6]Cl3)以及矾(如说MCr(SO4)2·12H2O)中,其中的M为锂以外的所有一价阳离子。
在生物组织中,中性pH值时,铬的水合配合物会发生水解,降低酸度,其结果会通过羟桥合作用形成桥,产生多核的铬配位化合物,最后沉积下来,变成生物学上的惰性物种。如果加入强碱,同时加热到120℃,羟桥合作用增强。强配位体(例如草酸根离子)能预防甚至逆转羟桥合作用;但是,较弱的配位体只能预防反应发生。在生物体内,铬能起作用是由于它能与较弱的有机配体或无机配体结合,形成易溶解的配合物。铬化合物与其他配体如硫氰酸根或氨基之间,也可能形成桥。例如,现有研究中已发现下列天然存在的配体:焦磷酸、蛋氨酸、丝氨酸、甘氨酸、亮氨酸、赖氨酸和脯氨酸,在生理条件下,它们抑制Cr(Ⅲ)的羟桥合作用。
2.铬的应用与毒性。所有铬化合物浓度过高时都有毒性,但各种铬化合物毒性的强弱不同。金属铬很不活泼,二价铬化合物一般认为是无毒的。三价铬进入人体过多时,可对人体健康带来危害,但三价铬的毒性较小,而六价铬毒性较大。
铬酸盐毒性大,由于溶解度大且易被迅速吸收,对生物组织有刺激性和毒性。Cr(Ⅲ)也有毒害作用。铬对人的毒害主要是偶然吸入极限量的铬酸或铬酸盐后,引起肾脏、肝脏、神经系统和血液的广泛病变,导致死亡。
在日常生活中,铬一般与其他元素混合制成合金来使用。
3.铬污染的来源。铬的污染源主要是铬铁冶炼、耐火材料、电镀、制革、颜料、化工等生产及燃料燃烧排放的含铬废气、废水、废渣。三价铬对胎儿有致畸作用、六价铬是强致突变物质,有致癌作用,含铬化合物对皮肤和粘膜有局部作用可引起皮炎、鼻中隔穿孔等。
五、砷(As)
元素砷位于元素周期表的第四周期,第五主族,与碳为同族。在地壳中的含量不大,在自然界中主要以硫化物和氧化物的形式存在。主要矿物有雄黄As2S2、雌黄As2S3、砒石(亦称砒黄)As2O3、毒砂(即砷黄铁矿)Fe-AsS。砷是一个类金属的非金属元素,具有金属光泽。它有三种同素异形体:黄砷、黑砷和灰砷。黄砷由砷蒸气骤冷而得,不稳定,密度为2.026g·cm-3。黑砷是加热砷化氢而制得,密度4.7g·cm-3。灰砷能稳定存在,有金属性,密度5.727g·cm-3。三种同素异形体物理性质有所差别,但化学性质却完全相同。单质砷的熔点1090K(2.8MPa下),889K时升华。密度5.78g·cm-3,砷蒸气的分子是As4,为正四面体结构。把含砷的矿物投进水中,会出现白色的烟,带有大蒜的气味,人们接触到它就会受到伤害,这就是三氧化二砷As2O3,即砒霜。
砷的硫化物矿自古以来被用作颜料和医药,如古代罗马人称砷的硫化物矿为“金黄色的颜料”,我国的炼丹家则把雄黄、雌黄、砒黄和硫黄称为四黄,视为炼丹的必备药剂。
砷是人体非必需元素,元素砷的毒性较低而砷的化合物均有剧毒,三价砷化合物比五价砷化合物毒性更强,且有机砷对人体和生物都有剧毒。砷通过呼吸道、消化道和骨骼、肌肉等部位,特别是在毛发、指甲中蓄积,从而引起慢性砷中毒,潜伏期可长达几年甚至几十年。慢性砷中毒有消化系统症状、神经系统症状和皮肤病变等。砷还有致癌作用,能引起皮肤癌。在一般情况下,土壤、水、空气、植物和人体都含有微量的砷,对人体不会构成危害。砷是我国实施排放总量控制的指标之一。
地表水中含砷量因水源和地理条件不同而有很大差异。淡水为0.2~230μg/L,平均为0.5μg/L,海水为3.7μg/L。砷污染主要来源于采矿、冶金、化工、化学制药、农药生产、纺织、玻璃、制革等部门的工业废水。
1.砷的化学性质。
(1)砷能生成氧化数为-3、+3和+5的化合物。-3和+3的化合物具有还原性,+5的化合物有氧化性。
(2)常温下砷不与水和空气作用,也不与稀酸作用,但与热的浓硫酸、硝酸和王水反应:
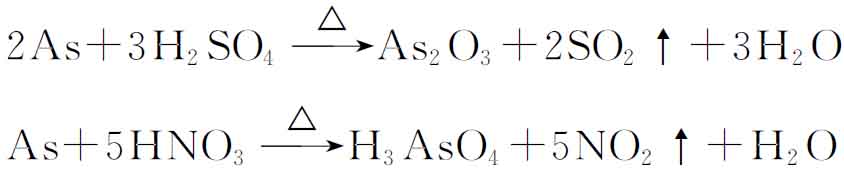
(3)砷为两性元素,能与碱作用生成亚砷酸盐:
![]()
(4)高温时砷能与O2、S、X2等许多非金属直接作用,生成As2O3、As2S3、AsX3或AsF5等。
(5)砷能与绝大多数金属生成合金和化合物,如与碱金属生成M3As(M=Li、Na、K、Rb、Cs)型化合物,与镓生成半导体材料——砷化镓GaAs。
2.砷的制备方法。
(1)硫化物矿先煅烧成氧化物,然后用碳还原:
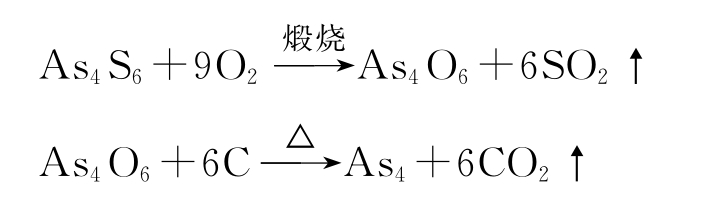
(2)砷硫铁矿FeAsS直接煅烧:
![]()
(3)以铁粉为还原剂,还原硫化砷成单质砷:
2As2S36Fe─→+6FeS+As4
3.砷的应用与毒性。
砷化物多用于制造硬质合金(如铅弹中加的35%砷)、砷酸盐药物、杀虫剂、杀鼠剂(一般为砷酸、亚砷酸盐类)、玻璃工业脱色剂、毛皮工业的脱毛剂和防腐剂。所以冶金、硫酸、化肥、皮革、农药等工业均有砷污染。
砷可以通过呼吸、皮肤接触、饮食等途径进入人体。砷能与蛋白质和酶中的巯基结合,抑制体内很多生化过程,特别是与丙酮酸氧化酶的巯基结合,使其失去活性,引起细胞代谢的严重紊乱。砷对人的中毒剂量为0.01~0.052克,致死量为0.06~0.2克。砷的急性中毒症状是:咽喉、食道及胃肠烧灼感,腹泻、腹痛、头痛、恶心、呕吐、口喝、面部发绀、血压迅速降低,病情严重时可迅速死亡。
砷中毒作用也是积累性的,能蓄积于骨质疏松部、肾、肝、脾、肌肉和角化组织(如头发、皮肤及指甲)。近年来还发现,与含砷物质经常接触的工人中,皮肤癌和肺癌的发病率锭高于其他行业;而皮肤溃疡、鼻中隔穿孔更为常见。
4.砷污染来源。
由于砷的广泛应用,造成环境中砷的积累和污染。砷污染的主要来源于开采、焙烧、冶炼含砷矿石以及生产含砷产品过程中产生的含砷三废,还有其他在使用砷的过程中造成的污染。可以肯定地说,凡是存在或使用砷的地方,都会成为砷的污染源,最常见的污染来自于工农业生产。
5.砷污染的危害。
砷元素(As)及其化合物广泛存在于环境中。元素形态的砷,因其不溶于水,因此几乎没有毒性。有毒性的主要是砷的化合物其中三氧化二砷(As2O3)即砒霜是剧毒物。
一般情况下,土壤、水、空气、植物和人体都含有微量的砷。环境中的砷化合物不超过人体负荷时不会对人体健康构成危害,但如果人体对砷的化合物的摄入量超过排泄量,如饮用水含砷量较高,长期饮用,则会引起慢性中毒。煤炭中含砷量过高,因烧煤造成污染而使人慢性中毒的事例在国内都有。
砷及其化合物进入人体,蓄积于肝、肾、肺、骨骼等部位,特别是在毛发、指甲中贮存,砷在体内的毒作用主要是与细胞中的酶系统结合,使许多酶的生物作用受到抑制失去活性,造成代谢障碍。
长期摄入低剂量的砷,经过十几年甚至几十年的体内蓄积才发病。砷慢性中毒主要表现为末梢神经炎和神经衰弱症候群的症状,皮肤色素高度沉着和皮肤高度角化、发生龟裂性溃疡是砷中毒的另一个特点。急性砷中毒多见于消化道摄入,主要表现为剧烈腹痛、腹泻、恶心、呕吐。抢救不及时可造成死亡。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。















