第二节 化学的负面作用
正如马克思的辩证法所指出的那样,任何事物都有其两面性。化学在为人类作贡献的同时,也给人类带来了许多危害,比如重金属污染、酸雨、温室效应,光化学烟雾等等。这些引起了全世界的广泛关注。接下来,我们来了解一下化学对环境的污染。
一、水污染
地球上大约有13.9亿立方千米的水,其中约97.2%为海洋水,2.15%是以冰山与冰川形式存在的固态水,人们可以利用的淡水只约占0.65%。人类就是依靠这些水来保持生命与从事生产的。在这些天然水中含有钾离子、钠离子、钙离子、镁离子、氯离子、硫酸根离子、碳酸氢根离子、碳酸根离子等离子。如果使不属于水体的物质进入水体,而且进入的数量已经达到破坏水体原有用途的程度,就叫水污染。
造成水污染的原因是多方面的。根据污染源可分为城市生活废水污染、工业废水污染、农田流水污染(喷洒的农药、施用的化肥被雨水冲刷流入水体)、固体废物污染(工业废渣中的有毒物质,经过水溶解后进入水体)及工业烟尘废气污染(烟尘废气落入水体或被雨水淋洗流入水体)等。
污染水体的物质一般可分为以下几类:
1.无机污染物包括酸、碱、无机盐等。
2.有机污染物包括碳水化合物、脂肪、蛋白质、碳氢化合物、合成洗涤剂等。
3.有毒物质包括重金属(铅、铬、汞、镉等)盐类、氰化物、氟化物、砷化物、酚类、多环芳烃、多氯联苯、有机农药等。
4.致病微生物包括各种病毒、细菌、原生物等。
5.耗氧污染物有些有机物与无机物,能消耗水中溶解的氧气,使水发黑变臭,危害水生生物的生存。
6.植物营养物质有些物质中含有植物生长所需要的氮、磷、钾等营养元素(如含磷洗衣粉、化肥、饲料等),这些物质能促使水中藻类疯长,从而消耗水中的氧气,危害鱼类的生长,造成水质恶化。
此外,还有石油工业带来的油污染、热电厂造成的热污染、核电厂带来的放射性污染等,不仅污染水体,危及水生动物,还会危害人体健康。
二、大气污染
1.臭氧层的破坏及危害
臭氧是大气中普遍存在的氧化剂,其分子式为O3,它在对流层中平均浓度1.7×10-9mol/L。在汽车、燃煤电厂、石油化工厂等排气中含有氮氧化物,并可由其通过进一步光化学过程产生臭氧,随后又容易导致光化学烟雾的发生。除此之外,对流层中臭氧还来源于以下几个方面:①从平流层扩散而下;②工程电器与民用电器设施高压放电;③自然界雷雨时节闪电等过程中,大气中部分氧气转为臭氧;④森林地区空气中含少量二氧化氮、甲醛、萜烯等,由光化学反应生成臭氧;⑤化学工业中将臭氧作为强氧化剂,以代替高温氧化、催化氧化。也可作为纤维织物的漂白剂、脱臭剂,或作水处理净化剂等。在应用过程中可能有部分臭氧散逸到大气中去。
对流层大气中的臭氧又是主要地通过均相光化学反应与非均相氧化反应消除。和臭氧层中情况相同,均相光化学反应包括氯氧化物、氮氧化物与氢氧化物环式反应。此外,如下式所示的气相反应也是对流层中臭氧的主要消耗过程:
O3+H2O(g)+hv─→O2+2HO
非均相反应是空气中臭氧先溶于水,然后再氧化S(Ⅳ)与氮氧化物的反应,其氧化速率和大气中臭氧浓度成正比。估计通过非均相反应消除的量约为臭氧汇总量的1/3。
臭氧是最强的氧化剂之一,液态的臭氧量深蓝紫色。臭氧分子O3呈三角形,键角为116.8°,键长127.8pm。臭氧的分子结构型式和二氧化硫分子类同。在臭氧分子中没有单电子,所以分子是反磁性的
大气臭氧层的损耗是当前世界上又一个普遍关注的全球性大气环境问题,它直接关系到生物圈的安危与人类的生存。
1984年,英国科学家首次发现南极上空出现臭氧层空洞。1985年,美国的“雨云-7号”气象卫星也测到了这个臭氧洞。以后经数年的连续观测,进一步得到证实。据NASA报道,NASA的“Nimbus-7”卫星上的总臭氧测定记录数据显示,近年来,南极上空的臭氧洞有恶化的趋势。现今不仅在南极,在北极上空也出现了臭氧减少现象。NASA与欧洲臭氧层联合调查组分别进行的测定都显示了这一点。
对于大气臭氧层破坏的原因,科学家中间有多种见解。但是大多数人认为,人类过多地使用氯氟烃类化学物质(用CFCl表示)是破坏臭氧层的主要原因。
由于臭氧层中臭氧的减少,照射到地面的太阳光紫外线增强,其中波长为240~329nm的紫外线对生物细胞具有很强的杀伤作用,对生物圈中的生态系统与各种生物,包括人类,都会产生不利的影响。臭氧层破坏以后,人体直接暴露于紫外辐射的机会大大增加,这将给人体健康带来不少麻烦。
首先,紫外辐射增强使患呼吸系统传染病的人增加;受到过多的紫外线照射还会增加皮肤癌与白内障的发病率。此外,强烈的紫外辐射促使皮肤老化。臭氧层破坏对植物产生难以确定的影响。近几十年来,人们对200多个品种的植物进行了增加紫外照射的实验,其中2/3的植物表现出敏感性。一般说来,紫外辐射增加使植物的叶片变小,因而减少俘获阳光的有效面积,对光合作用产生影响。对大豆的研究初步结果显示,紫外辐射会使其更易受杂草与病虫害的损害。臭氧层厚度减少25%,可使大豆减产20%~25%。紫外辐射的增加对水生生态系统也有潜在的危险。紫外线的增强还会使城市内的烟雾加剧,使橡胶、塑料等有机材料加速老化,使油漆褪色等。
经反复研究臭氧层被破坏主要归纳为因为有以下几种物质,氯氟烷烃(CFCs)、3种哈龙、40种含氢氯氟烷烃(HCFCs)、34种含氢溴氟烷烃(HBFCs)、四氯化碳(CCl4)、甲基氯仿(CH3CCl3)与甲基溴(CH3Br)为控制使用的消耗臭氧层物质,也称受控物质。
氯氟烷烃(CFCs)。此类化合物自1928年人类首次合成后被以多种方式使用,冰箱、空调制冷剂、气雾剂制品中的推进剂(CFCl、CFC12)、生产靠垫与垫子的软发泡剂、印刷线路板与其他设备的清洗剂等。
含氢氯氟烷烃(HCFCl)。此类物质是氯氟烷烃的一种过渡性替代品,HCFC因为含有H,使得它在底层大气易于分解,对臭氧层的破坏能力低于氯氟烷烃,但长期与大量使用对臭氧层危害也很大。
在工程与生产中作为溶剂的四氯化碳(CCl4)与甲基氯仿(CH3CCl3)同样具有很大的破坏臭氧层的潜值,所以也被列为受控物质。
溴氟烷烃主要是哈龙,哈龙1211(CF2BrCl)、哈龙1310(CF3Br)、哈龙2420(C2F4Br2),这些物质一般用作特殊场合的灭火剂。此类物质对臭氧层最具破坏性,比氯氟烷烃高3~10倍,1994年发达国家已经停止这三种哈龙的生产。
近年来,主要用于土壤熏蒸与检疫的另一种破坏臭氧层的含溴化合物即甲基溴(CH3Br)引起了人们的重视,它也被列为受控物质。
臭氧层中的臭氧是在离地面较高的大气层中自然形成的,其形成的机理是:
O2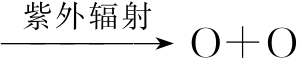 (高层大气中的氧气受阳光紫外辐射变成游离的氧原子)
(高层大气中的氧气受阳光紫外辐射变成游离的氧原子)
O2+O─→O3(有些游离的氧原子又和氧气结合就生成了臭氧,大气中90%的臭氧是以这种方式形成的)
臭氧是不稳定分子,来自太阳的紫外辐射既能生成臭氧,也能使臭氧分解,产生O2分子与游离O原子,因此大气中臭氧的浓度取决于其生成和分解速度的动态平衡。
人为消耗臭氧层的物质主要是广泛用于冰箱与空调制冷、泡沫塑料发泡以及电子器件清洗的氯氟烷烃(CFCs)以及用于特殊场合灭火的溴氟烷烃(Halons哈龙)等化学物质。这些物质被称为消耗臭氧层物质,国际社会为了保护臭氧层,将这些物质列入淘汰或受控制使用的名单中,因此也称这些物质为“受控物质”。
受控物质在大气的对流层中是十分稳定的,可以停留很长时间。以氟利昂-11为例,它在对流层中寿命长达120年左右,因此这类物质有足够的时间扩散到大气的各个部位,但是到了平流层后,就会被太阳的紫外辐射分解,释放出活性很强的游离氯原子或溴原子,参与导致臭氧损耗的一系列化学反应即游离的氯原子或溴原子和臭氧分子反应,产生氯或溴的一氧化物,夺走臭氧分子的一个氧原子,使之变成氧分子。氯或溴的一氧化物和游离的氧原子反应,释放“夺来”的氧原子,形成更多的氧分子与游离氯原子或游离溴原子,新的游离氯原子或溴原子重新和其他臭氧分子反应,再度生成O2分子与氯或溴的一氧化物,这样的反应循环不断,每个游离氯原子或溴原子可以破坏约10万个臭氧分子,这就是氯氟烷烃或溴氟烷烃破坏臭氧层的原因。
破坏臭氧层的过程可表示如下:
含氯或含溴的化合物─→太阳紫外辐射─→游离Cl(或Br)
O3+Cl(或Br)─→ClO(或BrO)+O2
ClO(或BrO)+O─→游离Cl(或Br)+O2
2.二氧化碳和温室效应
近百年来,随着生产迅速发展,煤、石油、天然气的消耗量惊人地增长,它们燃烧后生成大量的二氧化碳;由于自然灾害与人为的乱砍滥伐,地球上能吸收二氧化碳的森林却减少了。这样致使空气中二氧化碳的含量呈上升趋势。
大气圈内的二氧化碳等物质,像温室的玻璃或塑料薄膜那样,能使地面吸收太阳光而转化来的热能不易散失,从而提高地球表面的平均气温。这种现象叫“温室效应”。
有些科学家认为,温室效应引起地球气候变暖会对人类生存环境产生重大影响。例如有人认为,气温上升会使南北极冰川与其他地区冰雪融化,海平面上升,淹没沿海低洼地区;有些地区将热得无法居住;地面水分更多地被蒸发到大气中,会使一些富饶的土地变成沙漠。
对温室效应及其长期影响还需要人们进一步研究。当前,必须采取积极的措施减少其危害,如保护森林资源、植树造林,寻找利用二氧化碳的新途径,开发新能源等。
3.光化学烟雾污染
光化学烟雾属于次生污染物,作为其发生源的氮氧化物,它们的环境化学行为不再详述,在此介绍光化学烟雾的另一个重要发生源,即反应性烃类污染物。
空气中存在的污染性碳氢化合物,主要是那些包括甲烷、乙烷、乙烯、乙炔在内的气体状化合物。另外也有一些吸附在固态颗粒上的化合物,如具有致癌作用的苯并芘类化合物。此外,在森林大气中含有大量的萜烯类化合物。
城市空气中烃类的天然来源主要是各类有机物的微生物分解,而人为污染源包括①在各类工厂与企业中对溶剂与其他化学试剂进行加工、贮存、销售与应用;②汽车内燃机中汽油不完全燃烧;③各种废物燃烧等。据估计,进入大气的各种烃类总量的1/3是反应性的,其中有约50%反应性烃来源于汽油燃烧。
以下阐述烃类的反应性与烃类在形成光化学烟雾中的作用这两个问题。
(1)烃类的反应性
相关方面的知识可通过以下两种途径获取:①在实验室建立一套烟雾反应器装置,向其中引入空气、氮氧化物、HC,然后用紫外光辐照,测定各反应产物浓度随时间变化的曲线;②预想各种可能发生的反应过程,基于各反应的速度常数,借助计算机算出各种反应产物的浓度。根据这类实验或计算,可以推算出光化学反应的反应机理以及不同种类烃与自由基在反应中的相对重要性,并归结出各种烃类的相对反应性强弱。以下几个方面可作为判定烃类实际反应性强弱的依据:①被判定对象烃的浓度降低速率;②将一氧化氮转换为二氧化氮的能力;③光化学氧化剂(主要是臭氧)生成速率;④所生成烟雾对眼睛的刺激强度;⑤所生成烟雾对植物损害能力。
现今,人们已对各种烃类光化学反应性的相对强弱有了某些规律性的了解。其递减顺序为:带双取代基的内烯>环戊烯>带单取代基的内烯>内烯或者环己烯>三或四烷基苯,以及双键在端处的烯烃>单烷基苯>丙烷>苯>乙烷>甲烷。
(2)烃类在形成光化学烟雾中的作用
以反丁烯为例,其双键被大气中自由羟基攻击而引发光化学反应,随后在和氧、一氧化氮等发生反应的情况下,最终生成了一氧化碳、二氧化碳、二氧化氮、乙醛、硝酸甲酯(CH3ONO2)、过氧化乙酰硝酸酯(CH3COO2 NO2)。其中反应机理十分复杂,可能包含200个以上反应。
光化学反应中的氧化剂主要包括臭氧、PANs、二氧化氮、双氧水、硝酸等。它们都是光化学烟雾的构成物。
三、居室空气污染
多数人以多数时间生活在室内。居室空气中污染物组成与浓度取决于以下三方面因素:①污染源在室内还是室外;②污染源强度随时间(昼夜)变化情况;③室内外空气流通或交换程度。
室内与室外的光照情况有显著差异。室外是天然的太阳光照;室内采光基本上有三种光源:①太阳光,透过玻璃窗进入室内的阳光受玻璃吸收反射后,除去了具有光化学活性的紫外光部分;②白炽灯,主要是黄光部分,只含有很弱的紫外线;③荧光灯,含线光谱与连续光谱,有较强的紫外辐射。
室内与室外情况的另一差异是,室内陈设物件多,单位空间所占比表面积大,所以室内空气中所含气体、颗粒物有相对较大的干沉积量。这有利于空气净化,但对室内油漆件、金属器件乃至人肺的侵蚀作用也较大。
居室空气污染是多方面的,常见的有以下几个方面:
(1)吸烟易引发肺癌已是不争的事实。由于烟草种植过程中施用含放射性铀的磷肥,经过植物摄取的铀可富集在烟叶中。进入人肺中的铀产生长年累月的内照射,从而损伤组织。烟叶中还含有一种名为烟碱(尼古丁)的剧毒生物碱,可对中枢神经与植物神经系统产生先兴奋后抑制的作用,对人体极为有害。烟叶燃烧后又能产生多量CO与多种多环芳烃等化合物,它们都是有毒的或是致癌的居室污染物。除此之外,长期吸烟者抗病能力弱,易患心脏疾病及诸如哮喘、支气管炎、肺气肿等慢性疾病。被动吸烟者(特别是孩童)尤能引起心与肺的疾患。此外,由室内烹饪产生高浓度油烟中含大量脂肪酸热解产物(醛、丁二烯等)是非吸烟人群肺癌发生的重要因素。
(2)居室空气中含氡也是引起肺癌与白血病的危险因素之一。氡是铀的衰变子体,在水中有一定溶解度,所以凡屋基(土层或岩石,特别是花岗岩中含较多量铀)、房屋建筑材料及井水都可能是氡污染源。近期还发现靠高压线而建的住宅内氡含量较高,这是因为高压输电线产生强大电场可使氡分子带上静电,更容易附着在窗帘、衣服与家具上,使人体曝露于过量放射性氡气的氛围中。
(3)粘附在尘粒上的螨是常年性哮喘发作的过敏原。尘螨是一种微小的蜘蛛类生物,以人体脱落的皮屑为食,温湿度适宜时大量繁衍。它的分泌物、排泄物、蜕皮等代谢产物是极强变应原,在室内积累到一定浓度时,患者短时接触就会发作哮喘。
(4)家用电器噪声。按国际标准,居室电器噪声应控制在42分贝,但现今我国家电产品噪声污染大多超标。如电视机为60~83分贝,洗衣机为50~80分贝。
(5)其他。如建筑绝缘材料中含石棉纤维,其缓慢释出会引生肺癌;木制家具中含甲醛会发生耳、鼻、咽喉疾病;煤气炉、热水器排气中含CO、氮氧化物,由此引起中毒死亡案例屡见不鲜;各类居室装璜材料(油漆、涂料、粘合剂、塑料墙纸)乃至服装、鞋料、化妆品等无不含有各种各样的化学类物质,释入空气后可通过呼吸、皮肤接触等途径进入人体,引起乏力、头昏、恶心、呕吐、鼻塞、精神恍惚等症状。
四、土壤污染
土壤作为人类生存环境不可缺少的一部分,在承载与繁衍人类的同时,也由于人类的活动受到空前规模的污染。污染土壤的物质很多,但按化学来分可以分为无机物污染,有机物污染。我们要着重介绍一下农药与重金属对土壤的污染。
土壤污染的发生特征主要是和土壤的特殊地位与功能相联系的。其主要污染源有如下四个方面:①为了提高农产品的数量与质量,大量施用化肥与农药,它们的残留物在土壤中累积起来;②土壤历来就作为废物(废渣、污水与垃圾等)的处理场所,而使大量有机与无机污染物质随之进入土壤;③土壤是环境要素之一,因大气或水体中的污染物质的迁移、转化,从而进入土壤,使土壤随之亦遭受污染;④在自然界中某些元素的富集中心或矿床周围,往往形成自然扩散晕,使附近土壤中这些元素的含量超出一般土壤的含量范围。
土壤中的污染物质和大气与水体中的污染物质很多是相同的,其污染物主要种类有①有机物质,其中数量较大而又比较重要的是化学农药。化学农药的种类繁多,主要分为有机氯与有机磷两大类;②氮素与磷素化学肥料;③重金属,如砷、镉、汞、铬、铜、锌、铅等;④放射性元素如铯、锶等;⑤有害微生物类如肠细菌、炭疽杆菌、破伤风杆菌、肠寄生虫(蠕虫)、霍乱弧菌、结核杆菌等。此外,土壤中有机物分解产生二氧化碳、甲烷、硫化氢、氢气、氨气与氮气等气体(其中二氧化碳与甲烷是主要的),在某些条件下,这些气态物质也可能成为土壤的污染物。
对土壤的化学污染物作归纳,主要是有机物、无机盐类、重金属类与农药。其中一般有机物容易在土壤中发生生物降解,无机盐类易被植物吸收或淋溶流失,两者在土壤中滞留时间较短。因此重金属类与农药类化合物成为土壤的主要化学性污染物。重金属中的汞、镉、砷、铅、铬等进入土壤后可以被作物吸收积累,间接危害人畜健康,同时也可使土壤中野生动物受害或转入水体危及鱼类。至于不合理地施用化学农药,在现今已引起人们的高度重视。如归属于多氯联苯(PCB)、多环芳烃(PAN)类的有机氯农药,由于化学性质稳定,不易为土壤微生物所降解,所以在土壤中残留时间很长,被作物吸收后,再经各种生物之间转移、浓缩与积累,可使农药的残毒直接危害人体的健康。
1.农药在土壤中的环境行为
控制农药环境行为的主要因素有三,即吸附、迁移与降解。通过吸附过程,将使农药滞留在土壤中,减轻了因挥发引起大气污染与因淋溶引起地下水污染的程度;通过挥发、淋溶、径流及作物吸收等迁移过程,会促使农药转移到其他环境要素中去;通过降解过程,农药在土壤中逐渐转为小分子或简单分子化合物,乃至彻底无机化,转成为二氧化碳、水等。农药的残留性又是上述这些过程的集中体现。从维持药效,药尽其用的角度看,农药应有相当的残留能力,但从无害化角度看问题,其在土壤中的滞留时间又不能太长。一些残留能力特别强的农药如汞、砷制剂已被淘汰使用,原因即在于此。
(1)吸附
土壤对农药的吸附是影响农药在土壤中动态行为的最重要因素之一。农药被吸附的能力主要和其分子本身性质有关,其他相关因素还有土壤的性质、类型以及介质条件。
农药中主要成分的分子结构、电荷特性与水溶能力是影响吸附的主要因素。一般,几何尺寸大、伸展平直又有柔性的分子可和土壤胶粒表面以较大面积接触,吸附力也大;一般情况下,凡具有—NHR、—OCOR、—NH2、—NHCOR、—OH、—CONH2、—R3N+官能团的分子都有较强的被吸附能力,且该能力按以上次序递增。其次,能离解为离子的农药被吸附力强,相对说来,极性分子电性较弱,被吸附能力也相应见弱;非离子型或中性分子可在电场作用下暂时极化,就此被吸附在带电荷的土壤胶粒上,但这种吸附力较弱。此外,正辛醇/水分配系数是分子疏水性指标,此值越大的农药其被吸附能力越强。
就土壤性质而言,影响吸附的主要因素是粘土矿物与有机质的含量、组成特征以及铝、硅氧化物与它们水合物的含量。这些物质或者经过由电荷特性,或者借助含O、N、S的官能团,或者凭借其巨大比表面积对农药分子进行吸附。土壤有机质与各种粘土矿物对非离子型农药吸附能力的顺序是:有机质>蛭石>蒙脱土>伊里石>绿泥石>高岭土。
说到介质条件,土壤溶液的pH值是影响吸附的最重要因素。土壤胶粒表面通常带有电荷,且按电荷发生缘由可分为两类。一类是永久性电荷,发生在铝硅酸盐表面,由同晶离子置换引起。另一类是pH制约性电荷,发生在腐植质或细菌体表面,即当介质pH值小于其等电点时,它们的表面带正电,否则带负电。又如粘土胶粒、铁与铝水合氧化物表面都带有氢氧根离子基团,根据介质pH值的大小也会如腐植质那样带上正电或负电,同属pH制约性电荷。由于上述土壤组分的等电点大多较低,在土壤溶液相对较高的pH值条件下,它们的胶粒表面大多带负电。因此在土壤溶液中易离解为阳离子的农药,具有较强的被吸附能力。
(2)迁移
一些农药的蒸气压(和挥发能力相关)、溶解度(和滞留在土壤溶液中的能力相关)及分配系数(和在气液两相间的扩散能力相关)。由此可见,不同农药的性质相差悬殊。表中分配系数D被定义为平衡时农药在土壤溶液与土壤空气间的浓度比。一般物质在气相中的扩散能力约是在液相中的104倍,所以当D>104时以液相扩散为主,当D<104时以气相扩散为主。西玛津与二溴乙烯分别是这两种情况的实例。
(3)降解
土壤中微生物的生命活动是农药降解的最主要因素。此外,包括蚯蚓在内的非脊椎动物对农药的代谢作用也是很重要的。还有些农药能在摄入植物体内后被代谢降解。农药生物降解的最终产物是二氧化碳与水,如分子中含S、N、P,还能生成硫酸盐、硝酸盐与磷酸盐。
试验显示,经过灭菌处理过的土壤中也会发生农药降解。这显示除生物降解外,还存在着诸如水解、氧化还原等化学降解作用。此外,在光照条件下,分布在土壤表面的很多农药都有可测得其降解速率的光分解作用。总之,土壤介质对于农药的纳污容量与自净能力都是很大的。
下面以DDT为例叙述农药降解的具体情况。DDT农药具有一定挥发、降解与分解的能力,但在一般的环境条件下,过程进行得很慢,很不显著。例如一般环境条件下,残留在土壤中的DDT95%分解需时约10年;经过试验,在90℃~95℃水相介质中,紫外光照条件下,使DDT彻底降解(即最终生成二氧化碳)其总量的75%需120小时。
土壤中某些微生物能较快分解DDT。在缺氧条件下(例如土壤灌溉后),而且温度较高时,这种分解进行得特别快。土壤中的二价铁盐与氯化铬还能加速DDT的还原分解。例如,当土壤中DDT含量为200mg/kg,有二价铁离子存在与温度为35℃时,在28天之内DDT几乎全部分解。
(4)残留性与危害性
农药污染土壤的程度可用残留性表示。各类农药在土壤中的半减期。由此可见,汞、砷制剂等农药几乎将永远残留环境之中,DDT等有机氯农药的残留期也是非常长久的。这些农药虽然早已被禁止使用,但在环境中的残留量还是非常可观。农药的半减期有很大的宽度范围,这表示决定农药在土中的残留能力除和其本身性质相关外,还取决于多种环境因素,如药剂用量、植被情况、土壤类型、酸度、土壤中水与有机质等的含量及微生物种类与数量等。
多数农药有很强脂溶性与很弱水溶性,可通过食物链在生物体中高度浓集。如DDT农药可使居于食物链末端的生物体内的蓄积浓度比最初环境所含农药浓度高出数百万倍,对机体造成危害。而人恰恰处在食物链末端,危险性也最大。在DDT农药所到之处,食物链上的鱼虾、禽、鸟也是十分危险的,常发生大批死亡的案例,因为这些小动物群体数量大,个体的致死剂量限值又很低的缘故。
DDT由苯环与三氯乙烷基团组成,苯环是其致毒部分;后者则是脂溶性部分,对昆虫外表皮中的几丁层有高度亲和力,能使DDT透过昆虫体壁而进入虫体,从而起到杀灭作用。
DDT不易为哺乳动物的富蛋白质的皮肤所吸收,对哺乳动物也无急性的毒杀作用,但能在动物体内积存。DDT进入人体后易贮积于副肾、睾丸、甲状腺等富有脂肪的器官,进而转入肝脏、肾脏,破坏它们的正常机能。人体内DDT的累积量达到20mg/kg时,神经系统发生障碍;达到500mg/kg时,能致人死命。
喷洒在蔬菜或水果表皮上的DDT,很容易渗入其蜡质层中,使食品中残留量有所提高。此外,DDT的毒杀范围确实非常广泛,因此对害虫的天敌如瓢虫、寄生蜂也能大量杀灭。扰乱了自然界中生物间的相互制约作用,破坏了生态平衡,导致了种种不良的后果。
2.土壤重金属污染
土壤无机污染物中以重金属比较突出。主要是由于重金属不能为土壤微生物所分解,而易于在土壤中积累,甚至在土壤中可能转化为毒性更大的甲基化合物。有的通过食物链以有害浓度在人体内蓄积,严重危害人体健康。
(1)土壤中重金属的源头和汇集
1988年的一份调查资料曾经指出,世界范围每年进入土壤的重金属量(万吨):Hg为0.83、Cd为2.2、Cr为89.6、Pb为79.6、Ni为32.5、Cu为95.4、Zn为137.2,还有准金属As为8.2、Se为4.1。近二十年来,每年进入土壤的重金属量还在不断增长。
重金属的土壤污染源多数出自于人们的生产与生活活动。如冶金、农药生产等工业废物、汽车排气及城市污水都可使土壤中污染物浓度提高到有毒水平,对生活在该土壤地区的草食动物首先产生危害。
进入土壤的重金属在日后的走向有多个方面:①吸附在土壤中,且可分为溶解与不溶两种状态;②被植物或其他生物吸收;③进入排水,随之离开土体;④因挥发进入大气。对重金属污染物在土壤中所发生的迁移及其在土壤固液两相间分配的主要控制过程是吸附,其主要控制因素是重金属本身的性质与土壤环境的性质。
(2)土壤对金属的吸附作用
土壤中无机或有机组分都可能选择性地或非选择性地吸附阳离子。非选择性阳离子吸附的主要机理是静电力的作用。
例如,土壤中层状铝硅酸盐组分就能非选择性地吸附碱金属与碱土金属的阳离子。这些离子被吸附的能力和很多因素相关。如果将被吸附阳离子的电荷看成点电荷,则价数越大者,受吸附力越大。如果各阳离子价态相同,则受吸附力和离子的结晶半径与水合半径相关。按库仑定律,离子结晶半径越大,相应水合半径越小,则受吸附力越大。土壤溶液中一些阳离子受吸附力按如下次序递减:铁离子、铝离子、氢离子、钡离子、锶离子、钙离子、镁离子、铯离子、铷离子、氨根离子、钾离子、钠离子、锂离子。半径小、水化能力弱、运动速度大的氢离子在土壤中受到很大吸附力。
有些阳离子能在土壤中发生结合力强得多的选择性(同晶或类晶)吸附,这种情况下,对象阳离子能穿透土壤组成物质原子的配位壳层,并进一步通过和O基团、OH基团间形成的共价键,和土壤组成物质的原子相键合。例如铝、铁、锰的水合氧化物与氢氧化物能选择性地吸附碱土金属离子(钡、钙、锶、镁)与重金属离子(铅、铜、锌、铬、镍、钒、镉、钴)。
如上所述,土壤胶粒的键合位置原先就被各种吸附着的阳离子所占据,当作为污染物的重金属离子进入土壤后,就只能通过取代性的离子交换作用而被土壤胶粒所吸附。可将原先被吸附于胶粒的阳离子分为两类。一类是被牢固吸附的不可交换性阳离子,如处于1∶1型粘土晶层之间的某些被吸附阳离子;另一类是被宽松吸附的可交换性阳离子,如处于胶粒表面或碎裂晶体边缘处的被吸附阳离子及被吸附于2∶1型粘土晶层间的阳离子。一般用阳离子交换容量(CEC)来表征土壤胶体交换外来阳离子的能力。土壤中主要反应性组分的近似CEC值及和之有关的表面特性。作为解说的一个例子,蒙脱土属于2∶1型粘土类,其电荷密度较小,硅层间接合不牢固,因而层间距大,外来离子容易扩散进入而发生交换吸附,所以有较大的CEC值。
土壤对重金属阳离子的吸附能力按以下次序递降:Pb>Cu>Zn>Cd>Ni,Hg在序列中的位置依实验条件而异。对于呈阴离子状态的金属而言,Pb、Cu被吸附能力较强而Cr、As较弱。
(3)Hg、Cd、Cr在土壤中的环境行为
Hg(0-Ⅰ-Ⅱ)与Cd(Ⅱ)在土壤颗粒中滞留能力很弱,很容易在土壤中发生迁移并为植物所汲取,所以具有很大的潜在危险性。Cd2+的主要污染源是工业排放废水。从排放标准来看,进入土壤的Cd量是不多的,但从高度溶解性与强毒性来看,它又是十分危险的。汞在土壤中主要以Hg(Ⅱ)形态存在,和Cd(Ⅱ)比较,它在土壤中滞留能力略大,这是因为Hg(OH)2具有很小溶解度的缘故。但Hg(Ⅱ)在土壤中也有可能被还原为Hg(Ⅰ)与Hg(0)。Hg(0)是挥发性的,可在土壤颗粒空隙扩散,从这个意义上说,汞在土壤中具有较大的迁移能力。一般说来,在土壤条件下生成甲基汞的情况是罕见的。
Cr(Ⅵ)在土壤中一般呈阴离子形态存在,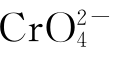 是强氧化剂,高浓度下易被还原,但在较高pH值与较低浓度(10-7mol/L)条件下,这种形态在土壤中还是相当稳定的。而且在好氧与中等偏高pH值的土壤条件下有一定迁移能力。
是强氧化剂,高浓度下易被还原,但在较高pH值与较低浓度(10-7mol/L)条件下,这种形态在土壤中还是相当稳定的。而且在好氧与中等偏高pH值的土壤条件下有一定迁移能力。
Cd、Hg、Cr等重金属在土壤环境中的归宿决定了它们具有很大的残留与危害性。但进入土壤毕竟比进入大气与水体的情况要好一些,因为在土壤介质中它们一般呈毒性较小的化学形态,也较容易被土壤颗粒滞留与从食物链中除去。例如这类金属在土壤中浓度增大1倍,则经过植物吸收后,在植物体中的浓度会增加。
正是由于化学的负面作用及人类的活动使当前环境的负荷严重超标;使化学面临着严峻的挑战,而且环境保护也成为当今世界各国人民共同关心的重大的社会经济问题,也是科学技术领域里重大的研究课题。环境科学是在现代社会经济与科学发展过程中形成的一门综合性科学。就世界范围来说,环境科学成为一门科学还是近二三十年的事情。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。

















