二、对称性规律
大家知道,金属半径大,电子受核的吸引小,易失电子,化合价显正价,显还原性,显碱性。相反,非金属半径小,化合价显负价,显氧化性,显酸性。层数越多,半径越大,电子受核的束缚小,电子受核的吸引大,易得电子,不易失电子,还原性增强,碱性增强,不易得电子,氧化性减弱,酸性减弱,因而,以下性质的变化只需判断元素是金属元素还是非金属元素,最终只需看元素的偏旁,即为汉字规律。另外,所有性质的变化以氟、钫为对角线对称,也称对称性规律。具体见附图20。

(一)原子与离子半径(具体见附图12)
1.原子半径随着原子序数呈周期性变化,总趋势是变大。
2.同周期元素半径进行比较,金属元素的半径>惰性元素的半径>非金属元素的半径。

3.阳离子半径总要比相应的原子半径小。阴离子半径总要比相应的原子半径大。
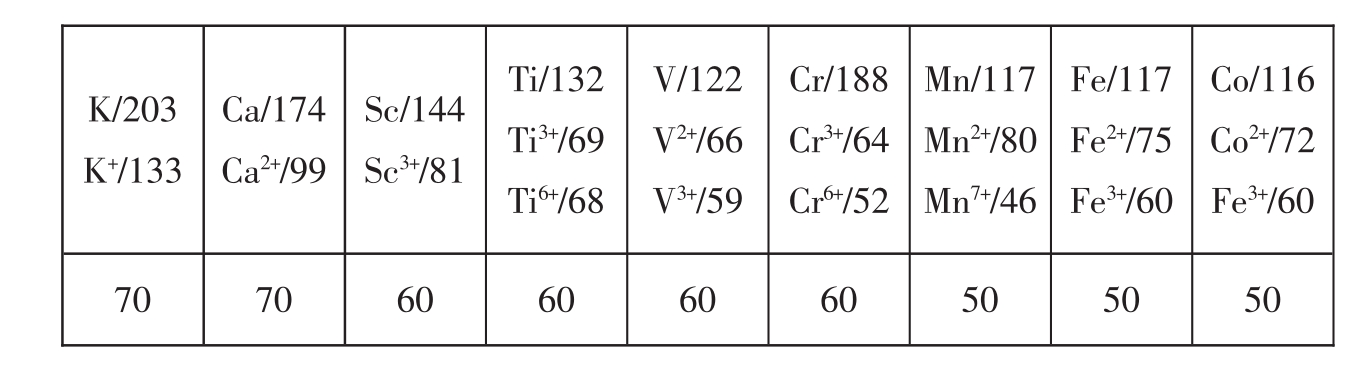
4.同一主族元素的原子半径自上而下逐渐增大。
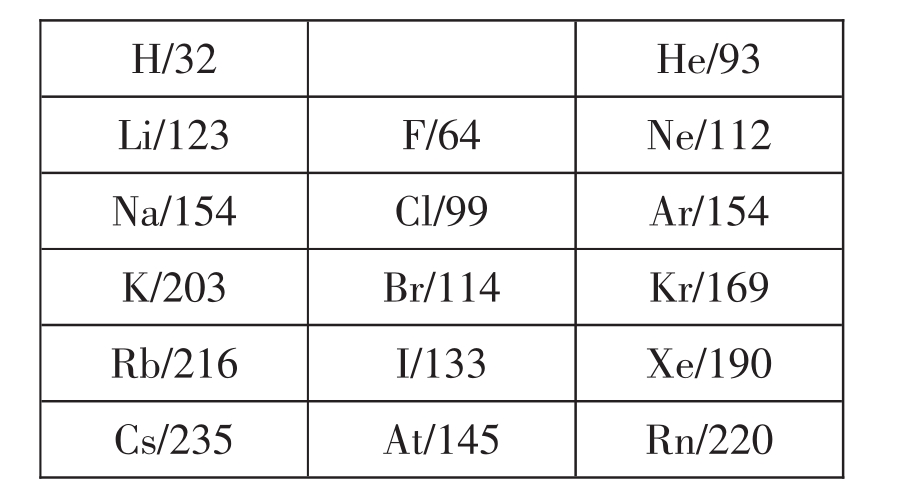

5.同一周期元素的原子半径自左而右逐渐减小。减小幅度先快(10~30pm)后慢(0~10pm),最后突然增大50~80pm。
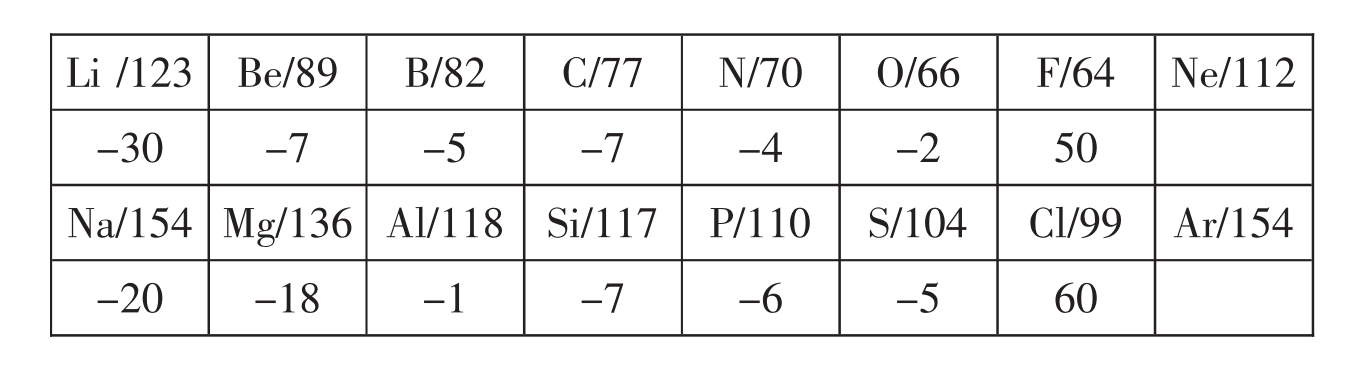
6.增加一个电子,若增加在同层,原子半径减小0~30pm;若增加在外层,原子半径增大100pm;若增加在外层,与惰性元素相比较,原子半径增大30~50pm。
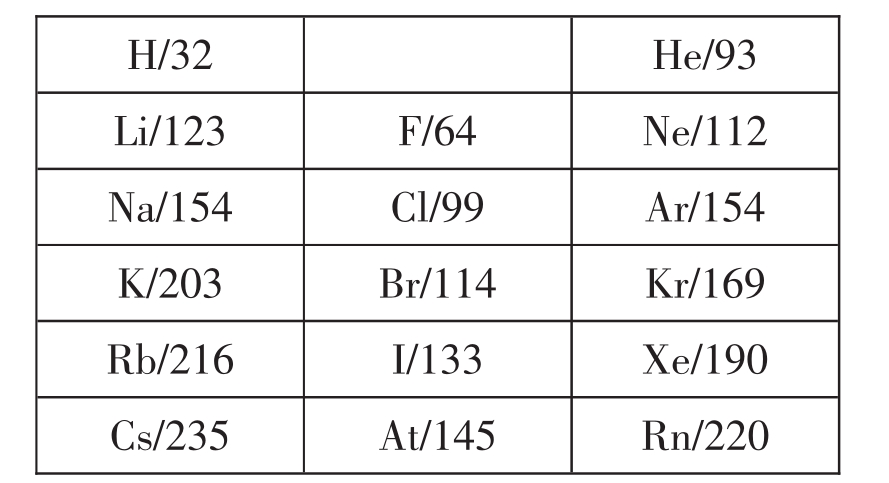
7.主族元素的原子半径都存在对角线规律,对角线下端的原子半径大于对角线上端。
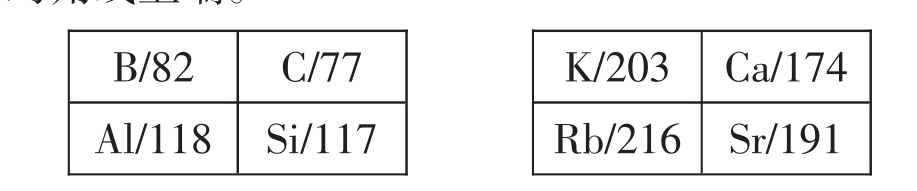
8.副族元素的原子半径上下或左右变化都比较小,与主族变化相似,但在IB和IIB处突然变大。

9.f区元素的原子半径左右变化总的趋势是变小,但是都比较小,甚至未变化。

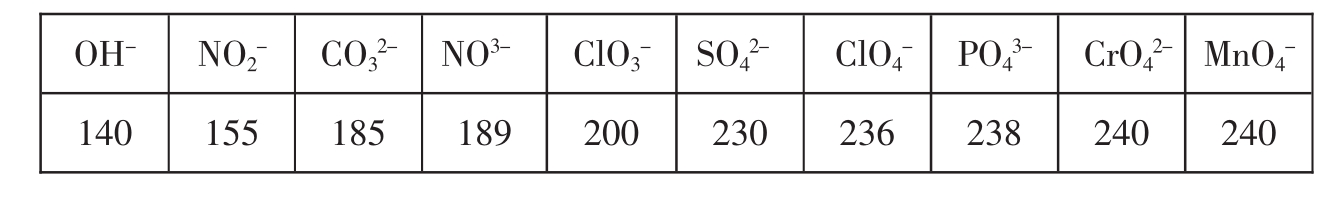
10.原子团的半径变化随着氧原子个数的增大而增大。
11.原子半径应该变小而变大的特殊元素。
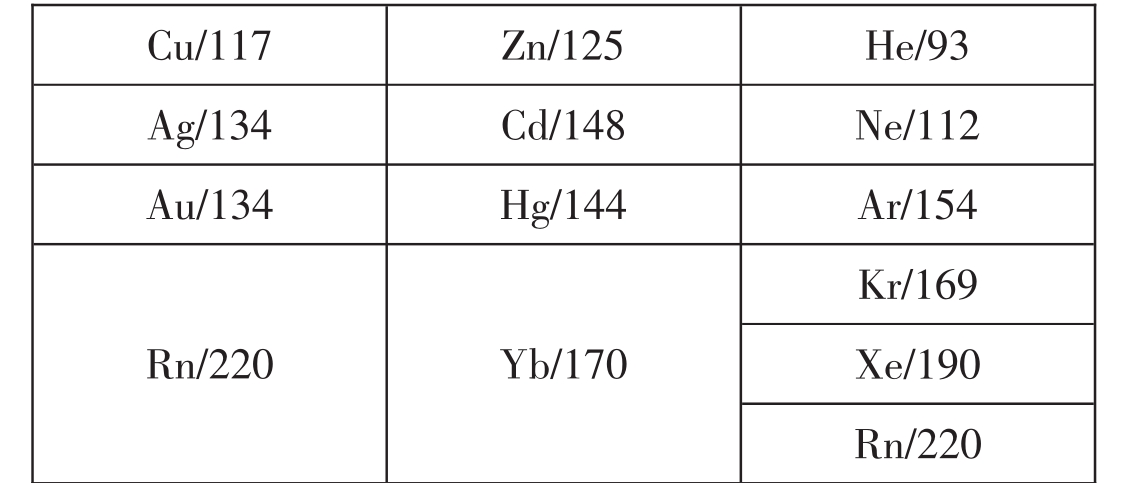
12.原子半径在主族元素与副族元素交界处,变化复杂。
(二)电负性

3.电离势

(四)亲合势

(五)氢化物、氧化物与水化物的酸碱性
1.酸性与碱性是相反的,金属元素一般显碱性,而非金属元素一般显酸性。
2.氢化物
同主族元素氢化物的酸性自上而下逐渐增强;同周期元素氢化物的酸性自左而右逐渐增强。
3.水化物
同主族元素同种化合价(第二、第三高价)的含氧酸的酸性自上而下逐渐减弱,碱性逐渐增强。
同周期元素最高价的含氧酸的酸性自左而右逐渐增强,碱性逐渐减弱。
同种元素不同化合价的含氧酸的酸性随着化合价的升高而增强。
强酸:活泼非金属的高价含氧酸。
中强酸:活泼非金属的亚价含氧酸,砷和磷的高价含氧酸。
弱酸:不活泼的非金属的含氧酸,活泼非金属的低价含氧酸。
4.氧化物
氧化物的酸碱性与其对应的水化物酸碱性一致。
(六)氧化还原性
1.最高价只有氧化性,最低价只有还原性,中间价既有氧化性又有还原性。
2.同种元素不同价态,价态升高,氧化性增强。
3.物质的氧化性与还原性始终相反;氧化性在酸性介质中强于碱性介质中。
4.越靠近金属,半径增大,还原性(金属性、失电子能力、碱性)增强,氧化性(非金属性、得电子能力、酸性)减弱。
5.对角线上左上端靠近非金属,右下端靠近金属,氧化性左上端强于右下端,还原性左上端弱于右下端。
6.电极电势越大氧化性越强,越小还原性越强。(具体见附图4与11。)
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。















