一、 实验目的
(1) 掌握PHS-3B型p H计的使用。
(2) 通过实验加深理解电位测定法测定水溶液p H值的基本原理。
(3) 学会校验p H电极的性能。
(4) 了解用标准缓冲液定位的意义。
二、 实验原理
p H是表示溶液酸度的标志, 定义为氢离子活度的负对数, 即
用电位分析法测量溶液的p H值, 是以玻璃电极作指示电极(-), 以饱和甘汞电极作参比电极(+), 组成测量电池, 电池示意如图2-9所示。
图2-9 电池示意
电池的电动势等于各相界电位的代数和, 即
E试液=(ε1-ε2)+(ε2-ε3)+(ε3-ε4)+(ε4-ε5)+(ε5-ε6) (2-19)
电池的电动势与氢离子的活度α1、α2有关:
在式(2-20)中,φSCE、φAg-Ag Cl分别为外参比电极和内参比电极的电位,φa为不对称电位,φj为试液与饱和氯化钾溶液之间的液接电位。假定在测定过程中,φa和φj不变,φSCE、φAg-Ag Cl和玻璃电极内充液的氢离子的活度α2的值一定,都可以合并为常数项,则电池的电动势可表示为:
在式(2-21)中, 常数项在一定条件下虽为定值, 但却不能通过准确测试或计算得到,所以在实际测量时, 要先用已知的p H标准缓冲液来定位, 然后在相同条件下测量溶液的p H值, 即选用p H值已经确定的标准缓冲液进行比较而得到待测溶液的p H值。
25℃时,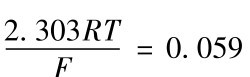 , 式(2-22)简化为式(2-23):
, 式(2-22)简化为式(2-23):
E试液=常数+0.059p H试液(2-23)
在式(2-23)中,0.059为玻璃电极在25℃时的理论响应斜率。
因为测试条件(如温度、电极等)相同, 将式(2-21)、 式(2-22)相减时, 常数项被消去, 因此水溶液的p H值通常被定义为其溶液所测电动势与标准溶液的电动势差有关的函数, 其关系式可表示为式(2-24):
该式常称为p H值的实用定义。可见,p H测量是相对的,每次测量的p H试液都是通过与其p H值相近的标准缓冲液进行对比得到的,测量结果的准确度首先取决于标准缓冲液p H标准的准确度。标准缓冲液是一种稀水溶液,离子强度应小于0.1mol·kg-1,具有较强的缓冲能力, 容易制备, 稳定性好。 常用的几种标准缓冲液的p H值见表2-3。
表2-3 p H测定常用的标准缓冲液
显然, 标准缓冲液的p H值是否准确可靠, 是准确测量p H值的关键。 目前, 我国所建立的p H标准溶液体系有7个缓冲液, 它们在0℃~95℃的标准p H值可查阅相关文献。
测定p H值的仪器——p H电位计是按上述原理设计制成的。 例如在25℃时, p H计设计为单位p H变化59m V。 若p H玻璃电极在实际测量中响应斜率不符合59m V的理论值, 这时仍用一个标准p H缓冲液校准p H计, 就会因电极响应斜率与仪器不一致引入测量误差。为了提高测量的准确度, 需用双标准p H缓冲液法将p H计的单位p H的电位变化与电极的电位变化校为一致。
当用双标准p H缓冲液法时, 电位计的单位p H变化率S可校定为式(2-25):
在式(2-25)中, p H(s,1)和p H(s,2)分别为标准p H缓冲液1和2的p H值, E(s,1)和E(s,2)分别为其电动势。 由此可得式(2-26):
这消除了电极响应斜率与仪器原设计值不一致所引入的误差。
25℃时, 溶液的p H值变化1个单位时, 电池的电动势改变59.0m V。 实际测量中, 选用p H值与水样p H值接近的标准缓冲液, 校正p H计(又叫定位), 并保持溶液温度恒定,以减少由于液接电位、 不对称电位及温度等变化而引起的误差。 测定水样之前, 用两种不同p H值的缓冲液校正, 如用一种p H值的缓冲液定位后, 在测定相差约3个p H单位的另一种缓冲液的p H值时, 误差应在±0.1p H之内。
校正后的p H计, 可以直接测定水样或溶液的p H值。
由于p H玻璃电极的内阻比较高(约108Ω), 因此要求p H计有较高的输入阻抗(>1012Ω),这才能保证一定的测量精度。质量好的p H计测量E的精度达±0.1m V,测量p H值的精度可达±0.002p H。
三、 仪器与试剂
1. 仪器
(1) PHS-3B型精密数字式p H计;
(2) E201复合式p H电极;
(3) 电磁搅拌器;
(4) 洗瓶1只;
(5) 50m L小烧杯4只。
2. 试剂
(1) 饱和酒石酸氢钾(25℃时p H值为3.56);
(2) 0.05mol·L-1邻苯二甲酸氢钾溶液(25℃时p H值为4.00):
称取130℃时干燥的邻苯二甲酸氢钾10.21g, 用蒸馏水溶解, 并稀释到1L;
(3) 0.025mol·L-1磷酸二氢钾溶液和0.025mol·L-1磷酸氢二钠缓冲液(25℃时p H值为6.86):
称取在110℃~130℃干燥过2h的KH2PO43.40g及Na2HPO4·12H2O8.95g,用不含CO2的蒸馏水溶解,稀释至1L;
(4) 0.01mol·L-1硼酸钠溶液(25℃时p H值为9.18):
称取3.81g Na2B4O7·10H2O,溶解于不含CO2的蒸馏水中,并稀释到1L,防止溶液接触空气;
(5) 饱和氯化钾溶液;
(6) 广泛p H试纸;
(7) 3种未知p H值的溶液。
四、 实验步骤
1. 准备
(1) 接通电源, 使仪器预热15min。
(2) 安装电极: 把电极夹在复合电极杆上, 然后将电极的插头插在主机相应的插口内紧圈, 电极插头应保持清洁干燥。
(3) 将仪器的功能开关置于“p H”挡。
(4) 将温度补偿电位器调在被测溶液的温度上。
(5) 将斜率电位器顺时针旋到底。
2.p H玻璃电极的校验
一只良好的p H玻璃电极的电位应与溶液的p H值呈直线关系, 但电极膜的制作及长期使用引起的老化或损伤, 往往会影响上述线性关系, 故在测试前应予以校验。
(1) 将p H计置于“p H”挡, 将温度调节至室温, 将电极插入溶液中, 拔去测量电极的插头, 用定位调节旋钮调节标准溶液的p H值为该温度下的p H值。
(2) 将功能开关置于“m V”挡, 按前法接好复合式电极。
(3) 将电极插入溶液中, 拔去测量电极的插头, 仪器显示值应为“000”, 插上电极插头, 稳定后, 所显示的数值即溶液的电极电位。
(4) 分别测量配好的各标准溶液的毫伏值。
①用温度计测量标准缓冲液的温度, 调节温度调节器, 使其所指示的温度刻度为所测得的温度。 打开电极套管, 用蒸馏水洗涤电极头部, 用吸水纸仔细将电极头部吸干, 将复合电极放入50m L左右的混合磷酸盐的标准缓冲液中, 使溶液淹没电极头部的玻璃球, 轻轻摇匀, 以促使电极平衡, 待读数稳定后, 调节定位旋钮, 使显示值为该溶液在室温时的标准p H值。
②将电极取出, 用蒸馏水清洗电极, 并用滤纸吸干电极外壁的水分。 用温度计测量邻苯二甲酸氢钾标准缓冲液的温度, 调节温度调节器, 使其所指示的温度刻度为所测得的温度。用邻苯二甲酸氢钾标准缓冲液荡洗三遍, 放入50m L左右的邻苯二甲酸氢钾标准缓冲液中,摇匀, 使电极平衡, 使显示值为该溶液在室温时的标准p H值。
③观察室温, 查附录求得该温度下相隔单位p H时的毫伏值, 计算两种缓冲液的Δp H,并与直接测得的两溶液的Δp H比较, 若两者的差值≤0.02p H, 则认为仪器的电极均正常。
3. 测量p H值
测量前用p H试纸初测未知样的p H值。 用温度计测量试液温度, 并将温度调节器置于此温度位置。 测量时试液体积为50m L左右。
1) 单标准p H缓冲液法测量溶液的p H值
这种方法适合一般要求, 即待测溶液的p H值与标准缓冲液的p H值之差小于3个p H单位。
(1) 选用仪器的 “p H” 挡, 将清洗干净的电极浸入待测标准p H缓冲液中, 按下测量按钮, 待数字显示稳定后, 调节定位调节旋钮, 使仪器显示的p H值稳定在该标准缓冲液p H值上。
(2) 松开测量按钮, 取出电极, 用蒸馏水冲洗几次, 小心用滤纸吸去电极上溶液。
(3) 将电极置于欲测试液中, 按下测量按钮, 读取稳定的p H值, 记录。 平行测定两次, 并记录。
(4) 升起电极架, 用蒸馏水冲洗电极后, 用滤纸吸干电极表面的水分, 再插入待测未知溶液中, 稳定后, 所显示的数值即待测溶液的p H值。
2) 双标准p H缓冲液法测量溶液的p H值
为了获得高精确度的p H值, 通常用两个标准p H缓冲液定位校正仪器, 并且要求未知溶液的p H值尽可能落在这两个标准溶液的p H值之间。
(1) 按单标准p H缓冲液法的步骤 (1)、 (2), 选择两个标准缓冲液, 用其中一个对仪器定位。
(2) 将电极置于另一个标准缓冲液中, 调节斜率旋钮 (如果没设斜率旋钮, 可使用温度补偿旋钮调节), 使仪器显示的p H值读数至该标准缓冲液的p H值。
(3) 松开测量按钮, 取出电极, 冲洗, 用滤纸沾干水分后, 再放入第一次测量的标准缓冲液中, 按下测量按钮, 若其读数与该试液的p H值相差至多不超过0.05p H单位, 这表明仪器和p H玻璃电极的响应特性均良好。 往往要反复测量、 调节几次, 才能使测量系统达到最佳状态。
(4) 当测量系统调定后, 将洗干净的电极置于欲测试样溶液中, 按下测量按钮, 读取稳定的p H值, 记录。 平行测定两次, 并记录。
(5) 升起电极架, 用蒸馏水冲洗电极后, 用滤纸吸干电极表面的水分, 再插入待测未知溶液中, 稳定后, 所显示的数值即待测溶液的p H值。
4. 实验结束工作
关闭p H计的电源开关, 拔出电源插头。 取出玻璃电极, 用蒸馏水清洗干净后泡在蒸馏水中。 取出甘汞电极, 用蒸馏水清洗, 再用滤纸吸干外壁的水分, 套上小胶帽存放于盒内。清洗烧杯, 晾干后妥善保存。 用干净抹布擦净工作台, 罩上仪器防尘罩, 填写仪器使用记录。
五、 注意事项
(1) 玻璃电极的敏感膜非常薄, 容易破碎损坏, 因此, 使用时应该注意勿与硬物碰撞,电极上所沾附的水分, 只能用滤纸轻轻吸干, 不得擦拭。
(2) 不能用于含有氟离子的溶液, 也不能用浓硫酸洗液、 浓酒精来洗涤电极, 否则会使电极表面脱水而失去功能。
(3) 测量极稀的酸或碱溶液(小于0.01mol∙L-1)的p H值时,为了保证电位计稳定工作, 需要加入惰性电解质(如KCl), 以提供足够的导电能力。
(4) 如果需要测量精确度高的p H值,为避免空气中CO2的影响,尤其在测量碱性溶液的p H值时, 要使待测溶液暴露于空气中的时间尽量短, 读数要尽可能快。
(5) 玻璃电极经长期使用后, 会逐渐降低及失去氢电极的功能, 这称为 “老化”。 当电极响应斜率低于52m V/p H时, 就不宜再使用。
思 考 题
1. 在测量溶液的p H值时, 为什么p H计要用标准p H缓冲液进行定位?
2.p H理论定义和实用定义各指什么?
3. 为什么用单标准p H缓冲液法测量溶液的p H值时, 应尽量选用p H值与它相近的标准缓冲液来校正p H计?
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。














