二、靶向基因病毒治疗的具体应用方案
(一)ZD55-gene系统
溶瘤腺病毒ONYX-015联合5-FU及顺铂治疗头颈部肿瘤患者取得了良好的效果,ONYX-015是Adv2和Adv5的嵌合体,其E1B55×103(55kD)基因被删除,并在E3区有部分碱基缺失。我们以5型腺病毒质粒pXC1为基础,通过定点突变双次PCR技术得到E1B55×103(55kD)基因缺失的新型溶瘤腺病毒载体,同时引入多克隆位点以便插入外源基因,命名为pZD55。pZD55与含有E3区的腺病毒大质粒pBHGE3在HEK293细胞中重组,得到的病毒称作ZD55。
ZD55与ONYX-015很相似,只能在p53基因突变或其信号转导途径异常的肿瘤细胞内复制,而不能在正常细胞内复制。ONYX-015很大的缺点是没有克隆位点用于插入外源抗癌基因,而ZD55则可以插入外源抗癌基因表达框,以增强ZD55的抗癌作用。利用ZD55携带抗癌基因构建成基因病毒ZD55-gene(图16-11)。
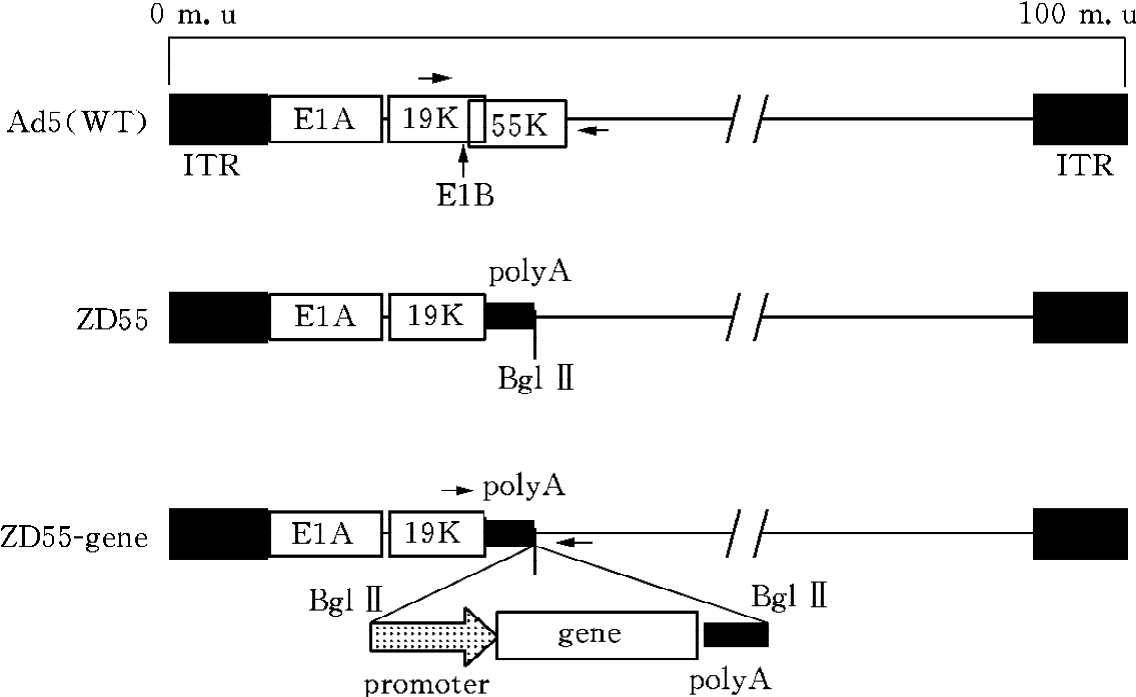
图16-11 ZD55-gene系统示意图
基因病毒ZD55-gene系统中的基因有以下特性:①表达产物能杀伤肿瘤;②表达产物若削弱病毒溶瘤作用采用适当的机制控制其表达。
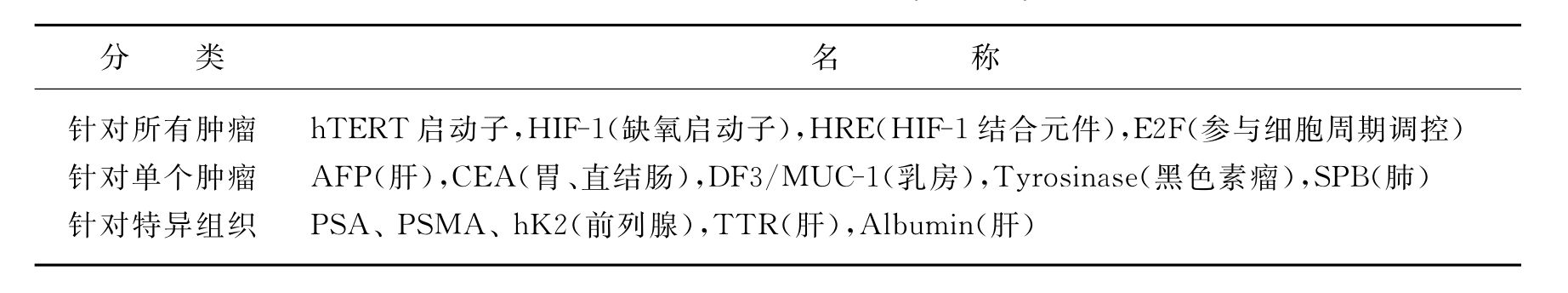
如表16-2所示,我们所用基因包括凋亡相关的基因Trail(TNF related apoptosis indu-cing ligand)和Smac(second mitochondria derived activator of caspase);自杀基因有CD和TK;抑制血管新生的基因有Endostatin和Angiostatin(plasminogen的Kringle1-4,简称K1-4;其类似物有K1-3和K5,它们抑制新生血管生成的能力为K5>K1-3>K1-4),以及sflt-1(可溶性VEGF受体)和VEGI(血管内皮细胞生长抑制因子);免疫调节基因有IL-12、IL-24和IFN-β;活性氧自由基的消除基因有锰超氧化物歧化酶(MnSOD)。这些ZD55的靶向基因病毒的体内外,抗癌效果均比单纯病毒ZD55或ONYX-015好。
表16-2 用于基因病毒治疗的治疗基因

(二)hTERT启动子调控腺病毒E1A方案
hTERT为人类端粒中维持端粒酶活性所必需的催化亚单位,在85%~90%肿瘤中表达水平都很高,正常细胞中则表达水平很低。E1A是腺病毒最重要的蛋白质,是控制腺病毒复制的关键,故用hTERT启动子调控E1A,可使整个腺病毒只能在肿瘤中复制并杀死肿瘤细胞,实现靶向杀伤肿瘤的作用,这个病毒我们命名为Ad-TERT(图16-12)。利用hTERT启动子调控E1A的腺病毒载体携带鼠源的endostatin基因构建成的基因病毒CNHK300-mE,对裸鼠移植瘤的生长有明显的抑制作用。
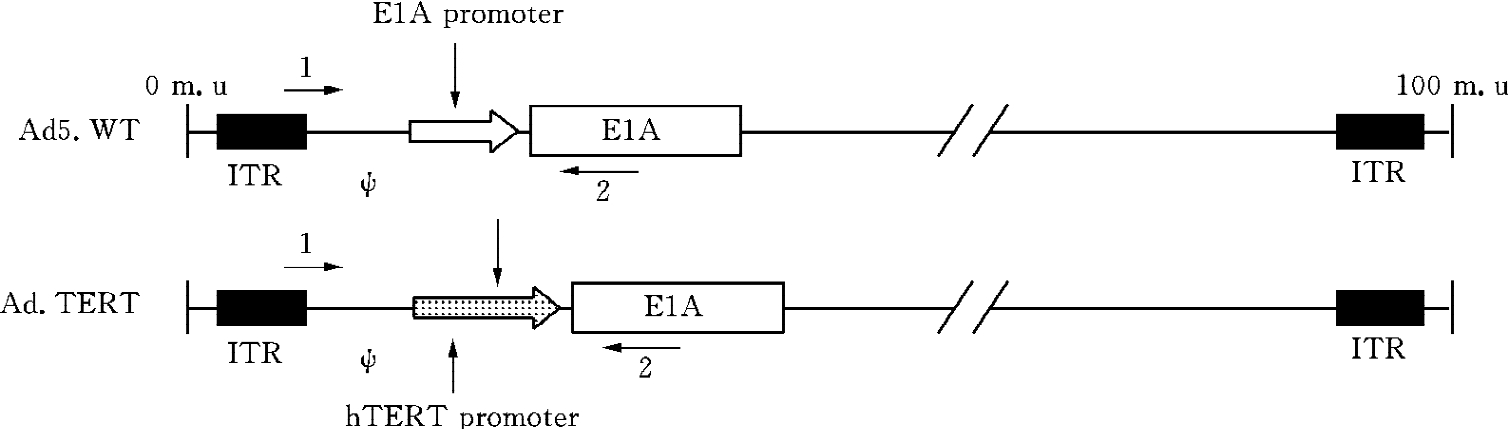
图16-12 hTERT启动子调控腺病毒E1A方案
(三)靶向双基因病毒治疗策略
有的靶向基因病毒治疗可将个别小鼠肿瘤全部杀灭,但不能将治疗组中所有小鼠肿瘤全部消灭。为了强化基因病毒治疗策略,提出了癌症的靶向双基因病毒治疗(targeting dual gene-virotherapy of 55-Smac、Ad-K5、ZD55-MnSOD以及ZD55-IL24相结合,结果治疗组中全部小鼠的移植性肿瘤均被杀灭。肝癌细胞(HCC)对Trail不敏感,这是因为肝癌细胞中含有较高抑制细胞凋亡的蛋白质(IAP),故Trail较难启动肝癌细胞的凋亡;而Smac能消除IAP的作用,使Trail能较好地诱导肝癌细胞的凋亡,Trail作用后又能诱导Smac的产生,故两者有协同效应,能把肿瘤全部消灭,此法有可能作为治疗IAP高表达的肿瘤。ZD55-Trail与Ad-K5结合,同样把SW620诱导的实体瘤(肠癌)全部杀灭。这是因为SW620对Trail敏感,能诱导其凋亡杀伤作用,而K5能抑制肿瘤血管的生成,两个基因从两个不同方面互补攻击肿瘤,能把100mm3左右的小鼠移植肿瘤全部杀灭。在靶向双基因病毒治疗策略中,只要选择适当的两个基因,就可以获得良好的抗癌效果。
(四)双靶向病毒双基因治疗
一个好的肿瘤靶向载体系统,应具有靶向全身的肿瘤细胞的能力,同时又要减少对正常细胞的潜在毒性。细胞和动物实验表明ZD55及Ad-TERT载体都有很好的肿瘤靶向性,而对正常细胞及实验动物的毒性很小。为此,我们用不同的肿瘤特异性启动子分别控制病毒复制所必需的不同基因,或与缺失病毒在正常细胞中复制所必须而在肿瘤细胞中复制不需要的病毒基因相结合,使病毒载体更特异地靶向肿瘤细胞。根据此概念,我们将ZD55与Ad-TERT两个靶向载体组合起来,构建成双靶向病毒载体(图16-13)。另外,根据双基因病毒治疗策略的经验,构建双靶向病毒双基因治疗载体。表16-2中各种基因可以选择,表16-3各种肿瘤特异性启动子(或元件)可以选择,如hTERT-HRE(缺氧诱导因子的结合元件)-Trail/Smac或-Trail/K5,hTERT-AFP-肝癌抑制基因/IL-24或hTERT-PSA-Trail/K5等等,这样将会有效果很好的药品用于肿瘤临床试验和治疗。
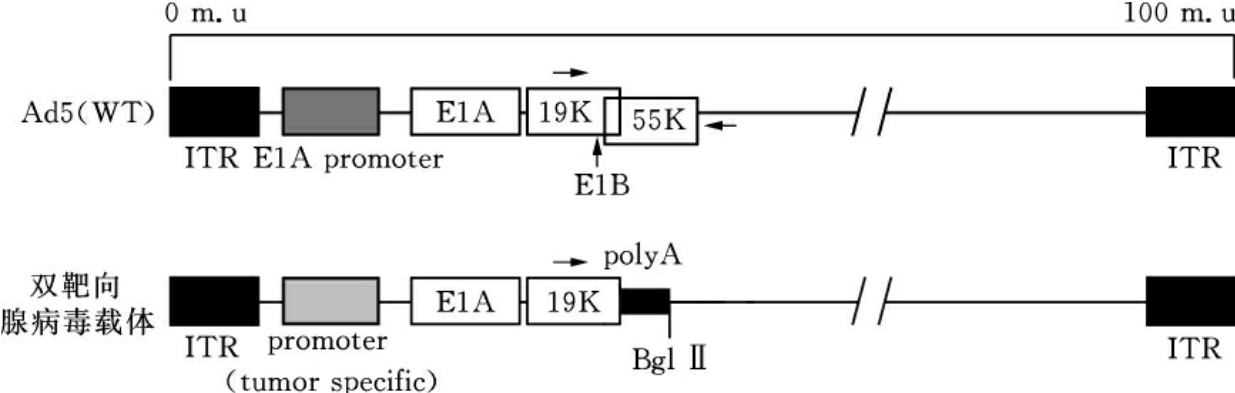
图16-13 双靶向腺病毒载体与野生型腺病毒结构差异示意图
表16-3 肿瘤特异性启动子(或元件)
(五)Gutless腺病毒系统
现在基因治疗所用的腺病毒载体大多是第1代腺病毒,缺失了腺病毒基因组的E1区和部分E3区,载体基因组表达产物仍有免疫原性,易被抗体清除而不能保持长期效果。第2代腺病毒载体缺失了E1区及部分的E2、E3、E4区,有更大的转载容量,但并未得到重视和应用。第3代腺病毒载体,被称作无肠(Gutless,GL)腺病毒载体,即腺病毒内部的基因全部被删除了,只保留两端的ITR和包装信号ψ,完全没有免疫原性,不会被抗体清除,能长期使用而不致失效,而且可装载很大的外源基因,是目前最好的基因治疗载体之一。
利用Gutless载体,我们构建了可调控的靶向抗癌系统,即在GL腺病毒中装入两个表达框,一个是trans-activator(TA)的表达框,另一个是受TA激活而启动抗癌基因的表达框。在这个系统中,TA受肿瘤特异性的hTERT启动子的控制,但产生的TA又要受RU486的诱导所调控。因此,不是肿瘤细胞,TA不会表达;不加外源RU486,TA又不能发挥作用,抗癌基因也不会表达;只有在癌组织,又外加了RU486后,抗癌基因才能表达然后杀伤肿瘤。而在正常细胞中这个系统就不会发生作用,也不会有抗癌的基因表达,使不良反应很小。Gutless腺病毒生产困难,不能排除重组时所用辅助病毒的污染,尚未正式用于临床研究。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。














