金沙江干热河谷地区构树的AFLP分析
廖声熙1,何承忠2,李 昆1,3,杨振寅1,张志毅3
(1.中国林业科学研究院资源昆虫研究所,昆明650224;2.西南林学院资源学院,昆明650224;3.北京林业大学生物科学与技术学院,北京100083)
摘 要:金沙江河谷两岸自然分布的构树,根据树皮颜色和斑纹色泽可分为4个不同类型,即红构、红花构、白花构和青构。应用AFLP分子标记技术,采用E+3/M+3引物组合,对该4个类型构树进行了分析鉴定。9对引物组合共扩增出584条带,其中237条为多态带,多态带百分率为40.6%。9对引物组合扩增得到了4类构树各自特有的AFLP指纹图谱,可以明确地将4个类型构树进行区分。UPGMA聚类分析结果与供试材料的形态鉴别结果完全一致。上述结果表明,4个类型构树的表型差异是由遗传物质的变异而引起,这为今后构树新品种的划分、鉴定和登录奠定了基础。
关键词:构树类型;AFLP;分子鉴定
构树[Broussonetia papyrifera(L.)Vent]为桑科(Moraceae)构树族(Broussonetieae)落叶乔木,本属在全世界共有5种,主要分布于亚洲东部及太平洋岛屿。我国有3种,即构树、小构树(B.kazinokiSieb.et Zucc)和藤构(B.kaempferiSieb)[1]。作为低山河谷区常见树种,构树以其既耐干冷,又耐湿热的强适应性广泛分布于我国的西北、华北、华南、东南及西南各地,具有生长快、成材早等优良特性,是干旱地区和其他特殊生境地区造林绿化的先锋树种[2]。同时,因其韧皮部纤维长、洁白,构树皮自古就是优良的造纸原料,常用于制造打字蜡纸、引线抄纸、电池隔膜纸、云母带原纸等特种长纤维高档纸张[3]。而其皮、叶、果、汁等均可入药,是传统的中药材[1]。
云南省鹤庆县境内的金沙江干热河谷地区分布有丰富的野生构树资源。根据树皮颜色及斑纹色泽不同,可将该地区分布的构树划分为4个类型:①树皮白色,光滑,上有不规则红色斑纹,红白界限明显,树皮厚,产量高,称为白花构[white-bark with red-stripe B.papyrifera,(WRB)];②树皮通体暗红色,略微粗糙,树皮较厚,产量较高,称为红构[red-bark B.papyrifera,(RB)];③树皮红色,略微粗糙,遍布米粒至黄豆大小白色斑点,间杂不规则大块白色斑纹,树皮较厚,产量高,称为红花构[red-bark with white-stripe B.papyrifera,(RWB)];④树皮通体青色,青中透紫,树皮较薄,产量较低,称为青构[green-bark B.papyrifera,(GB)]。虽然经典的植物学分类是基于形态学方法,但形态特征易受环境条件的影响,亲缘关系相近的物种之间在形态上差异性很小,或可采用的标记数量有限,使得鉴定结果的准确性不够[4]。而近10多年发展起来的AFLP分子标记技术,直接以DNA的形式表现,无时空表达效应,不受外界环境等因素的影响,数量极多,覆盖了整个基因组,有较高的多态性与灵敏性,具有很强的可重复性[5-8],已被广泛地应用于物种遗传多样性检测与遗传结构分析[9-11],遗传图谱构建[12-15],杂种子代及其亲本鉴定[16-20],物种系谱关系的验证与构建[21-24]等研究范畴。本研究利用AFLP分子标记技术,采用最小样本数[7],对上述4个类型构树进行DNA指纹分析,旨在快速地从DNA水平上鉴别引起构树树皮表型差异的根本原因,为后期构树新品种的划分、鉴定及登录提供科学理论依据。
1 材料和方法
1.1 植物材料
研究材料采集于云南省鹤庆县境内的金沙江干热河谷地区的坡地及沟谷两岸,海拔1100~1700m之间,生境条件较差。山高坡陡,冲沟发育,切割密度大,侵蚀力强,地形破碎。为高原季风气候,具有雨热同季,干湿季节分明,夏秋多雨,冬春干旱的特点,年平均气温20.3℃,年降水量683.0mm,全年≥10℃活动积温6931.0℃,5~10月份雨季降水量占全年降水量的90%。土壤类型为燥红土和红褐土,土壤风化度极低,层次不明显,保水性能差。植被为干热河谷稀树灌草丛,常见植物有攀枝花〔Gossampinus malabarica(L.)Merr.〕、红椿(Toona ciliate Roem)、西南抗子梢(Campylotropis capillipes A.K.Schindl)、小石枳(Osteomeles schwierinae Schneid)、余甘子(Phyllanthusern bliea L.)、戟叶酸模(Rumex hastatus P.Don)、扭黄茅[Heteropogon contortus(Linn.)P.]等。依据构树不同类型,按照随机取样的原则,每种类型选取6株个体,从各样株上剪取枝条,带回实验室水培,待发叶后采取嫩叶提取各分析样本的总DNA。
1.2 基因组DNA提取
采用CTAB法依照标准酚/氯仿方法的程序与步骤[25],提取分析材料的基因组总DNA,在0.8%的琼脂糖凝胶上进行电脉检测DNA质量,并用紫外分光光度计(UV-2201)测定其浓度,最后稀释到40 ng/μl,冻存于-20℃冰箱备用。
1.3 AFLP分析
AFLP分析的实验流程与方法基本按照Vos等[5]的方法进行,仅针对构树材料,对AFLP反应体系进行了优化。采用内切酶EcoRI(Biolab)和MseI(Biolab)组合对分析材料的基因组DNA进行限制性酶切,酶切与连接同步完成。预扩增反应选用引物组合E00/M00,选择性扩增采用E+3/M+3引物组合方式。PCR扩增反应在PE-9700 PCR仪上进行,所用接头与引物均由上海生工合成,Taq DNA聚合酶与dNTP购于北京天为时代公司。选择性扩增产物经过95℃变性5min后,用6%的变性聚丙烯酰胺凝胶电泳分离。电泳采用Bio-Rad公司生产的测序电泳槽,在90W恒功率的条件下电泳约2 h。电泳结束后采用银染检测方法进行AFLP指纹显色反应[26]。
1.4 数据处理与分析
统计位于相同片段位置的谱带,按1/0系统记录,有带记为1,无带记为0。依据公式:多态性(%)=扩增多态性条带数/总扩增条带数×100%计算多态性条带的百分率。采用Nei’s遗传相似系数(Genetic Similarity Coefficient,GS)来比较各分析样本之间的遗传距离大小(Genetic Distance,D=1-GS)[27],该遗传距离矩阵由POPGENE1.31(Yeh et al.,1999)软件分析条带统计结果的0/1矩阵后获得[28]。采用非加权配对算术平均法(Unweighted Pair Group Method with Arithmetic Averages,UPGMA)对4个类型构树单株分别进行聚类分析。
2 结果与分析
2.1 AFLP的多态性分析
经过多次反复提取,但红花构1株分析样本的基因组DNA始终未能达到AFLP分析所要求的质量。因此,最后只对23份材料的基因组总DNA进行了AFLP分析。从32对引物组合中,共筛选出分离效果较好,条带分布比较均匀的9对引物组合应用于本实验。9对引物组合共扩增出584条带,其中公共条带347条,多态性条带237条,占总扩增带的40.6%。每对引物组合扩增出55~79条带,平均每对引物组合扩增出AFLP标记64.9个,其中平均每对引物产生的多态性标记为26.3个,多态性水平在25%~57%之间。在9对引物组合中,E34/M33和E44/M33这2对引物组合分别扩增出谱带71条和79条,多态性带分别为40条和45条,多态性水平达56%~57%(见表1)。
表1 4个类型构树材料的AFLP 9对引物组合多态性
2.2 各类型构树的AFLP特异标记
由9对引物组合扩增而获得23株分析样本的AFLP指纹图谱中,红构具有6条特有阳性带和6条特有阴性带,红花构特有阳性带为13条而特有阴性带为5条,白花构的特有阳性带和阴性带各为10条,青构的特有阳性带和阴性带分别为8和6条(见表2)。各引物组合的各种类型构树指纹图谱中出现的特异阳性带与阴性带数量不等,变化范围在0~4之间。其中,引物组合E34/M33的指纹图谱检测到特异阳性带最多,为4条,出现在红花构中,而引物组合E60/M46的指纹图谱检测到特异阴性带最多,也为4条,出现在白花构中(见表2)。图1所示为引物组合E65/M63在4个类型构树间的部分AFLP指纹图谱。
表2 4个类型构树特异条带在9类AFLP指纹图谱中的分布

注:a表示特异阳性条带数,b表示特异阴性条带数。
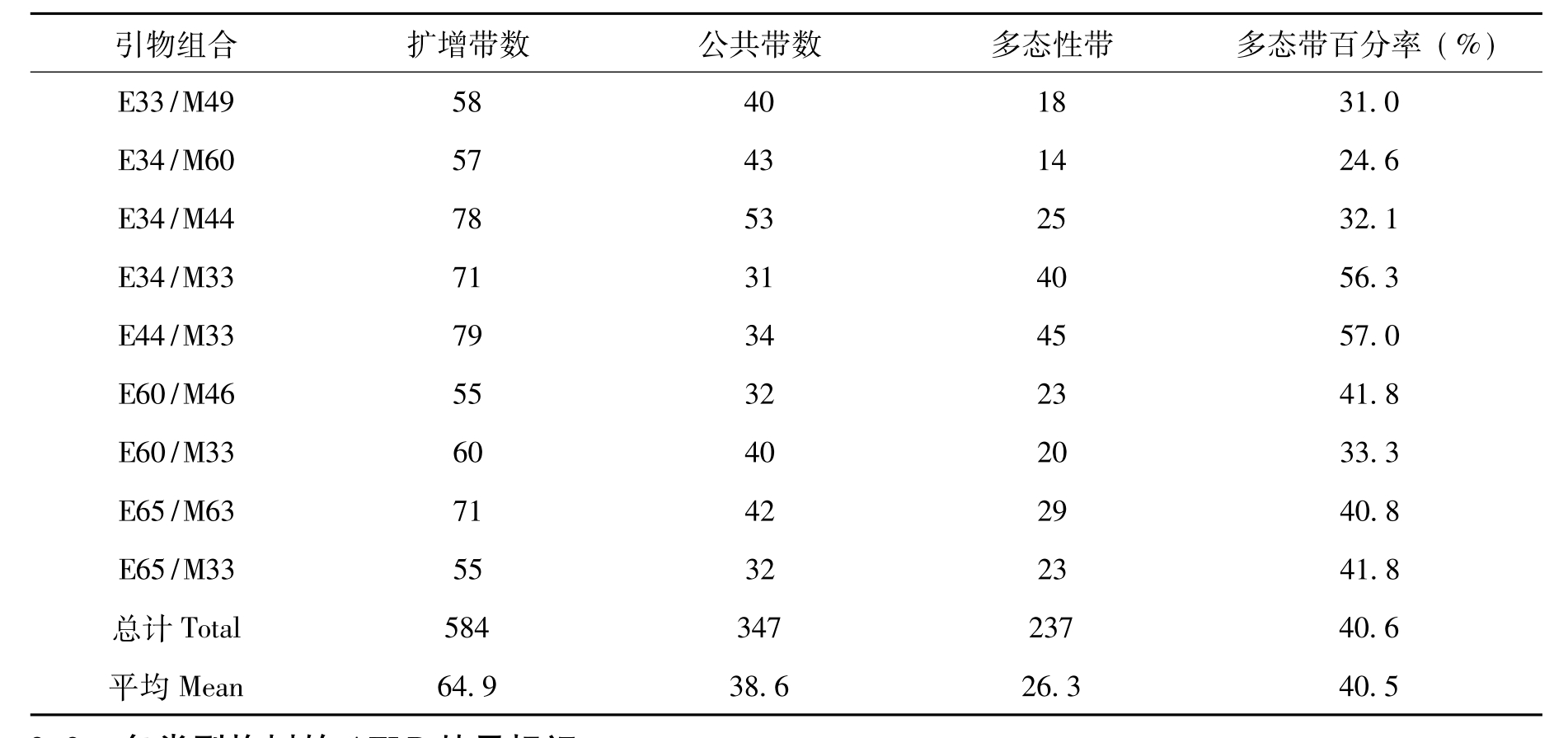
表3 4个类型构树间的Nei’s遗传距离与遗传一致度
注:对角线上方为遗传一致度,对角线下方为遗传距离。
2.3 各类型构树间的遗传距离与聚类结果
为了比较构树不同类型间的遗传差异,根据9对引物获得的AFLP多态性数据计算了各单株间的遗传距离(数据未列出)。结果显示,这23个样本之间的Nei’s遗传距离范围在0.0000~0.3502。而不同类型之间的遗传距离变化范围为0.2964~0.3964,红构与青构之间遗传距离最小,为0.2964,红花构与白花构之间遗传距离最大(0.3964)。相应地,红构与青构之间的遗传一致度最高为0.7435,而红花构与白花构之间的遗传一致度最低为0.6727(见表3)。

图1 引物对E65/M63在4个类型构树间的AFLP扩增结果
a.DNA质量不符合要求的样株;b.红花构特有阳性带;c.红构特有阳性带;d.白花构特有阴性带。
基于23个分析样本间的Nei’s遗传距离,采用非加权配对算术平均法(UPGMA)进行聚类分析(图2)。从图2中可以看出,23个构树材料分别按各自类型聚为一类,非常明显地形成四大分支。红构类型与青构类型首先相聚,其次与红花构类型聚为一支,而白花构类型与其他类型之间遗传距离较大,最后才与其余3种类型聚类。应用Bootstrap方法1000次重复验证各分支的可靠性,将分析样品划分为4类的准确性(Bootstrap检测值)达到100%(如图2)。
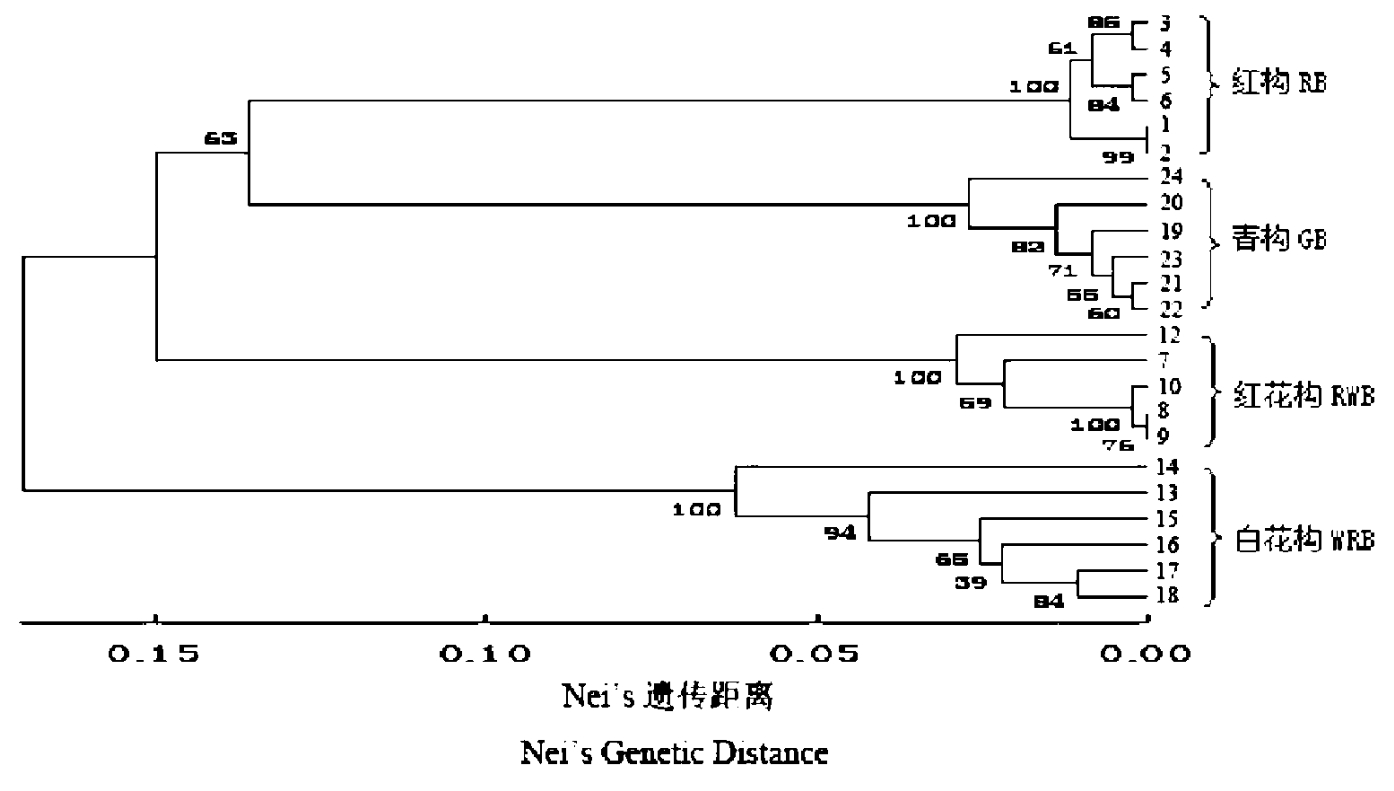
图2 4个类型构树间Nei’s遗传距离的UPGMA聚类图(分枝处数据为1000次重复的Bootstrap检测值)
3 讨论
AFLP分子标记技术具有分辨率高、信息量大、多态性检测率高等显著优点,被广泛应用于植物、动物以及微生物的相关研究[7,21,29-31]。但是,高质量基因组总DNA的获得是确保实验结果可靠性的关键环节之一。否则,由于酶切不完全,不能反映真实的AFLP指纹图谱[32]。构树是一种桑科的多年生木本植物,与大多数桑科植物一样,构树叶片中含有大量的多糖及多酚类物质。在本实验过程中,红花构的1株分析样本,虽然参照多种改进方法进行总DNA提取,但最终未能获得符合实验要求的DNA样品。在AFLP指纹图谱上,该样本的指纹表现出巨大的差异性,不能参与本实验结果的分析。
在应用AFLP标记鉴别分类关系较近的不同分类群(如亚种)时,若每一分类群的样本数太少,则该类群所具有的特异条带(Shared polymorphisms)极易被忽略。因此,每一分类群应采用最少5个样本进行分析[7]。本研究中,红花构样本数为5个,其余3个类型构树的样本数均为6个,4个类型构树的样本数均符合最小分析样本的要求。构树为异交植物,雌雄异株,自然群体以实生繁殖为主,使单株间存在遗传差异的主要原因。每一类型构树的分析样本中均有雌株和雄株,不是单一性别植株的代表。同时,取样时各样株之间保持了一定的地理距离,尽可能防止对相同基因型的重复取样。由此可见,本研究的结果具有较高的可靠性。
应用9对引物组合的AFLP选择性扩增结果中,构树23个分析样本共产生584条带,多态性条带为237条,占总扩增带的40.6%,而每对引物组合产生的多态性条带数在14~45条之间,表明各样本间亲缘关系较近,另一方面也表明构树不同种质资源之间存在着较为丰富的遗传多样性。对9对引物组合的指纹图谱进一步分析发现,除了各样株个体具有的特异条带外,每种类型构树的检测样株拥有该类型特有的阳性带或阴性带。其中,白花构的特异条带数多达20条,而红构的特异条带数为12条,青构的特有条带为14条,红花构特异条带数为18条,说明白花构与其他3种类型构树间差异最大。进一步地,Nei’s遗传距离及聚类分析结果均表明,白花构与其他3种类型间遗传距离相对较大,亲缘关系相对较远。此外,若采用4对引物组合(E34/M44、E60/M46、E60/M33、E65/M63)中任一一组,就可以将4个类型构树区分开来。上述结果表明,4个类型构树之间遗传分化十分明显,表型(树皮性状)的差异是由遗传物质的差异而引起,这种性状的差异具有遗传物质基础,不是因为环境条件而引起。在对构树树皮纤维的测定分析中发现,不同类型构树的纤维特性和制浆性能都有一定的差别[33,34],这也表明构树不同类型之间的差异具有遗传物质基础。引起构树类型之间遗传分化的原因,可能是由于沟蚀等作用,造成金沙江流域构树分布区的生境破碎化[35],加之生态环境条件复杂而特殊,经过长期的自然选择,最终分化出了现有的4个构树类型。
致谢:本实验在北京林业大学林木花卉遗传育种与基因工程教育部重点实验室完成,得到实验室李博硕士、冯夏莲硕士、安新民博士后以及实验室其他成员的大力帮助,特此致谢!
参考文献
[1]张秀实,吴征镒,曹子余.中国植物志(第二十三卷)[M].北京:科学出版社,1998:23-26.
[2]XIONG Y Q(熊佑清).An application research of Broussonetia papyrifera in Greenland[J].China Landscape(中国园林),2004,8:72-74(in Chinese).
[3]WEN Q J(文琼菊),NIE X Z(聂勋载).Method of mulberry bark pulping[J].Paper and Paper Making(纸与造纸),1996,4:10-11(in Chinese).
[4]GUIJ(桂君),TAN X F(谭晓风).The molecular taxonomy and identification of plant[J].Life Science Research(生命科学研究),1998,2(4):253-257(in Chinese).
[5]VOS P,HOGERS R,BLEEKER M,REIJANS M,et al.AFLP:A new concept for DNA[J].Nucleic Acids Research,1995,23:4407-4414.
[6]GRECH K,MARTINELLI A,PATHIRANA S,et al.Numerous,robust genetic markers for Plasmodium chabaudi by the method of amplified fragment length polymorphism[J].Molecular and Biochemical Parasitology,2002,123:95-104.
[7]BENSCH S,KESSON M Ten years of AFLP in ecology andevolution:why so few animals?[J].Molecular Ecology,2005,14:2899-2914.
[8]HE CH ZH(何承忠).Application of modern biotechnology in Populus genetic improvement[J].Journal of Southwest Forestry College(西南林学院学报),2003,23(3):61-67(in Chinese).
[9]KRAUSS S L.Accurate gene diversity estimates from amplifiedfragment length polymorphism(AFLP)markers[J].Molecular Ecology,2000,9:1241-1245.
[10]DESPRES L,LORIOT S,GAUDEUL M.Geographic pattern of geneticvariation in the European globeflower Trollius europaeus L.(Ranunculaceae)inferred from amplified fragment length polymorphism markers[J].Molecular Ecology,2002,11:2337-2347.
[11]NGUYEN T T,JAYLOR PW J,REDDEN R J,etal.Genetic diversity estimates in Cicer using AFLP analysis[J].Planting Breeding,2004,123:173-179.
[12]CERVERA M T,STORME V,IVENS B,etal.Dense genetic linkagemaps of three Populus species(Populus deltoids,P.nigra and P.trichocarpa)based on AFLP and microsatellite markers[J].Genetics,2001,158:787-809.
[13]CLERC A L,BRIARD M,REVOLLON P.Influence of number andmap distribution of AFLP markers on similarity estimates in carrot[J].Theoretical and Applied Genetics,2002,106:157-162.
[14]CARLIER JD,REIS A,DUVAL M F,etal.Geneticmaps of RAPD,AFLP and ISSR markers in Ananasbracteatus and A.comosus using the pseudo-testcross strategy[J].Planting Breeding,2004,123:186-192.
[15]ZHANG D,ZHANG Z,YANG K,et al.Genetic mapping in(Populus tomentosax Populus bolleana)and P.tomentosa Carr.using AFLP markers[J].Theoretical and Applied Genetics,2004,108:657-662.
[16]KRASNYANSKI S,BALL T M,SINK K C.Somatic hybridization in mint:identification and characterization of Mentha piperita(+)M.specata hybrid plants[J].Theoretical and Applied Genetics,1998,96:683-687.
[17]BEKKAOUI F,MANN B,SCHROEDER B.Application of DNA markers for the identification and management of hybrid poplar accessions[J].Agroforestry Systems,2003,59:53-59.
[18]CHAUHAN N,NEGIM S,SABHARWAL V,et al.Screening interspecific hybrids of Populus(P.ciliate xmaximowiczii)using AFLP markers[J].Theoretical and Applied Genetics,2004,108:951-957.
[19]RUAN C J,QIN P,HAN R M,et al.Identification of hybrids of Kosteletzkya virginica using AFLP markers[J].Journal of Nanjing Forestry University(Natural Sciences Edition)(南京林业大学学报自然科学版),2005,29(1):20-24(in English).
[20]YANG CH CH(杨成超),WANG SH D(王胜东),YANG ZH Y(杨志岩),et al.Genetic relationship between parents and hybrid progenies of Populus alba L.×Ulmus pumila L.using AFLP marker[J].Journal of Beijing Forestry University(北京林业大学学报),2007,29(2):7-12(in Chinese).
[21]ALBERTSON R C,MARKERT JA,DANLEY P D,etal.Phylogeny of a rapidly evoving clade:the cichlid fishes of Lake Malawi,East A frica[J].Proceedings of the National Academy of Sciences,USA,1999,96:5107-5110.
[22]JOHNSON E L,SAUNDERS J A,M ISCHKE S,et al.Identification of Erythroxylum taxa by AFLP DNA analysis[J].Phytochemistry,2003,64:187-197.
[23]HE T,KRAUSS S L,LAMONT B B,et al.Long-distance seed dispersal in ametapopulation ofBanksia hookeriana inferred from a population allocation analysis of amplified fragment length polymorphism data[J].Molecular Ecology,2004,13:1099-1109.
[24]KOOPMAN W J.Phylogenetic signal in AFLPdata sets[J].Systematic Biology,2005,54:197-217.
[25]MURRAY M G,THOMPSON W F.Rapidisolation of high-molecular-weight plant DNA[J].Nucleic AcidsResearch,1980,8:4321–4325.
[26]TIX IER M H,SOURDILLE P,RODER M,et al.Detection ofwheatmicrosatellites using a non radioactive silver-nitrate stainingmethod[J].Journal ofGenetics and Breeding,1997,51,175-177.
[27]NEIM.Estimation of average heterozygosity and genetic distance from a small number of individuals[J].Genetics,1978,89:583-590.
[28]YEH F C,YANG R C,BOYEL T.POPGENE Version 1.31,M icrosoftWindow-based Freeware forPopulation Genetic Analysis.University of A lberta and Centre for International Forestry Research.1999.
[29]ALLABY R G,BROWN T A.AFLP data and the origins ofdomesticated crops[J].Genome,2003,46:448-453.
[30]GAO G(郜刚),JIN L P(金黎平),QU D Y(屈冬玉),et al.Identification of Common AFLP Markers Linked with Resistance to BacterialW ilt in Potato[J].Acta Bot.Boreal.-Occident Sin.(西北植物学报),2005,25(2):269-274(in Chinese).
[31]CHENG ZH J(程振家),WANG H S(王怀松),ZHANG ZH B(张志斌),et al.Genetic Diversity ofMelon(Cucumismelo L.)Germplasm Based on AFLPs[J].Acta Bot.Boreal.-Occident Sin.(西北植物学报),2007,27(2):244-248(in Chinese).
[32]WANG ZH W(王卓伟),YU M D(余茂德),LU CH(鲁成),et al.AFLP analysis of genetic background of polyploidy breedingmaterials ofMulberry[J].Science of Sericulture(蚕业科学),2001,27(3):170-176(in Chinese).
[33]LIU X B(刘晓波),CHEN K L(陈克利),CHEN H Y(陈海燕),et al.A preliminary study on the chemical composition,fibermorphology and pulping property of three mulberry trees in the west Yunnan[J].SouthWest Pulp and Ppaper(西南造纸),2005,34(3):8-10(in Chinese).
[34]YANG ZH Y(杨振寅),LI K(李昆),LIAO SH X(廖声熙),et al.Influence of Types on Chemical Components,Fiber Morphology and Pulping Properties of Broussonetia papyrifera Bark[J].Journal of Nanjing Forestry University(Natural Sciences Edition)(南京林业大学学报自然科学版),2007,31(6):71-74(in Chinese).
[35]OU X K(欧晓昆),JIN ZH ZH(金振洲).A preliminary study on the flora and ecological diversity in Jinsha River dry-hot valley[J].Journal of Wuhan Botanical Research(武汉植物学研究),1996,14(4):318-322(in Chinese).
AFLP analysis ofBroussonetia papyrifera distributed in Jinsha River dry-hot valley
LIAO Shen-xi1,HE Cheng-zhong2,LIKun1,3,YANG Zhen-yin1,ZHANG Zhi-yi3
(1.The Research Institute ofResources Insects,the Chinese Academy of Forestry,Kunming 650224,China;
2.Faculty ofResources,SouthwestForestry College,Kunming 650224,China;
3.College of Biological Sciences and Biotechnology,Beijing Forestry University,Beijing 100083,China)
Abstract:The Broussonetia papyrifera,distributed in Jinsha River dry-hot valley,can be divided into four types according to their differences in bark colors and stripes,namely red-bark B.papyrifera(RB),red-bark with white-stripe B.papyrifera(RWB),white-bark with red-stripe B.papyrifera(WRB)and green-bark B.papyrifera(GB).The four types of B.papyrifera were identified by AFLP markers with E+3/M+3 primer combinations.Using nine primer combinations,a total of584 DNA fragmentswere generated with 237(40.6%)being polymorphic.The shared AFLP fingerprintingmaps of each type B.papyrifera constructed by nine primer combinations,and the four types of B.papyrifera could be distinguished by these shared polymorphisms.The cluster resultof23 individuals constructed with a UPGMA method was consistentwithmorphological identification.The all results indicate that the differences ofmorphological characteristicsmostly result from DNA variations among the four types of B.papyrifera,and provide the evidences for new varieties taxa,identification and enrol in B.papyrifera.
Key Words:different types of Broussonetia papyrifera;AFLP;molecular identification
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。















