3.4.2 Ps Fe/Mn-cSOD单体的结构
Ps-cSOD的一个单体是一个相对分子质量为22.6kD的大分子,包含201个氨基酸。Ps中Fe-SOD与Mn-SOD的结构几乎一样。以下是对两种酶的结构的描述。图3-27是一个单体的整体形状,从N-端开始,包括两个长的α-螺旋(H1,H2),两个短的α-螺旋(H3,H4),然后是三条链组成(B1,B2,B3)的一个β-折叠,然后是C-端的两个α-螺旋(H5,H6)。可以将其分为H1,H2构成的螺旋结构域Z,由其他螺旋构成的结构域Ⅱ及β-折叠,活性中心位于这些结构域的裂隙中。
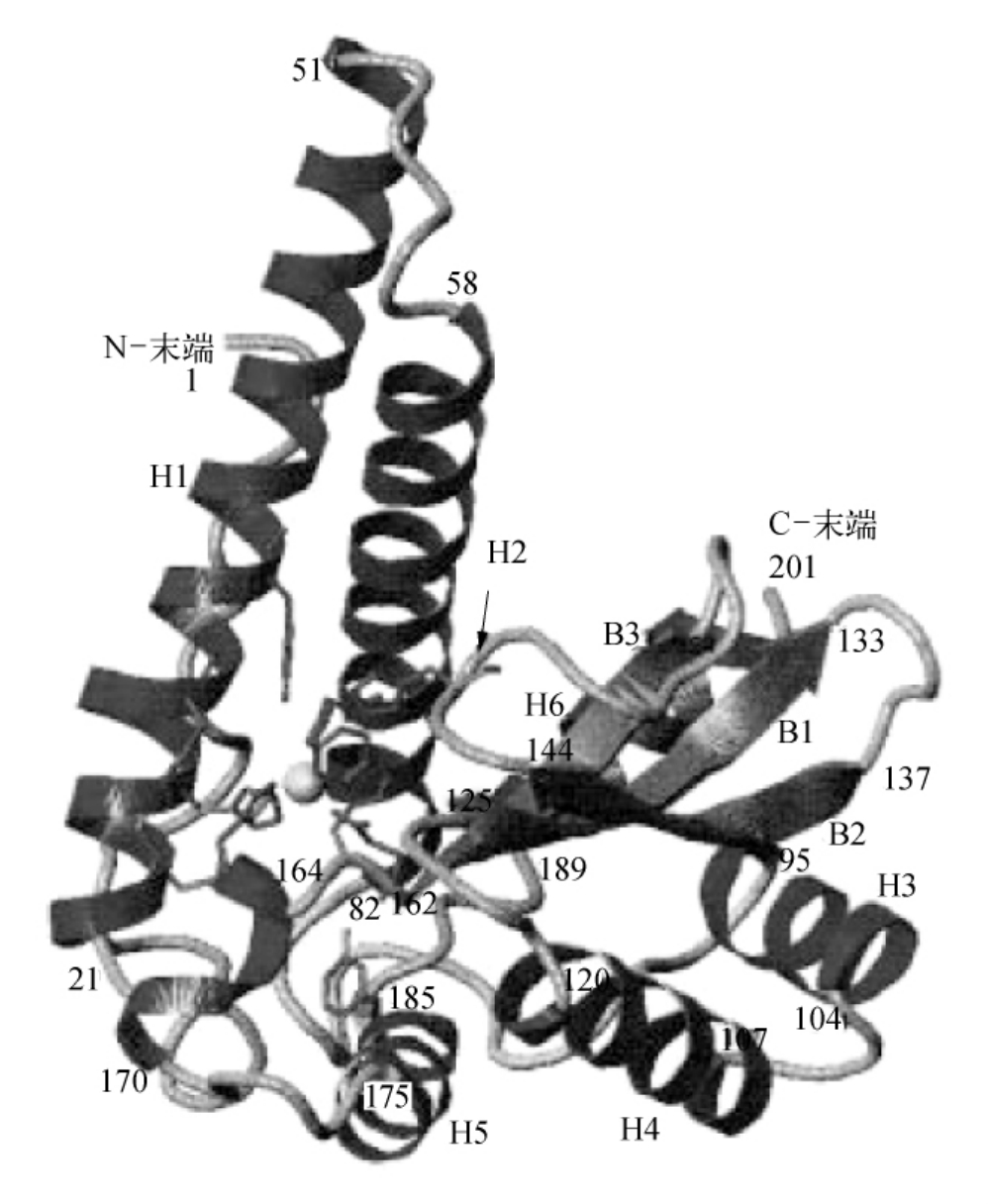
图3-27 Ps-cSOD的一个亚基三级结构的主链
(摘自Parak F,et al.J.Biol.Inorg.Chem.,1996)
为了有利于不同SOD间的对比,序列数在图中已经标注。活性中心的残基和金属离子也已显出。
N-端的结构域包括到第82位氨基酸残基。第53~57氨基酸残基是反向平行的H1螺旋和H2螺旋的连接环处。参与活性中心的氨基酸残基包括H1中Met24,His27,His31和Tyr35,以及H2中His75,Phe78和Met82。在与金属配位的His27残基附近的α-螺旋被另一个氨基酸残基Asp29所扭曲,这导致了已在其他SODs描述的扭结。该氨基酸残基的羰基氧可以通过氢键结合到Lys33的NZ上。21位N-端残基通过氢键紧紧结合到H1,H2上。结构域Ⅰ和结构域Ⅱ被83~94的氨基酸残基构成的大环分开,且几乎跨越了整个蛋白质。在H3,H4后是三折的β-折叠B1,B2,B3。B1链在中间,与B2,B3分别反向平行。连接B2,B3的145~153氨基酸残基形成的环穿越B1链中心,受到严格限制。连接环,B3链和后面一些残基中的His146,Asp161,Trp163和His165构成了活性中心。它们与上面提到的组成活性中心的氨基酸残基可以将中心金属和底物固定在特定的位置。螺旋H3,H4,H5和螺旋C-端的H6螺旋在β-折叠上方形成一个框架,这一结构通过内部的疏水作用而稳定,这些疏水作用主要存在于螺旋中的Phe、β-折叠中的Leu或Ile之间。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。
















