实验十 Southern Blotting鉴定目的DNA片段
一、实验目的
掌握Southern杂交技术的原理和实验技术,利用Southern杂交技术鉴定目的DNA片段。
二、实验原理
Southern杂交是指将DNA片段混合物电泳分离后,将分离的DNA平面原位转移到滤膜上,用标记有生物素的目标DNA片段与膜上的DNA进行杂交,再用连接有碱性磷酸酶并能识别生物素标记的抗体与探针结合,经显色处理后,将带有目标DNA的片段定位鉴定出来的过程或技术。整个过程包括DNA片段的凝胶电泳分离、DNA从凝胶上平面转移到固体膜、预杂交(封闭)、生物素标记的特异探针与膜上的DNA杂交、探针与碱性磷酸酶连接的抗生物素抗体结合、显色鉴定带有标记DNA。这个技术是1975年由E.Southern首先设计出来的,故名Southern DNA印迹转移技术。核酸分子杂交技术是1968年由Roy Britten及其同事发明的。原理是当互补的特定单链DNA或RNA混合时,其同源区段会退火形成双链结构,这是探针杂交检测同源基因的基础。
硝酸纤维素膜吸附单链DNA分子,因此转移前带有DNA的琼脂糖凝胶需要经过碱变性,需要转移的DNA分子大小不同,转移需要的时间也不同,进行酸处理(0.25mol/L HCl短暂浸泡)脱嘌呤再进行碱处理,使DNA分子断裂成小分子,可以使转移同步。琼脂糖凝胶上经过电泳分离的DNA以天然的形式转移到尼龙膜上,碱变性在尼龙膜上进行。
最初使用的转移缓冲液是SSC,1980年G.E.Smith发现1mol/L醋酸铵和0.2mol/L NaOH代替SSC可以提高硝酸纤维素膜对小分子DNA的吸附能力。最近还有人直接用0.4mol/L的NaOH转膜。
探针的制备有多种方法,除了实验三的PCR法外,本实验还可以采用切口平移法。切口平移法是利用Klenow大片段进行。它可以以目标DNA为模板,随机切口并在切口处从5'向3'移去旧碱基,添加新碱基,生物素标记的dUTP可暨此掺入新合成的链。
三、实验仪器、材料和试剂
1.仪器:微量移液器,枪头(10μL、200μL、1mL),枪头盒,离心管(1.5mL),电泳仪,电泳槽,恒温干燥箱,恒温摇床或杂交仪,塑料杂交盒或合适大小的培养皿,凝胶成像系统。
2.材料:实验一中制备的酶切DNA片段,硝酸纤维素膜。
3.试剂:转膜缓冲液:0.4mol/L NaOH(中性法:20×SSC)
杂交缓冲液:5×SSC,0.1% SDS,2.5mmol/L EDTA,100μg/mL salmon sperm ssDNA,50mmol/L*PB,5×**Denhardt's solution
封闭液:1%小牛血清或脱脂奶粉,0.1mol/L Tris-HCl,0.15mol/L NaCl pH7.4。
冲洗液:0.1mol/L Tris-HCl,0.15mol/L NaCl,pH7.4。
显色缓冲液:0.1mol/L Tris-HCl,0.1mol/L NaCl,pH9.5。
显色剂:1mL显色缓冲液中加入50mg/mL BCIP7.5μL,50mg/ mL NBT3.8μL。
四、实验步骤
(一)总DNA的酶切、电泳、转膜
1.酶切:选用限制性内切酶酶切基因组总DNA,酶切12h左右。或直接取实验一酶切的基因组总DNA。
2.酶切产物检测:先取少量进行预电泳检测酶切效果(1μL)。
3.DNA电泳:用0.8%的琼脂糖凝胶进行低电压电泳或反转电泳。
4.转移前DNA的处理:电泳后将大片段的凝胶部分用紫外灯照射15min左右,打断大片段(双酶切后可不做这一步)。
5.转移:用0.4mol/L NaOH进行碱法转移8~12h,将胶中的DNA转移到Hybond-N+尼龙膜上。
6.转移结束后,将尼龙膜放入一干净盒子,用6×SSC溶液简单洗两次后,室温干燥10min,紫外交联仪中(1200×100μJ/cm2)15min,或者在80℃真空干燥箱或干燥箱中1h,将DNA固定在膜上(如实验室没有紫外交联仪或者由于时间安排需要也可以采用烘干的方法,此外,在真空干燥箱中烘干杂交效果最好)。
7.用保鲜膜把膜包好,4℃下保存备用。
8.探针的制备。
用PCR法标记探针(参照实验九)。
RedPrime DNA探针标记试剂盒操作方法(参照附录8)。
(二)PCR标记探针的变性
探针的纯化(可以略去):将PCR标记的探针用2.5倍无水乙醇和1/5倍10mol/L乙酸铵沉淀1h(-20℃),16000rpm离心15min,弃上清液,沉淀用75%和无水乙醇洗,干燥后加ddH2O溶解。
纯化的探针(也可直接使用标记的PCR产物)使用前沸水中煮或95℃变性5~10min,然后马上置于冰上2min。
9.预杂交及杂交:按0.2~0.5L/m2杂交膜面积的量,将杂交液加入放有尼龙膜的杂交管中,45℃预杂交1~2h,然后将变性后的探针加入到杂交液中,45℃杂交炉中杂交过夜(14~16h)。
10.洗膜及杂交信号检测
(1)2×SSC,0.1%SDS室温下洗膜5min,重复3次。
(2)0.5×SSC,0.1%SDS45℃洗膜2次,每次15min。
(3)冲洗液(0.1mol/L Tris-HCl,0.15mol/L NaCl,pH7.4)中1min。
(4)封闭液至少60min。
(5)按0.5μL抗体/2.5mL封闭液,加入抗体,37℃1h。
(6)冲洗液洗膜15min,重复3次。
(7)显色缓冲液中2min。
(8)在刚覆盖住膜的显色液中避光显色(过夜)。
(9)蒸馏水洗或中和液终止反应。
实验时间跨度约60h。
五、结果与分析
对显色后的结果进行分析时应注意鉴别假阳性。当探针过多或不专一,会出现整条泳道被杂交上。如果静置时膜在塑料袋中没有与溶液充分接触,而是被塑料带阻隔,会出现深浅不一的斑点,如图10-1所示。
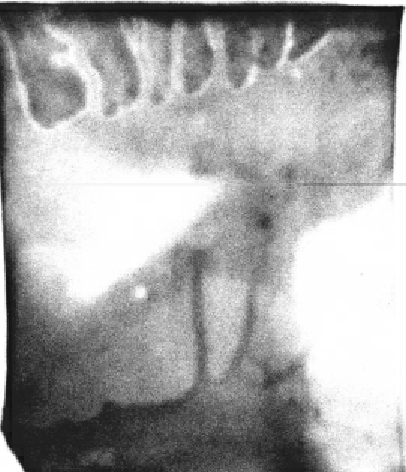
图10-1 Southern杂交方法鉴定花生基因组中DOF基因
六、注意事项
1.转膜时不要有气泡。
2.如果不是碱转膜,转膜前DNA要变性。
3.最后显色反应要避光静置。
4.探针应专一。
七、思考题
1.为什么Southern杂交要把DNA转移到膜上?
2.DNA探针杂交前为什么要变性?膜上的DNA是否要变性?
3.通过什么方法可以观察到特异DNA序列?
4.为什么要进行预杂交?这和后面与抗体杂交前的封闭液处理1h有何区别?
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。















