9.2.1 表面活性剂在溶液表面上的吸附
表面活性剂的一个重要特征是在水中只要加入小剂量,水的表面张力就会显著地降低。这是因为活性剂分子是由亲水的极性部分和亲油的非极性部分组成。当它溶入水中后,根据极性相似相溶规则,活性剂分子极性部分倾向于留在水中,而非极性部分倾向于超出水面,或朝向非极性溶剂中。每一个表面活性剂分子都有这种倾向,必然造成多数表面活性剂分子倾向于分布在表面(或界面上),并整齐地取向排列,形成一吸附层。此时的表面已不再是原来纯水的表面,而可以看做是掺有亲油的碳氢化合物分子的表面,由于极性与非极性分子之间相互排斥,所以加有表面活性剂的水溶液其表面(或界面)张力下降。
关于表面张力随活性剂在表面层浓度的变化规律,可以用Gibbs吸附公式来表达:
![]()
如前所述,Γ是指表面过剩量,但是对表面活性剂来说,当浓度很稀时,表面过剩量远大于内部浓度,因此,吸附量可近似地看做表面浓度。
应用Gibbs公式从σ-C曲线算出相应的Γ后,可以绘制Γ-C曲线。一般情况下,Γ-C曲线的形状如图9-2所示。
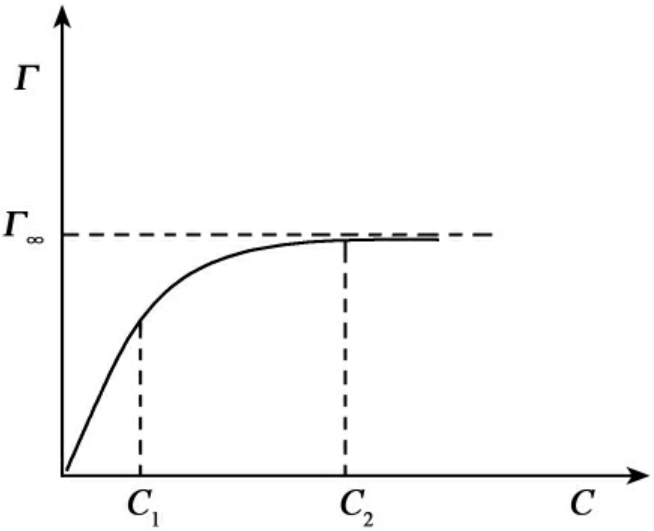
图9-2 Γ-C曲线示意图
吸附量有一极限值Γ∞,这表示吸附已达饱和,所以Γ∞称为饱和吸附量,可以用Langmuir型的经验公式表示:
![]()
式中k是经验常数,与表面活性剂性质有关。当浓度很稀时,1+kC接近于1,则
Γ=Γ∞kC
这时吸附量与浓度呈直线关系,在图9-2中是浓度小于C1的范围;当浓度很大时,1+kC接近于kC,则:
![]()
吸附量恒定,与浓度无关,这是饱和吸附的情况。
当吸附达到饱和时,每个吸附分子所占的面积S∞应当是
![]()
式中N是阿佛伽德罗常数。试验结果表明:对直链脂肪酸、醇、胺来说,只要含碳数目不大于8,不管链长度如何(如C2H5-COOH和C6H13COOH的链长之比为1∶2),Γ∞的值总是相同的。因此可以求出醇类的S∞=0.274~0.289nm2,RCOOH的S∞=0.302~0.310nm2,RNH2的S∞=0.270nm2,这些结果表明,达到饱和吸附时,表面上的吸附分子应该是定向排列的,否则就无法解释不管碳链长度如何,每个分子所占面积几乎都是相同的这一事实。
由于饱和吸附层中表面活性分子是定向排列的,显然对直链饱和脂肪族同系物来说,链长增加时,其厚度(也可看作分子的高度)也应该是有规则地同步增加的,由实验结果得知,在同系物中的饱和碳链上,每增加一个─CH─2基时,δ值约增加0.13到0.15nm,这与X光分析所得结果是一致的。
例:在19℃时,丁酸溶液的表面张力与浓度的关系为:σ=σo-aLn(1+bC),其中σo为纯水的表面张力,C为丁酸的浓度,a、b为常数。
1.试求该溶液表面吸附量Γ和浓度C的关系式。
2.若已知a=13.1×10-3N·m-2,b=19.62L·mol-1,试计算C=0.2mo l·L-1时的Γ。
3.试计算丁酸在溶液表面的饱和吸附量Γ∞。
4.设此时表面层上丁酸成单分子吸附,试计算每个丁酸分子的横截面积。
解:1.已知:σ=σo-aLn(1+bC)
则: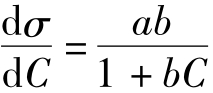 ,代入Gibbs吸附公式得:
,代入Gibbs吸附公式得:
![]()
2.当丁酸浓度C=0.2mol·L-1时,表面吸附量
![]()
3.从1解得
![]()
当浓度C较大时bC>>1,1+bC≈bC
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。
















