在进行基因组分析、Southern杂交及构建基因组文库的过程中,都需要提取高纯度、高分子质量的基因组DNA。不同生物(微生物、植物、动物)的基因组DNA的提取方法有所不同,不同种类的组织因其细胞结构及所含的成分不同,分离方法也有差异。制备DNA的原则是既要将DNA与蛋白质、脂类和糖类等分离,又要保持DNA分子的完整。总体来说,利用基因组DNA较长的特性,可以将其与细胞器或质粒等小分子DNA分离:加入一定量的异丙醇或乙醇,基因组的大分子DNA即沉淀形成纤维状絮团,可用玻棒将其取出;而小分子DNA则只形成颗粒状沉淀附于壁上及底部,从而达到提取基因组DNA的目的。
提取基因组的步骤概况如下:

提取产物经电泳分离、EB染色后,在紫外线灯下可观察到一个高分子质量条带。如果DNA断裂或降解,会出现弥散带型。
一、细菌基因组DNA的提取
利用溶菌酶水解大肠杆菌的肽聚糖细胞壁,从而破碎细胞。用蛋白酶K消化后,再用酚、氯仿抽提的方法去除蛋白质,最后经乙醇沉淀即得到大肠杆菌基因组DNA。
【材料】
1. 细菌培养物
2. 试剂
(1)LB液体培养基。
(2)LB固体培养基。
(3)溶菌酶溶液:用10mmol/L Tris-HCl(pH8.0)溶液配制成20mg/ml。
(4)胰RNA酶(10mg/ml)。
(5)TE缓冲液(pH 8.0):10mmo/L Tris-HCl,25mmol/L EDTA。
(6)饱和酚∶氯仿∶异戊醇=25∶24∶1(体积比)。
(7)氯仿∶异戊醇=24∶1(体积比)。
(8)3mol/L NaAc(pH 5.2)。
(9)无水乙醇和70%乙醇(放置于4℃冰箱,用后立即放回)。
(10)蛋白酶K溶液:将蛋白酶K(10mg/ml)溶于50mmol/LTris-HCl、1.5mmol/L Ca(Ac)2 。
3. 设备 微量移液器(100μl,1 000μl)、台式高速离心机、恒温振荡摇床、高压蒸汽消毒器(灭菌锅)、涡旋振荡器、恒温水浴箱、弯成钩状的小玻棒、1.5ml EP管。
【操作步骤】
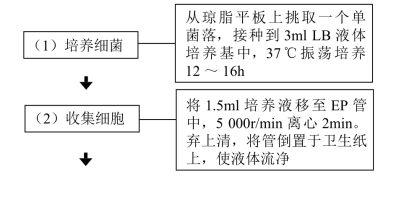
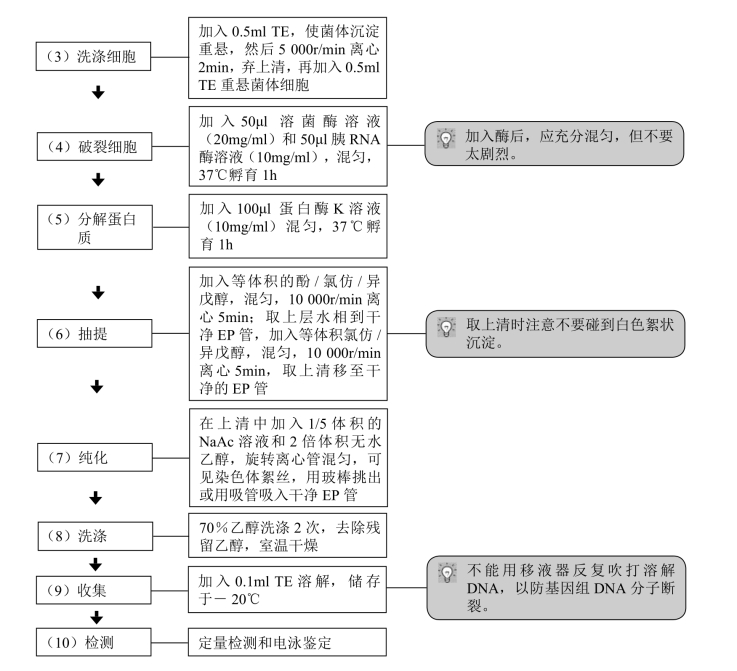
【注意事项】
1.DNA的二级结构和双链易受多种因素(如强酸、强碱、加热、低盐浓度、有机溶剂、酰胺类、尿素等)的影响引起双链解开发生变性,因此抽提时避免使用变性的条件。
2.抑制内、外源DNA酶(DNase)的活力:DNA酶催化大分子的DNA断裂成小片段,所以要加以杜绝,可以通过多种途径来抑制其活性。①低温操作;②调节溶液pH使其偏碱性(pH 8.0);③抽提液中加表面活性剂;④加螯合剂(EDTA)除去酶的辅助因子(Mg2+),使酶活性丧失。
3.防止化学降解。如强酸或强碱以及其他化学因素,会使DNA降解,一般综合考虑,取pH 8.0左右为宜。
4.防止物理因素降解。如温度太高或机械张力剪切等,DNA分子特别大,其长度可达109 bp,极易被机械张力拉断,甚至在离心管中稍急一些的流动也会使DNA断裂,所以在抽提过程中要特别注意这一点,操作过程要尽量简便、温和、避免剧烈振荡和重复冻融。
5.在用吸头吸取的过程中,应避免产生气泡,使用的吸头最好要大口径或者剪掉吸头尖。
二、植物组织基因组DNA的提取
十六烷基三甲基溴化铵(hexadyltrimethyl ammomum bromide,简称CTAB)是一种阳离子去污剂,能溶解细胞膜和核膜蛋白,使核蛋白解聚,从而使DNA得以游离出来在高离子强度的溶液中(>0.7mol/L NaCl),CTAB还能与蛋白质和多聚糖形成复合物但不能沉淀核酸。通过有机溶剂抽提,去除蛋白质、多糖、酚类等杂质后,可用乙醇或异丙醇沉淀即可分离出来核酸。 CTAB法是最经典的植物DNA提取方法之一。
【材料】
1.新鲜植物幼嫩叶子
2.试剂
(1)2×CTAB提取缓冲液:2% CTAB,100mmol/L Tris-HCl(pH 8.0),1.4mol/L NaCl,25mmol/L EDTA,0.2%β-巯基乙醇。
(2)氯仿∶异戊醇=24∶1。
(3)胰RNA酶溶液(10mg/ml)。
(4)TE缓冲液(pH 8.0):10mmo/L Tris-HCl,1mmol/L EDTA。
(5)预冷异丙醇。
(6)预冷无水乙醇和70%乙醇。
(7)液氮。
3.设备 微量移液器(100μl,1000μl),台式高速离心机,恒温水浴箱,陶瓷研钵50ml离心管(有盖)及5ml离心管。
【操作步骤】
【注意事项】
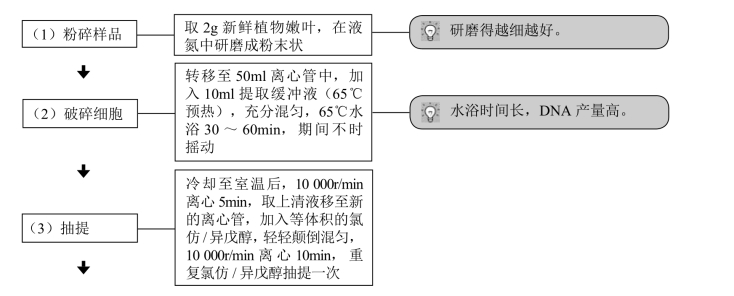
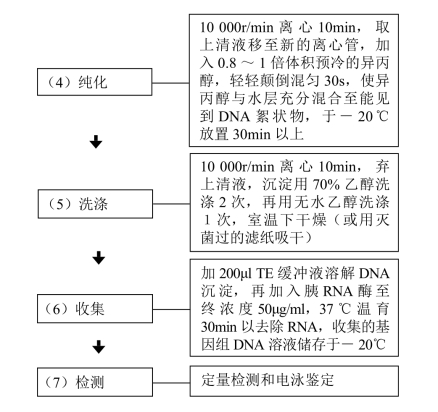
1.植物的次生代谢物(主要是胞质内的多酚类或色素类化合物)对核酸提取有干扰作用,因此,一般尽可能选幼嫩的、代谢旺盛的新生组织作为提取DNA的材料,这是因幼嫩的新生组织次生代谢物较少,DNA含量高,且易于破碎,另外植物材料最好是新鲜的。
2.在液氮中研磨,材料易于破碎,并且叶片磨得越细越好。
3.由于植物细胞匀浆含有多种酶类(尤其是氧化酶类)会对DNA的抽提产生不利的影响,在抽提缓冲液中需加入抗氧化剂或强还原剂(如巯基乙醇)以降低这些酶类的活性;另外,由于植物细胞中含有大量的DNA酶,因此,除在抽提缓冲液中加入EDTA抑制DNA酶的活性外,研磨时应迅速,以免组织解冻,导致细胞裂解,释放出DNA酶,使DNA降解。
4.植物细胞中含有大量的酚类化合物,氧化后易与DNA共价结合,并能抑制DNA的酶解反应,影响对基因组DNA进行的后续反应。为了防止这类情况出现,可以向提取缓冲液中加入2%(W/V)的聚乙烯吡咯烷酮(PVP,相对分子质量10 000),或者提高提取缓冲液中的巯基乙醇的浓度到2%~5%(W/V)。
三、动物组织基因组DNA的提取
动物细胞的DNA是以染色体的形式存在于细胞核内,因此哺乳动物的一切有核细胞(包括培养细胞)都能用来制备基因组 DNA。提取DNA的一般过程是将分散好的组织细胞在含SDS和蛋白酶K的溶液中消化分解蛋白质,再用酚和氯仿/异戊醇抽提分离蛋白质,得到的DNA溶液经乙醇沉淀使DNA从溶液中析出。
在匀浆后提取DNA的反应体系中,SDS可破坏细胞膜、核膜,并使组织蛋白与DNA分离,EDTA则抑制细胞中DNA酶的活性;而蛋白酶K可将蛋白质降解成小肽或氨基酸,使DNA分子完整地分离出来,并且蛋白酶K的重要特性是能在SDS和EDTA存在下保持很高的活性。
【材料】
1.新鲜动物肝脏组织
2.试剂
(1)匀浆缓冲液:10mmol/L Tris-HCl(pH 8.0),25mmol/L EDTA (pH 8.0),100mmol/L NaCl。
(2)10%SDS。
(3)蛋白酶K溶液(10mg/ml)。
(4)胰RNA酶溶液(10mg/ml)。
(5)饱和酚∶氯仿∶异戊醇=25∶24∶1(体积比)。
(6)氯仿∶异戊醇=24∶1(体积比)。
(7)TE缓冲液(pH 8.0):10mmo/L Tris-HCl,25mmol/L EDTA。
(8)3mol/L NaAc (pH 5.2)。
(9)预冷的无水乙醇和70%乙醇。
(10)PBS缓冲液。
3.设备 微量移液器(100μl,1 000μl),台式冷冻离心机,恒温水浴箱,手术剪,玻璃匀浆器,弯成钩状的小玻棒,1.5ml EP管。
【操作步骤】
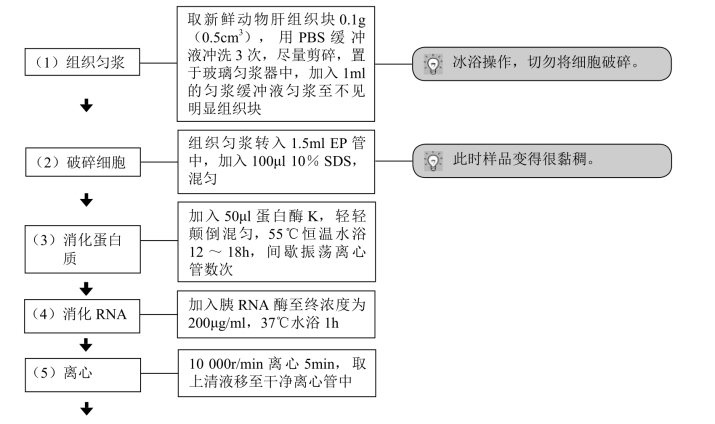
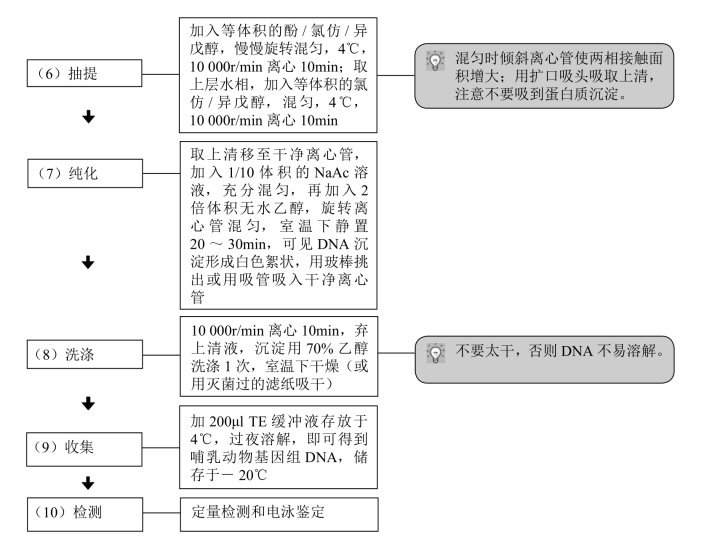
【注意事项】
1.选择的动物组织要新鲜,处理时间不易过长。
2.酚/氯仿/异戊醇抽提时,如果DNA含量过高,水相在下层,应注意观察;如果两相界面或水相中蛋白质含量多,可重复抽提多次。
3.取上清时,不应贪多,以防非核酸类成分干扰。
4.异丙醇、乙醇、NaAc、KAc等要预冷,以减少DNA的降解,促进DNA与蛋白等的分相及DNA沉淀。
5.若使用培养细胞提取基因组DNA,则1 500r/min离心5min收集细胞,用PBS冲洗1次,加入匀浆缓冲液后直接开始破碎细胞,细胞密度为109/ml的1ml细胞与1g组织的流程类似。
【结果与分析】
1.实验结果及分析 提取得到的基因组DNA经琼脂糖凝胶电泳、EB染色,在紫外灯下可看到一条带(图6-2)。
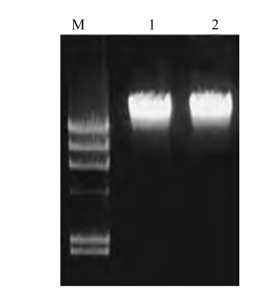
图6-2 绵羊的基因组DNA琼脂糖凝胶电泳图
M:Lambda-Hind Ⅲ ladder(梯状带,即分子量标准);1和2:绵羊基因组DNA
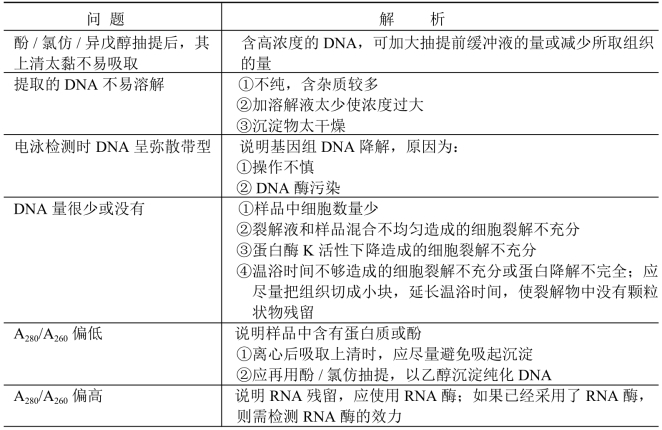
2.常见问题及解析 见表6-2。
表6-2 动物组织基因DNA提取的常见问题及解析
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。
















