一、大 鼠
(一)大鼠骨髓基质干细胞的获取模型
1.SD大鼠,体重300~350g,雌雄不拘。在无菌操作下,用骨穿针于每只大鼠的双股骨粗隆或胫骨结节内侧穿入骨髓腔,将预先已吸入100U/ml肝素0.2ml的5ml注射器套于骨穿针上,抽取骨髓1~2ml,用α-MEM稀释。采用密度剃度离心法分离MSC:先将与骨髓等体积的70%Percoll分离液吸入试管底部,再缓慢滴加骨髓,900r/min,离心30min。
2.SD大鼠戊巴比妥钠腹腔注射麻醉后,离断大鼠的单侧股骨、胫骨。于超净工作台上剪去干骺端,将骨髓冲入含体积分数为15%的FBS、1×108 mol/L地塞米松、50mg/L左旋维生素C、10mol/L磷酸甘油钠的α-MEM培养基中,置于37℃、体积分数为5%的CO2孵箱中培养,每3d换液1次。
3.将SD乳鼠置入75%乙醇中浸泡5min。于超净台上取顶骨,放入PBS皿中,刮除附着组织,待骨质发白、透亮,再放入PBS小瓶反复冲洗,换液3次,以0.1%Ⅰ型胶原酶消化30min后吸弃酶液,再以PBS冲洗3次后加入0.1%Ⅰ型胶原酶,将骨剪成1mm2大小,放置15min后加入与酶液等量的含15%小牛血清的DMEM培养基,吸取上清液,以1 000r/min离心10min,将下层液接种于50ml培养瓶,离心液去上清后接种于25ml培养瓶,分别加入上述培养基,置入37℃、5%CO2、饱和湿度培养箱内。每2d换液1次。
(二)裸鼠背部肌肉内植入模型
戊巴比妥钠经腹腔麻醉。于裸鼠颈背部和骶尾部各做长2cm小切口,切开皮肤及皮下组织,暴露肌组织,分开肌间隙,按实验分组将材料植入肌腹内,每只裸鼠颈部及骶尾部可植入多块材料,然后缝合切口。术毕将各组裸鼠放入无菌环境下分笼饲养。
(三)大鼠颅骨骨缺损动物模型
SD大鼠戊巴比妥钠腹腔注射麻醉后,将大鼠颅骨制成直径8mm的极量颅骨缺损或称临界骨缺损,植入细胞材料复合体进行修复。
组织工程研究中动物模型的选择在组织工程创立之初,最多采用的是裸鼠模型。裸鼠模型的特点是可以忽略细胞的来源及支架或载体材料与宿主之间的反应,直接研究动物体内建造组织工程化组织的可行性。由于裸鼠作为免疫缺陷动物,不能反映具有正常免疫功能的动物和人类体内的真实状况,从裸鼠模型所获取的资料需要其他动物模型的验证。因此,裸鼠模型仅限于组织工程研究的初级阶段。
二、兔
(一)兔骨髓基质干细胞的获取模型
取4周龄新西兰白兔,雌雄不限,常规消毒铺单,18号骨髓穿刺针于股骨大粗隆下抽取骨髓约2ml,缓慢注入含4ml淋巴细胞分层液试管内,2 000r/min离心25min,吸取中间单个核细胞层,pH值为7.2的Hanks液洗2次。用含100ml L-1小牛血清的RPMI 1640(USAGibco公司)作为培养液(含青霉素100μg/ml、链霉素100μg/ml、两性霉素B0.25μg/ml),将细胞密度调至2×106/ml,接种于培养瓶中于37℃恒温,50mg·L-1 CO2浓度,饱和湿度中培养箱培养。
(二)兔骨膜成骨细胞的获取模型
麻醉成功后,取2周龄新西兰白兔胫骨前内侧面骨膜2cm×4cm,标本经洗涤、剪碎,用0 25%胰蛋白酶和0 1%Ⅰ型胶原酶分步消化,收集细胞悬液接种于50cm2培养瓶,加入RPMI 1640培养液(内含15%小牛血清、100μg/ml青霉素和100μg/ml链霉素),置37℃、50%CO2、饱和湿度培养箱内培养。
(三)软骨细胞的获取模型
1.1日龄大耳白兔,用75%乙醇溺死,取四肢关节干骺端软骨切成10mm3大小,冲洗后以10倍体积Ⅱ型胶原酶(560U/ml)37℃消化,每隔1h取上清,离心收集软骨细胞,调整细胞浓度为36×106/ml,加入96孔板(10万/孔)。
2.新西兰大白兔(体重2.0~2.5kg,雌雄不限)。全麻下将实验组和对照Ⅰ组计16只兔一侧耳郭从根部切下,剥去皮肤及软骨膜,剪成0.1cm×0.1cm大小的碎片,以磷酸盐缓冲液(PBS,含青霉素200U/ml,链霉素200μg/ml)冲洗两遍,以去除残余血迹。然后加入两倍于软骨体积的Ⅱ型胶原酶(3mg/ml)在37℃恒温振荡器内消化。4~5h收获细胞1次,2~3次后软骨碎片完全溶解,细胞从基质中释放出来。
(四)兔关节软骨缺损的动物模型制作
5~6月龄日本大耳白兔或2~3月龄新西兰白兔,雌雄不限,体重2.0~2.5kg,麻醉,消毒铺单后双膝髌内侧纵切口约2cm,将髌骨向外侧脱位,显露髌股关节的股骨面,于股骨滑车中央用电钻钻出直径3~5mm,深3~5mm的全厚层关节软骨缺损。动物笼中自由活动(图9-1,彩图17)。
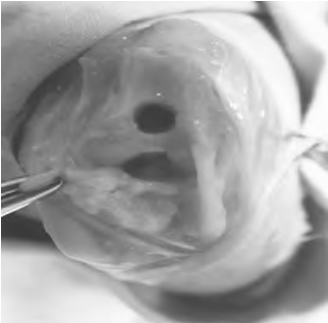
图9-1 兔关节软骨缺损的动物模型制作
(五)兔颅骨骨缺损动物模型的制作
3~4月龄新西兰兔,体重2.0~2.5kg,雌雄不限,肌注麻醉动物,无菌条件下暴露颅盖顶骨,用骨凿在顶骨两侧各造成1.5cm× 1.0cm的长方形全层骨缺损模型。
(六)下颌骨骨缺损动物模型的制作
新西兰兔,用8%硫化钠双侧颌下区脱毛,肌注麻醉,固定,消毒,铺无菌巾。沿左侧下颌骨下缘,切开皮肤皮下组织至骨膜表面,沿下颌骨下缘切开骨膜,暴露下颌骨。用牙科涡轮钻截骨,喷水降温,在下颌角前造成下颌骨15mm×8mm缺损。尽量去除骨膜,修剪锐利骨缘,冲洗,分层缝合伤口。
(七)尺桡骨骨缺损动物模型的制作
新西兰大白兔,前肢剃毛,戊巴比妥钠腹腔内注射麻醉,在前肢外侧切开皮肤、筋膜,直接暴露桡骨中段,用钢丝锯连同骨膜切除桡骨1.5cm,用无菌纱布尽可能吸掉骨髓,因尺骨完整,动物均不做内外固定,严密缝合软组织、皮肤。分笼饲养(图9-2,彩图18)。
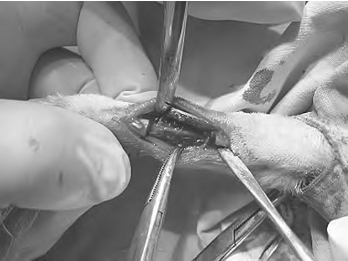
图9-2 兔尺桡骨骨缺损动物模型的制作
新西兰兔属于远交系动物,其实验动物学质量高于一般杂种动物。新西兰兔可以提供足够的骨髓基质细胞和软骨细胞,同时新西兰兔耐受力较强,故认为新西兰兔可以用于组织工程骨及软骨的研究。
三、羊
(一)山羊骨髓基质干细胞获取模型
山羊速麻安0.05ml/kg静脉麻醉,双侧髂骨处备皮后于严格无菌条件下16号骨穿针穿刺抽取红骨髓10ml,混入DMEM完全培养基(含青霉素及链霉素各100U/ml,20%新生牛血清)10ml,500U/ml肝素溶液抗凝,经4号针头反复抽吸,制成单细胞悬液。单细胞悬液混匀后1 500r/min离心15min后弃上清,过200目滤网,以3×106/ml细胞数接种入50ml培养瓶中,于37℃、5%CO2孵箱中培养,3天后半量换液,以后2~3d全量换液1次,倒置显微镜逐日观察,待细胞汇合成单层后以0.25%胰蛋白酶消化,记数,1×105/ml接种于培养皿中预先放置盖玻片,进行传代培养(图9-3)。
(二)山羊股骨骨缺损的动物模型

图9-3 原代培养山羊骨髓基质干细胞× 100
肌注氯氨酮后,山羊左侧卧位,备皮,颈静脉置管,静脉点滴抗生素。右后肢常规消毒、铺无菌巾,取股外侧手术入路,暴露股骨中段,线锯锯断股骨干。逆向打入导针至股骨大转子窝处,出皮肤,骨折处解剖复位后,选择长度适宜的髓内钉沿导针顺行打入股骨骨髓腔,拔出导针。通过瞄准器分别钻孔,依次在远端和近端旋入交锁用螺钉。或用钢板固定,检查固定牢固后,用线锯锯除中段2cm长左右的骨干及骨膜,生理盐水冲洗,放置细胞材料复合物,丝线扎牢。缝合伤口,不用外固定。羊放回笼内,常规饲养。
(三)山羊胫骨骨缺损的动物模型
山羊速麻安0.05ml/kg静脉麻醉,左侧后肢备皮,碘酒乙醇消毒,铺手术单。下肢前外侧弧形切口切开皮肤、皮下,沿胫前肌与胫骨间隙分开进入,保护深层的胫前血管及周围组织。于胫骨外侧放置已塑形好的AO 7孔窄动力加压钢板,除第4孔外,其余孔螺丝钉固定,不拧紧。环行剥离胫骨中段骨膜,于钢板第3、5孔之间,线锯锯断胫骨,切除该段对应的骨膜,拧紧加压螺钉,造成20mm的段缺性骨与骨膜缺损,逐层关闭。切口以无菌绷带包扎固定,常规换药,术后1周内每只动物肌注青霉素80万U/d,常规喂养高蛋白饲料,术后14d拆线,无异常后放养,任羊自由活动(图9-4,彩图19)。
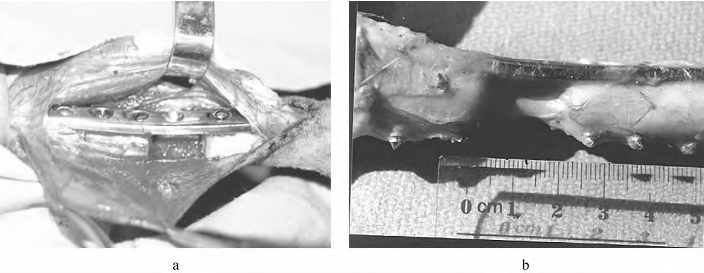
图9-4 原代培养山羊骨髓基质干细胞×100
注:a.山羊胫骨骨缺损的动物模型;b.植入体内12周后可见骨缺损未被修复
(四)筋膜瓣促血管化的动物模型
如上先制作骨缺损模型,固定钢板,在深筋膜的浅、深层锐性分离,注意保护真皮血管网,解剖出有较大血管蒂和完整血管网的深筋膜,观察血管蒂和血管网走行,保护主要血管蒂,修剪成50mm×30mm大小,将植入物纵行包裹一周,丝线缝合,露出植入物两端,嵌入骨缺损,操作中注意保证筋膜无张力、无扭转、无卡压,包裹的筋膜与远近端骨膜缝合固定(图9-5,彩图20)。

图9-5 解剖游离的皮下深筋膜可见丰富的血管网
普遍认为,动物实验中骨缺损的标准长度(critical size defect)应为其周径的1.5~ 2.5倍以上或为长骨长度的1/10以上。如何建立骨缺损的标准模型,一直是骨缺损动物实验研究中的首要问题。既往的实验研究大多采用鼠、兔等小动物作为研究对象,骨缺损处用克氏针简单固定,或者选择前肢尺骨或桡骨做缺损,这样另一长骨可作为相对固定。这两种模型不可能达到骨缺损处的牢固固定,缺乏动物实验观察过程中的规范统一性,不完全符合科学研究的基本要求,同时,小的骨缺损不利于骨移植和骨替代物的长期观察和深入研究。采用犬、羊或猿等大动物为实验对象,更接近人骨代谢和骨形成过程,选择股骨、胫骨等处做骨缺损模型,容许充填大块的骨移植和骨替代物,研究更接近于临床。
山羊与狗、猪相比具有易于管理、检测,四肢骨较长,操作方便等优点,国内外大多采用山羊。山羊股骨与胫骨都可以用作骨缺损模型,胫骨更符合要求,临床上骨缺损常伴有周围软组织损伤,血供不充分,因而骨缺损模型不宜在局部血供丰富的股骨制备,而羊胫骨上段有1/3无肌肉包围,直接位于皮下,中下段达到1/2~2/3,是比较合适的部位。羊胫骨骨缺损制备的长度报道不一,根据羊种属、研究目的等不同有30~50mm。还要考虑多个因素:①骨缺损不能自行愈合;②羊的年龄与个体大小;③骨缺损量的比例;④内固定因素。目前羊胫骨缺损不能自行愈合的长度尚无文献报道,缺损长度增加将带来固定困难、实验观察期延长等一系列问题。采用12月龄、体重14.5~15.5kg的中国青山羊,胫骨中段距胫骨结节45mm处按羊肢体长度与钢板长度制备20mm骨与骨膜缺损,7孔AO自动加压钢板固定。术后8周内放射性核素检测显示术侧的ROI放射记数无显著差异,摄取比值均小于1,说明成骨与血供少于正常侧,无早期成骨表现。12周内的X线与组织学检查都证实20mm缺损对于羊是不能自行愈合的,12周后髓腔几近闭合,更无愈合的可能。放置钢板是为将骨缺损处空出,充填生物材料/种子细胞复合物。倘用髓内针将占据骨缺损位置,用外固定架不便于术后管理,都不合适。经测量胫骨的长度(126±11)mm,中段横径(11±2)mm,7孔AO自动加压钢板长度为93mm,完全可以在不影响胫骨上下关节的情况下放置在胫骨干皮质段的外侧,塑形后与胫骨干能很好的贴服。钢板第4个孔空置,第3孔远端与第5孔近端之间的距离足以跨越20mm的骨缺损,不影响相邻螺孔的固定,远近截骨端与钢板远近端的长度各有35mm,3个螺钉固定,这样就构成了符合AO要求的桥形钢板,本实验按此制备的6例20mm骨缺损模型及随后的多例模型中,均未发生内固定失败。预实验中对30mm以上缺损用同样的内固定均失败。由于羊胫骨中段无明显的骨性标志,先截骨后固定很容易发生旋转与分离、短缩移位,本实验先在完整胫骨上固定钢板,后截骨,考虑自动加压产生的短缩移位,截骨时预留2mm,最后紧固。本实验模型确定了实验动物一般情况、操作细节,尽可能的减少了误差,具有可操作性、可重复性,是检验骨组织工程中生物材料/种子细胞复合物成骨能力较好的模型。
四、灵 长 类
(一)猴骨髓基质干细胞的获取模型
猕猴无菌条件下于胫骨结节抽取骨髓2ml,加入含肝素的DMEM液中,混匀后加入3ml的淋巴细胞分离液,离心(1 800r/min)10min,吸中间层细胞再离心,所得细胞沉淀以5×105~1×106,加入含15%的胎牛血清DMEM培养基中,于37℃、5%CO2饱和湿度条件下培养。待培养的细胞相互汇合到90%生长面积时用0.25%胰蛋白酶(Sigma公司)消化传代培养。传至第2代移入含10-8 mol/L地塞米松、10-2 mol/Lβ-甘油磷酸钠、50mg/L维生素C的无血清DMEM液再培养诱导2d,诱导后的细胞经表型检测证实为成骨样细胞(图9-6,彩图21)。

图9-6 原代培养猴骨髓基质干细胞×100
(二)猴桡骨骨缺损的动物模型
猕猴2~5岁,雄性10只,雌性7只,体重3.5~5.5kg,平均4.8kg。称重后用氯胺酮(10mg/kg)静脉麻醉。双侧前臂剃毛,消毒,于双侧前臂中下份沿桡骨做3cm纵行切口,肌间隙钝性分离显露,于桡骨中下段锯下2.5cm骨段连骨膜一起去除,制成骨缺损模型。将骨屑冲洗干净,将细胞材料复合物植入骨缺损处,钻孔,钢丝捆绑固定。分层缝合切口,伤口不包扎。术后用庆大霉素8万U肌注,2/d,共2d。术后严密观察猕猴精神状态、饮食、活动、伤口情况和全身反应。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。















