升温后泥炭孔水溶解有机碳浓度及其不稳定性:野外沼泽地增温试验
Evan S.Kane1 Lynn R.Mazzoleni1 Carley J.Kratz1 John A.Hribljan1
Christopher P.Johnson1 Thomas G.Pypker1 Rodney Chimner1 著 赵旋琪2 王江静2 赵红艳2 刘莎莎2* 译
(1 密歇根科技大学森林资源与环境科学学院 霍顿 MI 49931
2 东北师范大学地理科学学院 长春 130024)
摘 要:北欧和北美的研究表明,近几十年来水生生态系统中溶解有机碳(DOC)浓度不断增加。尽管关于其提高的机制还没有定论,但是一般认为其根本原因在于升温、降水变率增加和大气沉降变化等气候变化因素。本实验测试了增温对泥炭孔水组成的影响。在长达3年的研究中,通过在泥炭地上方1.24 m处安装红外灯,在泥炭地下5cm处进行监测,结果发现生长季各处理的平均温度(n=5)比对照处理高1.9±0.4℃,孔水平均DOC浓度比对照高出15%(t=5.03,p=0.007)。同时,在泥炭地下25cm处,生长季中各处理的孔水DOC浓度(73.4±3.2 mg/L)比对照处理(63.7±2.1 mg/L)高15%(t=4.69,p<0.001)。升温后的处理中,DOC分解速率是实验室内对照处理的2倍,芳香族化合物含量更低(增温后泥炭在254 nm处的吸光度降低)。溶解有机氮(DON)浓度变化规律与DOC一致,每单位C中溶解的N随着温度升高而下降。以往的研究表明,在这个实验地,增温使净初级生产力增加;同时,几丁质酶和葡萄苷酶的活性增加。本实验观察到,增温条件下DOC浓度增加,可能是因为根际微生物和植物相互作用的结果。探测到增温后出现较多的含有较高双键(DBE)的含氮化合物(通过超高分辨率离子电喷雾质谱鉴定达16%),这些化合物可能是植物、微生物和酶活性在增温后的产物。随着泥炭地温度升高,相对不稳定的DOC含量升高,这可能导致地表径流中DOC浓度增加,还可能作为有效的电子供体(或者受体)源使陆地和水生环境中的CO2和CH4增加。
关键词:泥炭 气候变化 细胞外的酶 溶解有机氮 溶解有机碳 杜鹃花科 苔草
Peat Porewater Dissolved Organic Carbon Concentration and Lability Increase withWarming:
a Field Temperature Manipulation Experiment in a Poor-fen
Evan S.Kane1 ,Lynn R.Mazzoleni1 ,Carley J.Kratz1, John A.Hribljan1 ,Christopher P.Johnson1 ,Thomas G.Pypker1,
Rodney Chimner write,Zhao Xuanqi2,Wang Jiangjing2,ZhaoHongyan2,Liu Shasha2* translate
(1 School of Forest Resources and Environmental Science,Michigan Technological University,Houghton,MI 49931
2 School of Geography Sciences,Northeast Normal University,Changchun,130024)
Abstract: Studies conducted across northern Europe and North America have shown increases in dissolved organic carbon (DOC)in aquatic systems in recent decades.While there is little consensus as to the exact mechanisms for the increases in DOC,hypotheses converge on such climate change factors as warming ,increased precipitation variability,and changes in atmospheric deposition.In this study,we tested the effects of warming on peat porewater composition by actively warming a peatland with infrared lamps mounted 1.24 m above the peat surface for 3 years.Mean growing season peat temperatures in the warmed plots (n=5)were 1.9±0.4℃warmer than the control plots at 5cm depth (t statistic = 5.03,p=0.007).Mean porewater DOC concentrations measured throughout the growing season were 15% higher inthe warmed plots (73.4 ± 3.2 mg/L)than in the control plots (63.7 ± 2.1 mg/L)at 25cm(t= 4.69,p<0.001).Furthermore,DOC from the warmed plots decayed nearly twice as fast as control plot DOC in laboratory incubations,and exhibited lower aromaticity than control plot porewater (reduction in SUVA254 in heated plots compared with control plots).Dissolved organic nitrogen (DON)concentrations tracked DOC patterns as expected,but the amount of dissolved N per unit C decreased with warming.Previous work has shown that warming increased net primary production at this site,and together with measured increases in the activities of chitinases and glucosidases we suggest that the increased DOC concentrations observed with warming were derived in part from microbial-plant interactions in the rhizosphere.We also detected more nitrogen containing compounds with higher double bond equivalents(DBE)unique to the warmed plots,within the pool of biomolecules able to deprotonate (16% of all compounds identified using ultrahigh resolution ion electrospray mass spectrometry);we suggest these compounds could be the products of increased plant,microbial,and enzyme activity occurring with warming.With continued warming in peatlands,an increase in relatively labile DOC concentrations could contribute to dissolved exports of DOC in runoff,and would likely contribute to the pool of efficient electron donors (and acceptors)in the production of CO2 and CH4 in terrestrial and aquatic environments.
[收稿日期]2015-11-10
[译者简介]赵旋琪,女,1994年生,在读本科生,主要从事自然地理方面的研究。*通讯联系人:刘莎莎,女,博士后,E-mail:liuss100@nenu.edu.cn。
Key words: peat;climate change;extracellular enzyme;dissolved organic nitrogen;dissolved organic carbon;Ericaceae;sedge
欧洲和北美学者研究表明,北方泥炭地和淡水水体中的溶解有机碳(DOC)浓度在过去20年里不断增加。类似北方泥炭地这样的生态系统中储存着大量的DOC,且DOC增速和死亡生物产生的有机碳在一个数量级上。DOC的储存与释放在碳循环中很重要,而且DOC浓度变化对水生生态系统的也产生重要影响,包括pH值、光强、与矿物的络合度和重金属的移动性、泥炭孔水电化学和微生物活性、食物网结构等。因此,弄清DOC浓度增加的直接驱动因子非常重要。
到目前为止,在各种生态系统中,仍然不确定哪些因素驱使着DOC浓度的增加。关于主要驱动机制的辩论聚焦到气候变化上,包括温度显著升高、大气沉降改变、降水或排水模式,以及大气中二氧化碳浓度增加等问题。关于陆地上水体DOC浓度增加不能确定的原因,主要在于难以区分是地表径流、水力传导率变化,还是土壤中DOC浓度变化引起的。类似的涉及景观温度梯度或者生物群落的研究指出,增温会使土壤DOC浓度不断增加。但在地表径流中,普遍认为温度对DOC浓度的直接影响是多方面的。尽管如此,泥炭地和其他集水地类型相比,仍然是DOC的输出源。加强泥炭地DOC浓度变化机理的认识,可以更好地理解已观察到的DOC变化,并预测其未来的变化趋势。
泥炭孔水DOC浓度主要取决于泥炭土DOC生产和消耗之间的差值,而且生产和消耗过程都可能随着北方有机土温度的增加而增加。升温后,根系分泌物、胞外酶种类与渗出活动、植物枯枝落叶增加和土壤浸出加剧,植物的生产力提高等等,都会引起DOC浓度增加;DOC的量随着死去的有机物质循环(因为温度升高)和可溶于水的分解物积累的增加而增加。DOC的矿化也随着温度增加而增加,其矿化速率依赖于DOC结构的变化。因为DOC是由微生物产生的,同时也是微生物的活动基质,所以DOC的产生和消耗之间的关系很难确定。在野外实验中,通过控制与温度共变的变量,来测定增温条件下驱动DOC浓度升高的特殊机制。
升温后,可溶于水的有机质的积累量因酶活性和微生物分解的减少而减少。微生物吸收的营养元素主要来自细胞外酶的释放,这些酶通过有机物的水解和氧化释放可以被微生物吸收的可溶于水的物质。用热力学第一定律可以解释酶活性因温度而变化问题,同时证明有机物质溶解与特定酶的活化能有直接的关系。此外,在北方泥炭地中,低气温条件下酶的敏感性更高。例如,Wallenstein等(2009)在模拟苔原带土壤水解酶(β-葡糖苷酶)活性实验中,温度变化解释了72%的酶活性变化现象。此外,Jassey等(2012)证明了被动式增温条件下,泥炭藓泥炭地中氧化酶活性(过氧物酶)增长了30%。迄今为止,在泥炭地生态系统中,酶活性对DOC浓度的直接影响可推测为,当酶的功能被抑制时,比如被有机分子络合或者有氧存在条件下,可以积累大量DOC。DOC和细胞外酶活性之间的关系可能存在着正反馈,当不稳定的DOC促进了水解酶增加时,DOC的数量也因水解酶的增加而增加。然而,以往的研究几乎没有调查原位温度如何影响水解酶和氧化酶的功能,以及这些酶如何反过来影响DOC浓度。
为了测试温度升高对孔水组成的直接影响,对美国密歇根州北部不典型的富营养泥炭沼泽地表进行加热,综合使用光谱指数法、泥炭孔水收集处理(考察矿化作用和酶活性)、离子色谱法和超高分辨率电喷射质谱法来证明我们的假设。假设由根际区微生物和植物之间的相互作用得到的DOC进入孔水中,这部分DOC的输入超过了其矿化作用造成的损失,导致在增温条件下孔水中的DOC含量和不稳定性增加。增温下水解酶和氧化酶的活性增强,可能使DOC浓度通过酚类化合物的循环而增加,或者升温可能导致氧气的溶解性变小或酚氧化酶的活性下降。我们还假设,在泥炭地的微观尺度中,因为热导率和相对水位变化,微地貌(小丘、平地或凹地)影响温度,进而影响DOC浓度。
1 方法与材料
1.1 研究地点与仪器
研究地点位于美国密歇根半岛苏必利尔湖滨(46.85 N,88.37W),海拔183 m。该泥炭地形成于2225年前苏必利尔湖上的一处连岛沙洲,泥炭地厚度约290cm,表层由莎草科植物和泥炭藓组成,下面为砂质土壤。该泥炭地的微地貌以丘和坪为主,植被类型以不典型的富营养泥炭沼泽为主(乔木有黑云杉和美洲落叶松;灌木包括甸杜、加茶杜香、山月桂、杨梅、越橘等;草本含圆叶茅膏菜、紫瓶子草、莎草科的3种苔草;苔藓有锈色泥炭藓、中位泥炭藓、疣泥炭藓等)。该地区的年平均气温和降水总量分别为4.5 ℃和833cm。
在丘和坪微地貌上随机选取10个2 m×1 m的样方,并随机划分为加热处理组和对照处理组。采用美国Kalglo电子有限公司红外线灯(1500W、165cm长)进行加热处理,用钢管在距离泥炭地表层124cm的沙土上方固定,分3个周期进行加温:2008年6~11月(数据未呈现),2009年5~12月,2010年4~10月。
在研究地安装了气温/相对湿度传感器和雨量计,每分钟记录一次数据,20次数据被划分为一组并求其平均值。在每个样点地下5cm处安装热电偶,并连接多路转换器和数据采集器。在地下1.5 m处,每隔一个小时通过直径10cm的PVC管道中的水位记录器和大气压力记录仪进行地下水位测量。在2010年的7~10月,通过手动水分传感器在每个样点的泥炭藓层下0~6cm和0~12cm处测量单位体积含水量。实验的所有温度数据均来自于Alberta福特森林研究中心,并与密歇根2009-2011年6~9月的生长季节温度和日平均气温数据对比。
1.2 孔水收集与分析
2009-2010年生长季,每2周收集一次孔水;2011年每月一次。使用的测压计是直径2.54cm的聚氯乙烯管,10cm长的槽状部分覆盖40 μm的尼龙网。槽口中心置于泥炭地下25~50cm处。取样前将测压计抽干并充电。为了保证样本纯度,先抽取少量孔水到收集瓶中进行预冲洗,每次收集大约150mL样品,在冰袋中冷存,然后带回实验室用0.45 μm的滤膜进行过滤(整个过程不超过1天)。过滤后,将样品分为3部分:(1)50mL水样酸化(pH为2)处理后,冷藏保存,用于分析DOC和TDN;(2)50mL水样冷冻保存,用于阴离子和有机酸分析;(3)10mL水样稀释(1∶10)后,用分光光度计测定λ=254 nm下样品的吸光度。用去离子水做空白对照(被酸化处理和未被酸化处理)(每15个样品做一次空白试验)。使用有机碳分析仪测定DON和TDN;使用离子色谱ICS-2000测定硝酸盐、乙酸盐、甲酸盐和草酸盐,铵盐测量采用分光光度法;溶解有机氮采用差值法;计算λ=254 nm条件下不同DOC浓度的紫外吸光度(SUVA),以L·mg/(C·m)作为单位;2010年夏天,用分光光度法量化总铁溶解度;测量整个生长季泥炭地下25~50cm的溶解氧(DO)及电导率。
1.3 超高分辨率ESI-FT-ICR质谱分析
分别取加热处理和对照处理样品各2个,样品于25cm处DOC浓度差别最大时(2009年第249天)进行采集。每个样品取10mL,经Strata-X固相萃取装置(预先用甲醇和乙腈处理)萃取,萃取装置用高纯水润洗后干燥。再用1.5 mL甲醇将DOC洗出。样品保存在-5℃备用,用于电喷雾傅里叶变换离子回旋共振质谱法(ESI-FT-ICR MS)对DOC结构进行分析。
用配备有ESI资源的7特斯拉FT-ICRMS仪器进行行超高分辨率质谱分析。分析时将溶液以4 μL/min的速率直接注入ESI接口,用甲醇稀释的方法对信号进行优化处理。将ESI探头放置在“B”位置,并将电压设置在-3.7 Kv和-3.8 Kv之间(空白在-4.0 Kv下运行)。每个样品测完后,用至少500 μL的甲醇/水(50/50)和100%甲醇水冲洗装置直至无样品信号为止。负离子质谱采集质量范围设为100<m/z<1000。质量分辨率设置为40000(以m/z 400定义)。实验过程中,为避免质量分析器过渡充满造成空间电荷效应,每次采样时使用自动增益控制法来保证向仪器中持续注入同样数目的离子(n=1×106)。另外,用十二烷基硫酸钠和牛磺胆酸标准溶液在负离子模式下对仪器进行外部校准,以保证准确度优于2 ppm。将收集到的200多个质谱保存在Thermo Xcalibur软件中。对样品进行重复测试。样品的信号强度及相对低丰度样品的信号重现性问题用重复分析方法处理。
超高分辨率FT-ICR MS数据用Sierra Analytics Composer软件进行分析。将记录在时间域中的200个样品一起加入,以提高样品的检测效果。分子量计算器设置可以计算高达70个碳原子,140个氢原子,25个氧原子和4个氮原子的分子。应用这种方法,曾获得更高氮原子数,但是这导致出现了大量化学上不可归属的不合理的分子式,而总的可归属的离子数目并没有显著增加。因此本实验选择保守的方法(N≤4)进行检测。基于PREDATOR算法,分子量计算器采用Kendrik质量分析法,将离子划分为CH2“同系物”,母体物分子式设定为≤500Da。这就是说,分子量大于500Da的分子要么被归属为≤500Da的母体物质同系物,要么便没有进行归属。分子量介于950<m/z<1000,取其平方根的6倍(RA≥0.4%)。包含一个13C同位素的物质的分子式也进行了归属和评价。使用相同方法分析空白样品,剔除测量误差大于3 ppm的分子式。通过2005年Koch等描述的方法,对归属的分子式进行进一步过滤筛选。
1.4 酶活性实验
选择9月初和10月末的孔水进行酶活性实验。采用Sinsabaugh等(2005)使用的96孔板法进行测定。每个样品做16次重复实验,每次重复实验包含200 μL孔水和50 μL泥炭基质。使用200 μM荧光基质估测水解酶活性,这些基质含有磷酸酶、β-葡糖苷酶(糖苷酶)、纤维二糖水解(纤维素酶)和N-乙酰基氨基葡萄糖苷酶(几丁质酶)等。水解酶活性测定用250 μL反渗透水做空白,校对空白的培养基由200 μL水和50 μL基质组成,用200 μL水和50 μL甲基7-羧基香豆素做空白抑制实验。每批实验8次重复。通过测定酚氧化酶和过氧化物酶活性的方法估测氧化酶活性。每个样品16次重复,空白8次重复。过氧化酶活性将10 μL的H2O2加到所有孔中,在室温下培养。水解酶样品培育2 h,然后将10 μL 1.0 M的氢氧化钠加入到每个孔中。将多功能M2酶标仪在364 nm下激发,在450nm波长下发射,进行荧光测量。氧化酶样品室温培育24 h,在450nm下测量其吸光度。根据German等(2011)的方法计算酶活性。
1.5 孔水培养
2010年5月,分别取3个加热样点和对照样点地下25cm处收集孔水150mL。所有样品经过前文所述方法进行过滤,将30mL水加入60mL进行了预清洗和漂洗的高密度聚乙烯瓶中(每个水样分装在5个瓶中,共计30瓶)。根据Wickland等(2007)描述的方法,将1 mL的孔水接种液经过孔径1.6 mm的玻璃纤维过滤后,移到每个瓶子中,在20℃下培育0、7、14、21和56天,每批取6个瓶子(处理和对照各3个),酸化到pH=2,然后进行DOC和TDN浓度测定。
1.6 统计分析
使用混合效应程序分析加热样点和对照样点孔水DOC、DON和SUVA254差异性。加热措施、加热深度、微地貌(丘、洼和坪)、一年的天数、年份、深度和温度的相互作用被视为固定因素,样点数目视作研究对象,一年的每一天视作重复措施。通过拟合统计、Kenward与Rogerd校正自由度,使用方差分量对称协方差结构进行重复测量分析。固定效应在Ρ<0.05时具有显著效应。通过协方差分析考察DOC和DON随温度变化的显著性。数据处理使用最小二乘法和t检验。
2 结果
2.1 温度对于DOC浓度的影响
分别于2009年和2010年的6~8月对泥炭地不同深度样点的温度进行测量。结果显示,泥炭地下5cm处加热样点温度(18.4±0.2℃)比对照样点温度高1.9 ℃(t=5.03,p=0.007)。在地下5cm处任何时间,小丘或草坪微地貌上的样点泥炭温度没有显著不同(t=0.18,p=0.86),但在6月份和7月份,小丘与平地温度可以观测到相反的趋势(图1e,图1f)。2010年的生长季,加热样点(16.6±0.2℃)和对照样点(16.3±0.1℃)地下42cm处的平均温度没有显著差异。地下50cm处的平均季节性溶解氧浓度为1.1±0.8mg/L,平均电导率为53.1±4.7 μS/s,且随着温度升高,可溶于水的O2含量下降(r=-0.69,F1,14=11.98,p=0.004)。

图1 泥炭地下5cm处加热样点和对照样点每小时平均温度集结性变化差异
Fig.1 Seasonal differences between the mean hourly peat temperatures (5cm)of plots heated with infrared lamps and unheated control plots.Negative values in pane (a)indicate periods when the heated plots were actually cooler than the control plots
注:(a)中负值表示加热样点比对照样点冷。
2009年生长季(5~9月)降水是343mm,2010年生长季降水量是483mm。然而,2009年(13.7±3.2 cm)和2010年(16.4±3.1 cm)的地下水位深度并没有变化(t=1.90,p=0.15)。2010年7月(77mm)相比于2009年7月(47mm)降水量增长了40%,但这2个月平均地下水位深度基本相同,分别是15.2±2.5cm和16.8±1.4 cm。在整个生长季,地下6cm处与地下12cm处泥炭水分含量没有显著差异(分别是t=0.45,p=0.66和t=0.34,p=0.74)。
2009-2010年的所有取样时间,加热样点(73.4±3.2 mg/L)泥炭地下25cm处的泥炭孔水DOC平均浓度相比于对照样点(63.6±2.1 mg/L)高15%(t=4.69,p<0.001)(图2)。在2009年,孔水的月平均DOC浓度(69.9±2.0 mg/L)没有显著差异(t=1.01,p=0.35)。但在2010年,差异明显(t=4.47,p=0.001)。根据季节变化可以得出,升温对于DOC浓度有着明显的影响(表1)。事实上,加热样点月平均DOC浓度的增长与泥炭地升温相联系(图3),且DOC和泥炭温度的最大增长发生在生长季后期(8月和9月)。年份(图2)、深度和微地貌(小丘或草坪地貌)对DOC浓度影响不大(表1)。在2011年6~10月,未进行红外线灯加热条件下,加热样点和对照样点在泥炭地下25cm处的DOC含量没有任何不同。
表1 可溶性有机碳(A)和可溶性有机氮(B)的预测值的综合性影响模型
Tab.1 Mixed-effects model of predictors of (A)dissolved organic carbon and (B)dissolved organic nitrogen
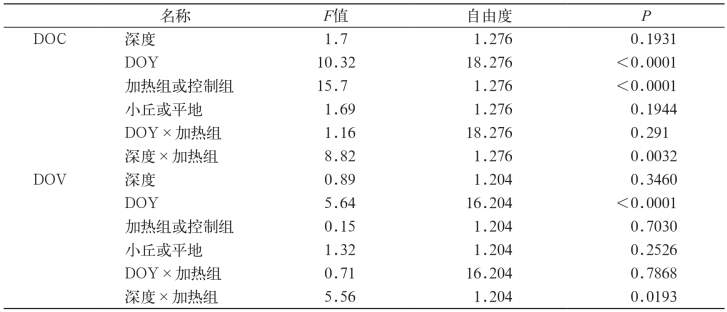

图2 2009-2010年地下25cm(图表上部)及50cm(图表下部)处加热样点和对照样点日平均DOC浓度变化
Fig.2 Mean daily DOC concentrations for heated and control plots at 25cm (top pane)and 50cm (bottom pane)throughout 2009-2010
注:误差线代表标准误差的平均值。下同。
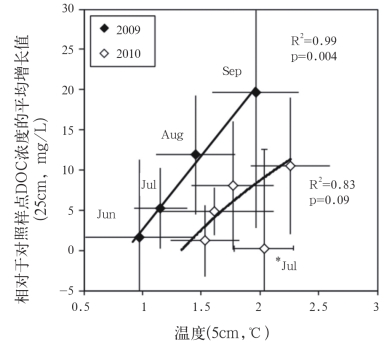
图3 地下25cm处孔水DOC浓度月平均增长值比较
Fig.3 Mean monthly increases in peat temperature are compared to mean monthly increases in porewater DOC concentrations at 25cm
注:*表示相对强降雨时期回归线外的回归点(标准差=1.32)。
2.2 温度影响孔水成分和质量
由于温度升高,DOC发生明显改变,DON改变不明显,这导致不同的DOC∶DON比率。当DOC和DON随季节改变表而发生变化时,加热对于所有样点孔水DON含量没有直接影响(表1)。根据所有数据(t=2.37,p=0.03),地下25cm处加热样点(1.31±0.06 mg•N/L)相对于对照样点(1.20±0.06 mg·N/L),DON浓度增长,而地下50cm处(t=1.14,p=0.27)则无显著差异,所以加热和深度的相互作用解释了DON浓度的变化(表1)。如同预期那样,DON浓度随着DOC浓度增长,加热和DOC之间的边缘效应解释了DON的变化(F1,240=2.90,p=0.09,图4)。通过协方差分析(ANCOVA)计算DOC和DON的相关性,在任何样点深度,加热对于DON浓度都有微弱但重要的影响。同样,加热样点每单位DOC中DON数量比对照样点较低(图4)。所有样点平均DIN浓度较小(0.08±0.02 mg•N/L),加热样点和对照样点无明显差异(t=1.06,p=0.29)。
加热明显降低孔水芳香性(图5)。孔水芳香性随着深度和季节变化,也随着加热而发生变化,而且还是DOC∶DON比率的协变量(表2)。加热样点(2.1±0.4mg/L)和对照样点(1.6±0.2mg/L;t=1.55,p=0.16)可溶性铁的平均浓度不同,由此带来的任何潜在铁干扰对SUVA254的影响很小。此外,在为期2个月的实验室模拟的前3周,加热样点的指数分解系数是-1.8×10-3±8.4×10-4,对照样点是-8.0×10-4±3.7×10-4(图6),加热样点的DOC分解速度是对照样点的2倍。培育56天时,DOC分解系数与加热样点(-8.6×10-4±3.2×10-4)和对照样点(-9.2×10-4±1.1×10-4)收集的孔水差异不大。
令人惊讶的是,SUVA254与DOC∶DON比值呈负相关(r=-0.47,p<0.001;表2)。实验结果表明,加热处理的样品高DOC浓度与本身脂肪族含量高及更高的C∶N比有关。超高分辨率质谱仪显示,相对小分子量的组分能够去除质子化。加热处理这些化合物(分子量在200~800间),引起的孔水成分变化不大。加热后这些化合物中H∶C比更低,DBE更高,缩合度也增加,氧化程度相降低(图7,图8)。加热样点DOC组成的1545种生物大分子中,17%是蛋白质和碳水化合物;而对照样点1516种生物大分子中8%是氨基糖类。加热样点的孔水中有更多带有芳香性化合物性质的生物分子,且35%的生物分子种类显示出AI>0.5。加热后,3种有机酸发生不同程度的改变,且有些没有明显的统计意义。用最小二乘法进行数据处理,结果显示,加热处理没有使醋酸浓度发生明显变化(从0.32mg/L下降到0.16mg/L,F1,244=1.80,p=0.18),但加热处理导致甲酸盐(对照样点平均浓度0.10mg/L,加热样点平均浓度0.12mg/L,F1,244=2.04,p=0.16)和草酸盐(平均浓度从0.20mg/L增到0.26mg/L,F1,244=2.25,p=0.14)发生变化。醋酸浓度随着泥炭地深度增加(泥炭地下25cm到50cm)而增长(从0.06mg/L到0.42mg/L,F1,244=7.90,p=0.005)。
表2 波长254 nm下紫外线吸光度预测值的综合性影响模型[SUVA254;L•mg/(C•m)]
Tab.2 Mixed-effects model of predictors of specific ultraviolet absorbance at 254 nm [SUVA 254;L•mg/(C•m)]
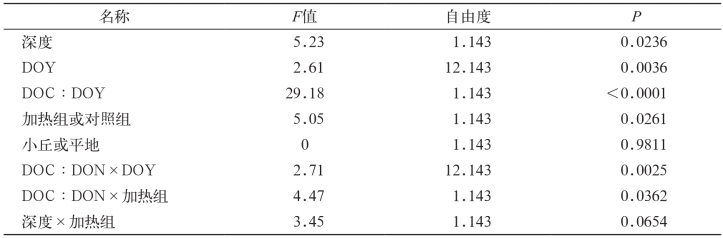

图4 加热协方差分析中DON和DOC的斜率关系
(F1,240=4.19,p=0.04)
Fig.4 The slope of the relationship between DON and DOC declined with heating in analysis of covariance
(F 1,240 = 4.19,p = 0.04)
注:加热样点变化趋势系数为β0=0.38±0.09,β1=0.013±0.001,对照样点变化趋势系数β0=0.18± 0.13,β1= 0.017±0.002。
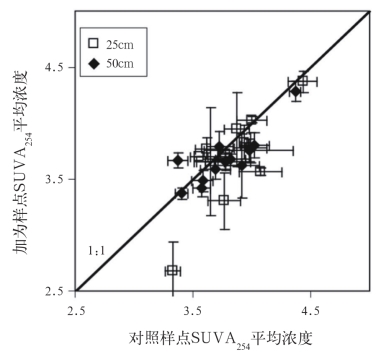
图5 加热样点日平均紫外线吸光度波长254 nm[SUVA 254;L·mg/(C·m)]时得到的值比对照样点低(t=2.76,p=0.011)
Fig.5 Mean daily porewater Specific Ultraviolet Absorbance at 254 nm [SUVA254;L·mg/(C·m)]measurements were lower in heated plots than in control plots across all depths and sampling days (t=2.76,p=0.011)
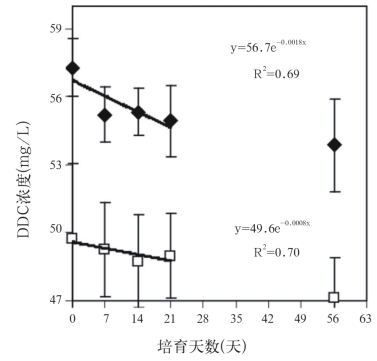
图6 实验室孵化56天DOC减少
Fig.6 Reduction in dissolved organic carbon over a 56 day laboratory incubation
注:每个点代表3个加热样点(不透明菱形)或3个控制样点(正方形)的孔水平均DOC浓度。前21天可以建立负指数关系。误差线代表标准误差的平均值(n=3)。

图7 O∶C、H∶C、N∶C的平均加权相对丰度以及样品中所有分子式的DBE和所测样品的特定分子式
Fig.7 Mean weighted relative abundances of O:C,H:C,N:C and the DBE of all molecular for mulaspresent in the sample,and of the molecular formulas unique to a given sample
注:数据表示地下25cm,同一天在2个加热样点和2个对照样点收集到的被标定的分子式(n=2)。
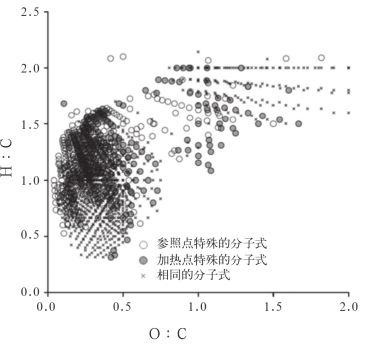
图8 加热样点和对照样点的孔水Van Krevelen图
Fig.8 Van Krevelen diagram of porewater harvested from two heated and two control plots
注:灰色点(●)和白色点(○)分别表示加热样点和对照样点生物大分子种类的成分。时间描绘点表示所有孔水相同的生物大分子种类。
2.3 酶活性
由表3可知,孔水细胞外酶活性受到加热处理和季节影响,特别是几丁质酶和葡萄糖苷酶,平均活性分别增加了58%和138%(p=0.005和p=0.03)受到增温的影响显著,纤维素酶、酸性磷酸酶和苯酚氧化酶活性显示出季节性变化,但并没有因为升温发生变化(表3)。纤维素酶在叶片衰老期,无论加热与否,其活性均增长(p=0.002)。磷酸酶和苯酚氧化酶在生叶期活性较高(分别为p=0.004和p=0.002)。
表3 夏末加热样点及对照样点孔水酶活性的改变及衰老控制(±平均标准差)
Tab.3 Changes in porewater enzyme activities (25cm depth)in late summer and following senescence in both control and heated plots (±standard error of the mean)

注:除苯酚氧化酶和过氧化酶的单位是umol/h,其余单位均为nmol/h。加粗字体表示由设备及季节所引起的巨大差异(α=0.05)。
3 讨论
3.1 温度对DOC的浓度和成分的影响
本实验加热造成DOC浓度的增加是可以预测的,因为分解产物和源于生物的DOC都可溶于水,它们会随着温度的升高而增加,这是因为分解物的分解速度和微生物的活性都依赖于温度。本实验观察到季节对DOC的浓度产生强烈影响,这和许多研究成果一致。在植物生长季,孔水DOC的浓度可以反映温度、植物生长和微生物活性的变化。2011年生长季的温度比2010年或2009年都高。与此一致的是,2011年所有观测点孔水DOC的浓度比2009-2011年间高出22%。在2011年观测到DOC浓度的增长和受热过后泥炭地中DOC浓度的增长是相似的。这项研究的一个创新方面是,升温影响下DOC浓度升高独立于时间变量,这个影响已经被证实。研究证实,2011年在没有红外线灯加热条件下,加热之前DOC浓度和对照相同。实验观察到,随着第二年的加热处理,尽管在50cm处温度都没有发生显著的改变,但在更深的孔水中,DOC的浓度有差异。这也揭示了加热除了引起孔水向下扩散之外,还对植被产生了影响,使其根部微生物和根系活动产生相互作用。在以往的一个高山泥炭地中进行3年被动增温实验模拟研究中,枯枝落叶层中微生物群数量的增长影响了水化学性质。Jassey等(2012)指出,泥炭藓的多酚和升温之间的相互作用,可能会增加营养物浓度并释放溶解的碳。在本实验高山泥炭地的研究中,被动增温对DOC和TDN浓度的影响有差异。在第三年的实验中,增温仅对DOC浓度有显著影响,而对TDN浓度没有影响。除此之外,这些研究结果与本文普遍比较吻合。这证明对泥炭地表进行适度的增温可以直接影响DOC的浓度,间接影响微生物活性和孔水特性。
植物根部和微生物释放出来的腐殖质(更多为脂肪族)分子量比分解产物中可溶于水的物质(芳香性化合物)分子量相对低。本研究中,泥炭孔水中的相对芳香性在升温后下降(表2、图5),但是适度的升温没有明显改变泥炭地表能去除质子化的那些生物大分子(~200~800Da)的特性。加热处理产生的化合物中H∶C和O∶C的比率小(图8),揭示其是一个更加具有芳香性或者浓缩结构的可溶有机物质(DOM)。然而这些数据和SUVA245数据不一致,表明在加热条件下,大部分孔水中的成分发生变化,特别是其中化合物的变化,还不能很好地被超高分辨率的质谱仪检测到。相对不稳定的低分子量的DOC浓度上升和提高了微生物活性有关。加热处理后,新形成的化合物与微生物产生的腐植酸或者多糖的成岩作用(富氧生化)增加有关,导致在相对大分子量的DOM中,H∶C和O∶C比率降低。虽然解释这些数据并不容易,但因为主要的大分子最初是来自泥炭地的植被,而藓类很快被分解为小组分,这种转变在较高的温度下更容易进行。在本研究中,加热样点和对照样点中新化合物DBE数量普遍降低,并且不饱合化合物和/或者氧化物的含量也下降,说明化合物在这2种环境中都更加不稳定。FT-ICR MS数据和孔水平均浓度分析结果一致,并且新化合物中N∶C比率逐渐增加,DBE量也相应增加(图7)。这个结果与没有加热的对照样品N∶C和SUVA245增高一致。高的N∶C比(即高的芳香性)可能与羧基与胺的络合作用或蛋白质同酚基的络合有关,很可能是升温后随着大分子的腐植酸类物质进一步分解,或者是低分子量的物质含量增加,导致含蛋白质的化合物与DOM的结合性降低。今后研究需要运用新兴的液相色谱法和质谱分析法,并结合野外模拟实验,弄清DOM如何随着全球变暖而发生变化。本实验同时证明了气候变暖下泥炭地不同分子量大小DOM的产生和消失机制不同。
在本研究中,增温导致了脂肪族DOC相对增加,而DON变化没有达到显著水平(表1B、图4)。研究显示,DOC中脂肪族和芳香族的比例在水生环境中普遍偏高,同时DON相对于DOC上升。在DOC中的芳香性结构物质多数来自于植物的木质素降解(也可能来自焚烧产物)。而脂肪族的DOC大都来自细菌、藻类和根区的渗出物。
实验观测到芳香类的DOC与DON之比随着温度升高而降低,这可能是含氮生物分子没有从根区内渗出,或可溶性氮很快被固定。由于微生物中木质素的缺乏和温度升高引起SUVA254降低等事实,证明了温度升高所引起的DOC浓度增长是因为植物和植物根内微生物的相互作用,而并非有机物质的分解。这个结论与前人在北方泥炭地的研究一致,指出孔水的DOC具有多变性,与根区的现代碳有关,尤其当莎草发育良好,其现象更加明显。对该点的综合研究表明,以丘为主的地块升温引起生态系统初级生产力增长,但呼吸作用无明显差异。总之,本研究结果表明,温度升高下DOC浓度的增长来源于植物和植物-微生物相互作用,而不是有机物质分解堆积。
3.2 温度影响孔水的酶活性
升温处理后,孔水中细胞外酶,如几丁质酶和葡萄苷酶活性产生了分异,纤维素酶、磷酸酶和酚氧化酶的活性因季节而变化,这证明了酶的代谢依赖于周围环境。几丁质酶是消耗碳和氮的酶,因为加热条件下氮循环的速率加快,可能导致其活性增强。这个结论在温带森林研究中已经得到了证实。在北极苔原冻土中,温度是影响水解酶活性的主要驱动因子。几丁质酶的产量或者几丁质酶的活性随着温度的增加而增加。真菌主要产生了几丁质酶,在苔原生态环境中真菌丰度随着温度的增加而增加。Allison和Treseder(2008)发现,全球变暖导致北方针叶林真菌丰度和几丁质酶的活性下降,然而他们的实验没有将温室效应影响下降水减少、有机土层变干的因素区分出来。本研究运用红外线灯,不会阻碍降水水分进入土壤中。通过对全世界32个不同泥炭地的研究,Kang等(2005)证实,与固相泥炭有关的几丁质酶(N-乙酰葡糖胺糖苷酶)活性随着年平均温度升高而增加。尽管他们提出的温度量级比本研究(表3)中要高,这个结论证明在泥炭地中固相的或溶解的有机碳中几丁质酶的活性随着温度的增高而相应增加。
葡萄糖苷酶的活性在升温后也提高,这可能是由于升温后可用的基质多或者孔水中葡萄糖苷酶数量或效率发生改变。既然脂肪族化合物和DOC浓度随着温度升高而升高,葡萄糖苷酶分解的多糖浓度就可能增加。此外,温度升高可能会引起酚类物质的积累,但苯酚氧化酶活性没有增加,这与水位波动和供氧环境改善等有关。总之,本实验数据表明,温暖气候下水解酶活性的增加将会促进DOC浓度增加,这与Freeman等(2001)报道的温度是影响径流中DOC浓度上升的观点相吻合。
本实验观测到水解酶和氧化酶活性具有季节性变化。相比于叶片衰老期,磷酸酶活性在生叶期更高,这表明嗜磷的酶或有较多可利用的基质材料、或具有更高的丰富度、或在早期有特殊的活性。苯酚氧化酶活性在生叶期更高,说明苯酚氧化酶或有较高的丰富度、或活动效率、或有更高的多元酚浓度。尽管我们仍然不清楚内部机制,但可能是由于酚氧化酶种类较多且有季节变化造成。以往的一处高山泥炭地的研究表明,过氧化物酶的活性随着温度升高而提高,这比酚氧化酶的活性高出3个数量级。本实验结果显示,9月份的氧化酶活性比10月份高,但我们并未观测到酚氧化酶和过氧化物酶活性有显著差异,且加热对氧化酶活性也没有显著影响。本实验测量孔水中的酶活性,与泥炭地固相有联系的氧化酶,相比于与溶解有机物相联系的自由浮动的胞外酶对环境变化更加敏感。纤维素酶活性在叶片衰老期比生叶期提高,可能是结构复杂的多糖浓度在落叶期增加,也可能是结构简单的多糖在此时下降。需要更多的关于此类化学物质的相对丰度数据,进一步探讨承载酶的基质浓度对孔水酶活性的影响。
4 结论
经过2年的升温实验,发现泥炭地孔水DOC浓度上升,芳香性化合物轻微下降,而且升温引起水解酶活性提高。针对该地区早期研究结果显示,随着温度升高,生态系统初级生产总量增加,而呼吸作用几乎没有变化。本实验观测到孔水性质的改变与提高植被生产力和增长微生物活性保持一致。此外,还观测到在未加热对照样点中DOC∶DON的比值增长与更高的芳香性基本对应。加热样点新出现的化合物有更高的N∶C和DBE值。然而,所有这些化合物的DBE含量都少于加热样点和对照样点的常见化合物。这些数据暗示气候对泥炭地和孔水化学作用影响较大,使不同分子量的生物分子形成和发展具有不同的结果。总之,这些数据支持了在未来几十年内,随着温度升高,DOC浓度在有机土中可能增长,进而引起孔水DOC浓度增加,且可能会有助于DOC进入径流中,成为陆生和水生环境中产生CO2和CH4的电子供体和受体。
今后我们将进一步考察升温后DOC是被矿化还是进入径流中,这对于我们理解温度对土壤中DOC浓度的影响十分必要。
参考文献(略)
译自:Biogeochemistry,2014,119:161~178。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。















