实训40 药品微生物限度检查
一、实训目的
(1)学习并掌握药品微生物限度检查的一般程序。
(2)熟练掌握平板菌落计数法和大肠杆菌快速检验法。
二、实训原理
微生物限度检查法是检查非规定灭菌制剂及其原、辅料受微生物污染程度的方法。检验项目包括细菌数、霉菌数、酵母菌数及控制菌检查。控制菌包括大肠杆菌、大肠菌群、沙门氏菌、铜绿假单胞菌、金黄色葡萄球菌、梭菌。微生物限度检查应在环境洁净度10000级下的局部洁净度100级的单向流空气区域内进行。检验全过程必须严格遵守无菌操作,防止再污染。
在药品生产企业中,一般口服制剂的微生物限度检查主要检测三个指标:细菌总数测定、霉菌总数测定和控制菌大肠杆菌的测定。
细菌总数是指规定单位的非规定灭菌药品制剂中污染活细菌的数量。霉菌总数是指规定单位的非规定灭菌药品制剂中污染霉菌的活菌数量。细菌数或霉菌数越多,表明药品受到致病微生物污染的可能性以及药品制剂变质的可能性越大,安全性越差。测定细菌总数和霉菌总数是对生产单位药品原辅料、器具设备、工艺流程、生产环境和操作者卫生学评价的综合依据。
大肠杆菌是人和温血动物肠道中的常住菌,随粪便排出,可直接或间接污染药品及药品生产的各个环节。该菌是人类重要的条件致病菌,常引起各种肠内外感染,某些特殊菌株是腹泻和泌尿道感染的重要细菌。药品中检出大肠杆菌表明该样品已受到粪便污染,服用后可能被粪便中存在的肠道致病菌或寄生虫卵等病原体感染。
口服制剂的卫生标准如下。
(1)中药固体制剂。
①不含生物原粉的制剂:细菌总数不得超过1000CFU/g,霉菌总数不得超过100 CFU/g,大肠杆菌不得检出。
②含生物原粉的制剂。
片剂:细菌总数不得超过10000CFU/g,霉菌总数不得超过500CFU/g,大肠杆菌不得检出。
丸剂:细菌总数不得超过50000CFU/g,霉菌总数不得超过500CFU/g,大肠杆菌不得检出。
散剂:细菌总数不得超过10000CFU/g,霉菌总数不得超过500CFU/g,大肠杆菌不得检出。
(2)中药液体制剂。
细菌总数不得超过100CFU/mL,霉菌总数不得超过100CFU/mL,大肠杆菌不得检出。
(3)化学药固体制剂。
细菌总数不得超过1000CFU/g,霉菌总数不得超过100CFU/g,大肠杆菌不得检出。
(4)生化药固体制剂。
细菌总数不得超过1000CFU/g,霉菌总数不得超过100CFU/g,大肠杆菌不得检出。
(5)化学药或生化药液体制剂。
细菌总数不得超过100CFU/mL,霉菌总数不得超过100CFU/mL,大肠杆菌不得检出。
三、实训器材
1.设备
超净工作台,高压蒸汽灭菌锅,电炉,恒温水浴锅,微波炉,菌落计数器,匀浆仪,紫外检测器,生化培养箱。
2.仪器与用具
φ90mm培养皿,锥形瓶(250mL、500mL),吸管(1mL、10mL),试管,烧杯,玻璃棒,量筒,漏斗,接种环,记号笔,酒精灯,天平,研钵。
3.培养基与试剂
营养琼脂培养基,玫瑰红钠琼脂培养基,胆盐乳糖增菌液,MUG培养基,柯氏试剂,伊红美蓝琼脂培养基,NaCl,蛋白胨,KH2PO4,K2HPO4。
4.检验样品
口服固体制剂(冲剂、片剂、胶囊剂等)。
四、实训步骤
1.实训准备
(1)φ90mm培养皿10个,包扎。
(2)1mL吸管4支,10mL吸管2支,玻璃棒1支,分别包扎。
(3)250mL烧杯1个,试管3支,100mL量筒1个,研钵1个,分别包扎。
(4)称量纸若干,包扎。
(5)pH 7.0NaCl-蛋白胨缓冲液(稀释液)200mL 1瓶。
配方:KH2PO43.56g,K2HPO47.23g,NaCl 4.30g,蛋白胨1.0g,水1000mL。
制备:称取上述各成分,微温溶解,滤清,分装于锥形瓶中,包扎。
(6)营养琼脂培养基200mL 1瓶,包扎。
依照营养琼脂培养基试剂瓶上说明方法配制。
(7)玫瑰红钠琼脂培养基200mL 1瓶,包扎。
依照玫瑰红钠琼脂培养基试剂瓶上说明方法配制。
(8)胆盐乳糖(BL)增菌液100mL 3瓶,包扎。
依照胆盐乳糖培养基试剂瓶上说明方法配制。
(9)伊红美蓝琼脂培养基100mL 1瓶,包扎。
依照伊红美蓝琼脂培养基试剂瓶上说明方法配制。
上述(1)~(9)准备好后,均置于121℃高压灭菌20min。
(10)MUG培养基5mL 4支,包扎。
依照MUG培养基试剂瓶上说明方法配制,置于115℃高压灭菌20min。
(11)菌液制备。
接种大肠杆菌的新鲜培养物至营养琼脂培养基中,置30~35℃培养18~24h,上述培养物用0.9%无菌NaCl溶液制成1mL含菌50~100CFU的菌悬液,用作阳性对照。
2.操作步骤
1)供试液的制备
称取10g供试品,加灭菌的pH 7.0NaCl-蛋白胨缓冲液至100mL,用匀浆仪或灭菌研钵研磨等适宜方法,混匀,作为1∶10的供试液。必要时加适量的无菌聚山梨酯80,并置水浴中适当加温使其分散均匀。
2)细菌总数、霉菌及酵母菌数检查
(1)稀释和加样。
一般采用3个稀释级。
无菌操作,将灭菌pH 7.0NaCl-蛋白胨缓冲液分装于2支灭菌试管中,每支9mL,取1mL灭菌吸管吸取混匀的1∶10供试液1mL,沿管壁注入装有9mL无菌pH 7.0 NaCl-蛋白胨缓冲液的试管中,混匀,制成1∶100稀释液。再用同一吸管分别吸取1∶10供试液1mL注入4个培养皿中。
以另一支1mL灭菌吸管吸取混匀的1∶100供试液1mL,沿管壁注入另一支装有9 mL无菌pH 7.0NaCl-蛋白胨缓冲液的试管中,混匀,制成1∶1000稀释液。再用同一吸管分别吸取1∶100供试液1mL注入4个培养皿中。
然后再取第三支1mL灭菌吸管分别吸取混匀的1∶1000供试液1mL注入4个培养皿中。
另取1支1mL灭菌吸管分别吸取1mL灭菌pH 7.0NaCl-蛋白胨缓冲液注入4个培养皿中,做空白对照。
(2)培养基注皿。
先将熔化后冷却至约45℃的营养琼脂培养基注入培养皿中,每个稀释度和空白对照注入2个培养皿,每皿约15mL,随即转动培养皿,使样液与营养琼脂培养基混匀后置于超净工作台上待凝。
另将熔化后冷却至约45℃的玫瑰红钠琼脂培养基注皿,每个稀释度和空白对照注入另2个培养皿,方法同上。
(3)培养。
待培养基凝固后,将营养琼脂平板倒置于30~35℃培养箱中,培养(48±2)h,将玫瑰红钠琼脂平板倒置于23~28℃培养箱中,培养(72±2)h。
细菌总数检验程序如图3-38所示。

图3-38 细菌总数检验程序示意图
霉菌及酵母菌数检验程序如图3-39所示。
3)大肠杆菌检查
(1)BL增菌培养。
吸取1∶10供试液10mL,加入到100mL胆盐乳糖增菌液内,置于(36±1)℃培养18~24h。同时做阴性对照试验和阳性对照试验。

图3-39 霉菌及酵母菌数检验程序示意图
阴性对照试验:吸取1∶10稀释液10mL,加入到100mL胆盐乳糖增菌液内,置于(36±1)℃培养18~24h。
阳性对照试验:吸取1∶10供试液10mL和1mL含菌量为10~100CFU的大肠杆菌菌悬液,加入到100mL胆盐乳糖增菌液内,置于(36±1)℃培养18~24h。
(2)MUG培养。
取供试品增菌培养物、阴性对照增菌培养物、阳性对照增菌培养物各0.2mL,分别接种至5mL MUG培养基的试管中,每种接1支,置于(36±1)℃培养5h、24h,在波长366nm紫外光下观察,同时用未接种的MUG培养基做本底对照。有荧光(蓝白色荧光)为MUG阳性,无荧光为MUG阴性。沿管壁加入柯氏试剂数滴,液面呈玫瑰红色,为吲哚阳性;呈试液本色,为吲哚阴性。
结果判断:MUG阳性、吲哚阳性,判检出大肠杆菌;MUG阴性、吲哚阴性,判未检出大肠杆菌;MUG阳性、吲哚阴性或MUG阴性、吲哚阳性,需进一步做以下检查。
(3)分离培养。
用接种环挑取1~2环需进一步检查的培养物划线接种于伊红美蓝琼脂培养基平板上,置于(36±1)℃培养18~24h。检查有无疑似大肠杆菌菌落。疑似大肠杆菌菌落形态为紫黑色、浅紫色、蓝紫色或粉红色,菌落中心呈深紫色或无明显暗色中心,圆形、微突起,边缘整齐,表面光滑,湿润,常有金属光泽。若无菌落或无可疑菌落生长,则判供试品未检出并报告。若有可疑菌落生长,则进行以下试验。
(4)纯培养。
用接种环挑取2~3个疑似大肠杆菌菌落,分别接种于营养琼脂斜面培养基上,(36±1)℃培养18~24h。
(5)革兰氏染色镜检。
用接种环挑取营养琼脂斜面培养物涂片,进行革兰氏染色镜检,若为革兰氏阴性短杆菌者,继续做生化反应试验。
(6)生化反应试验(IMViC试验)。
①乳糖发酵试验:取纯培养物接种于乳糖发酵管中,(36±1)℃培养24~48h,观察结果。小倒管中有气泡,判为产气;在试管中加入酸性品红指示液,溶液呈红色,加入溴麝香草酚蓝指示液显黄色,判为产酸。
②吲哚试验(I):取纯培养物接种于蛋白胨水培养基中,(36±1)℃培养24~48h,沿管壁加入柯氏试剂数滴,轻轻摇动试管,液面呈玫瑰红色为阳性反应,呈试剂本色为阴性反应。
③甲基红试验(M):取纯培养物接种于磷酸盐葡萄糖胨水培养基中,(36±1)℃培养(48±2)h,在约2mL培养液中加入2滴甲基红指示液,轻轻摇动,立即观察,呈鲜红色或橘红色为阳性,呈黄色为阴性。
④乙酰甲基甲醇试验(V-P):取纯培养物接种于磷酸盐葡萄糖胨水培养基中,(36±1)℃培养(48±2)h,在2mL培养液中加入α-萘酚乙醇液1mL,混匀,再加入40%KOH试液0.4mL,充分摇匀,在4h内出现红色者,判为阳性,无红色反应为阴性。
⑤柠檬酸盐利用试验(C):取纯培养物接种于柠檬酸盐斜面培养基上,置(36±1)℃培养2~4天,培养基斜面有菌苔生长,培养基由绿色变为蓝色,判为阳性;培养基斜面无菌苔生长,培养基仍呈绿色,判为阴性。
(7)结果判定。
阴性对照试验呈阴性,阳性对照试验为MUG阳性、吲哚阳性,供试品MUG阳性、吲哚阳性,报告1g或1mL供试品中检出大肠杆菌;供试品MUG阴性、吲哚阴性,报告1g或1mL供试品中未检出大肠杆菌。
供试品MUG阳性、吲哚阴性、IMViC试验为“―+――”、革兰氏阴性短杆菌,报告1 g或1mL供试品中检出大肠杆菌;MUG阴性、吲哚阳性、IMViC试验为“++――”、革兰氏阴性短杆菌,报告1g或1mL供试品中检出大肠杆菌。
供试品培养物检查不符合以上结果判定中的任一项,报告1g或1mL供试品中未检出大肠杆菌。
当阴性对照有菌生长或阳性对照未生长或生长但非大肠杆菌,不能作出检验结论并报告,应检查原因后,取双倍量进行复检。
大肠杆菌检验程序如图3-40所示。

图3-40 大肠杆菌检验程序示意图
五、结果记录
检验样品:______批号:______生产厂家:______
供试品制备:供试品g(mL)加无菌pH 7.0NaCl-蛋白胨缓冲液至mL。
(1)细菌总数(30~35℃,48h)(表3-34)。
表3-34 口服制剂中的细菌总数
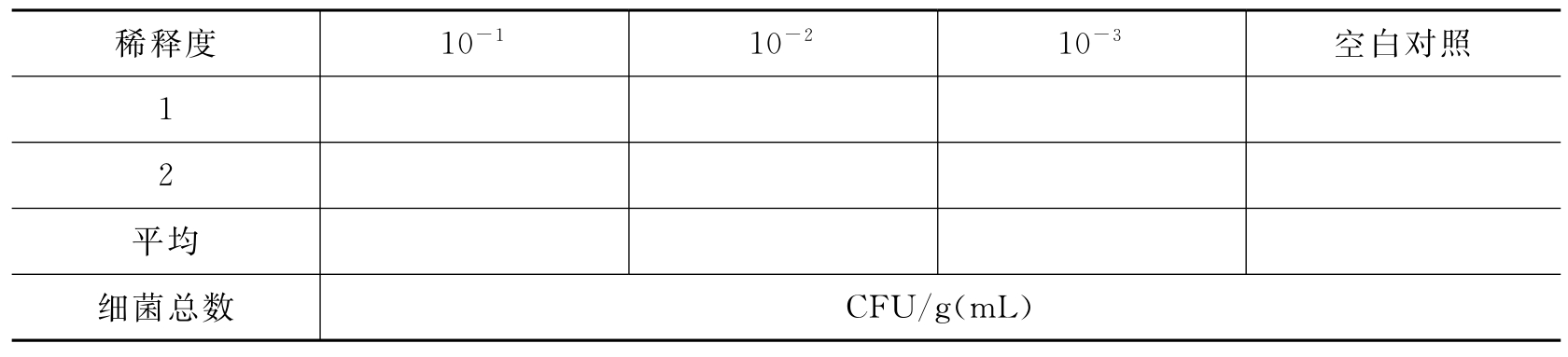
(2)霉菌(酵母菌)总数(23~28℃,72h)(表3-35)。
表3-35 口服制剂中的霉菌(酵母菌)总数
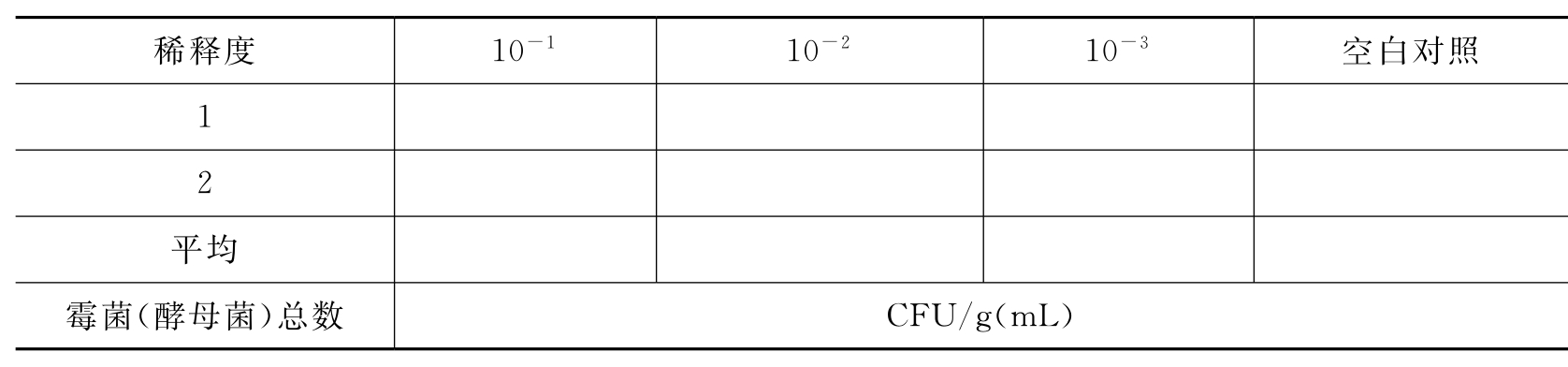
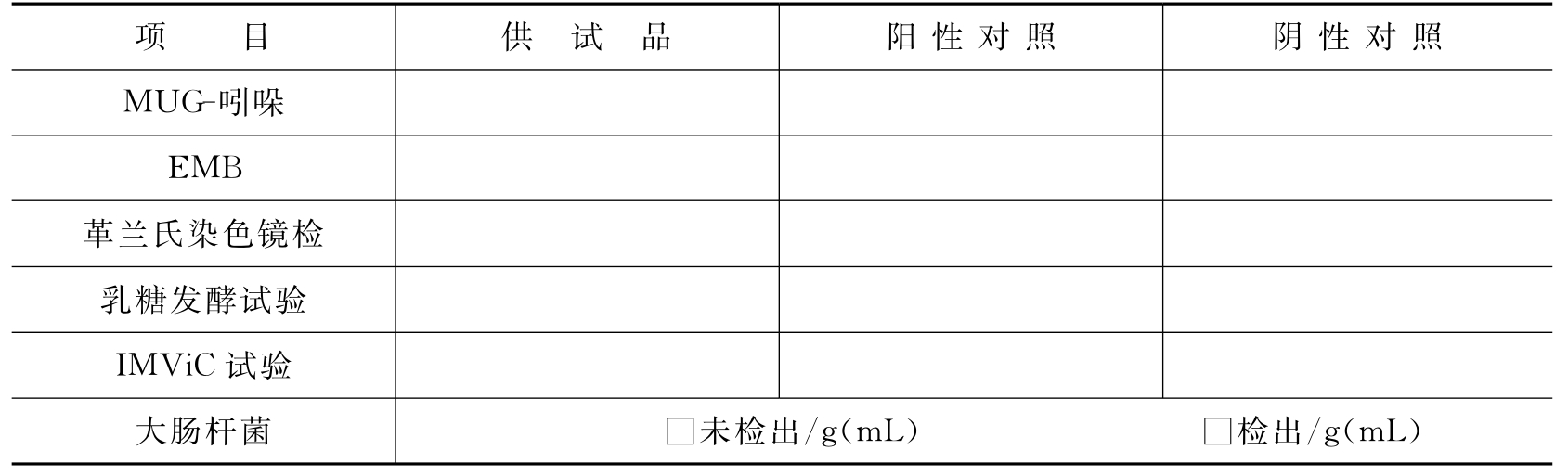
(3)大肠杆菌检查(35~37℃)(表3-36)。
表3-36 口服制剂中大肠杆菌检查
(4)结论:所检验的口服制剂是否达到国家药典规定的口服制剂的卫生标准?
六、思考题
(1)为什么要检定药品中的细菌和真菌总数?为什么要以大肠杆菌作为药物的卫生学指标菌?
(2)为什么要做微生物限度检查的验证试验?
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。
















