17.1.3 SOD口服有效性的研究
目前,SOD在临床上的应用研究多采用静脉或腹腔注射方式,关于口服SOD的报道很少。Bernier M等对小鼠口服SOD治疗局部缺血再灌流引起的心室纤维性颤动进行了研究。结果表明,小鼠口服SOD后,分离的心脏因缺血再灌流引起心室纤维性颤动的发生率由对照组的87%降至27%。颤动发生率随口服剂量变化呈一条U形曲线,剂量为8×10-3IU/L时,颤动发生率最低。Marinv G和Pastori S报道了口服SOD治疗睾丸变性的研究。服用SOD的90名病人均感疼痛消失,且大部分人的性功能有所恢复。Dcrevenco P等的实验结果说明,Wistar鼠口服SOD缓解了服用氯化锰引起的脑组织损伤。这些研究采用口服方式治疗疾病均有明显的疗效,说明SOD口服后可被吸收进入血液起到治疗作用。
除临床外,SOD越来越广泛地应用于日常生活,SOD口香糖、SOD片剂及口服液的相继问世,使口服成为一种重要的使用方式。SOD这种大分子蛋白质经口服后能否被吸收进入体内,以怎样的途径被吸收成了迫切需要解决的问题。强美玉等研究了125I-SOD灌胃后在小鼠体内的分布情况。实验结果如下:小鼠灌胃125I-SOD后,在血液及肾、肝、心、脾和肺各器官中均有一定量的放射性出现。以0.2mL125I-SOD灌胃,血细胞中放射水平在3h达到高峰,随后缓慢下降。各脏器中放射性分布次序为:肾>肝>肺>脾>心。肾脏在高峰时的放射性为肝的8倍、肺的33倍、脾的72倍、心的73倍。在灌胃1h内,残留在胃肠道中的放射性水平很好,胃肠腔内容物残留的放射性约占给入量的60%,随时间延长明显下降。至9h只有10%左右。这个结果表明,外源SOD可经胃肠道吸收进入体内。
药理学认为药物经口服后常发生首过效应,即药物在体内受到氧化、还原、酸解、酶解或形成复合物、化合物等失活作用,从而减少原形药物的吸收量。另外,药物经胃肠道黏膜的吸收要经过不流动水层、刷毛缘、细胞间隙和细胞基侧膜等几道屏障。药物的理化性质、胃肠道的运动状态及表面积、血流速度均影响到药物的吸收。人们对SOD在模拟小鼠胃肠道环境中受到酸解、酶解等失活作用进行测定,进而研究了不同剂量的SOD灌胃后小鼠血细胞中SOD活性的变化及其速度,并对牛内皮细胞对SOD的胞饮作用作了观察,结果如下。
17.1.3.1 SOD在胃酸中的保存试验
SOD在pH为2.5的盐酸-生理盐水中在37℃下保温150min,残存活性为84%;在含有200u/mL胃蛋白酶的pH为2.5的盐酸-生理盐水中保温150min,残存活性为82%。通常一般食物或药物在胃中停留时间为120min左右,人体胃酸分泌量为2 000mL/天,实验条件远比小鼠体内条件“恶劣”,故可以认为SOD对小鼠体内的酸碱及胃蛋白酶解有较强的抗性。在肠道中,SOD主要受到小肠液中的胰酶酶解作用。SOD在含有2mg/mL胰酶的pH为8.6的磷酸缓冲液中在37℃下保温210min,残存活性为83%。实验中胰酶实际上是胰蛋白酶、糜蛋白酶、羧肽酶A和弹性蛋白的复合物。以上结果表明:SOD经灌胃后能够耐受胃肠道中酸解和酶解作用,有68%左右的SOD以活性形式存留下来,这为SOD的吸收提供了前提条件。
17.1.3.2 SOD在模拟小鼠胃肠道环境中的稳定性研究
(1)SOD对胃酸的耐受力实验。10μL SOD在1.2mL pH为1.5的生理盐水-HCl中在37℃下保温,每隔30min测其SOD活性。实验表明,SOD在pH为1.5的生理盐水-HCl溶液中保温,其残存活性百分数随时间缓慢下降,保温150min后,残存活性为84.0%。
(2)胃蛋白酶对SOD的降解实验。10μL SOD溶液和200μL胃蛋白酶溶液在1.2mL pH为1.5的生理盐水-HCl溶液中37℃下保温,每隔30min测其活性。SOD在37℃,pH为1.5条件下与胃蛋白酶共同保温,SOD残存活性百分比随保温时间而下降,保温150min,残存活性为82.3%。
(3)胰酶对SOD的降解实验。10μL SOD溶液和150μL胰酶溶液在1.0mL pH为8.5的碳酸钠缓冲液中在37℃下保温,每隔30min测SOD活性。SOD在pH为8.6的胰酶溶液保温,其残存活性百分数随时间呈下降趋势。降解反应至210min,残存活性为83.1%。
由以上三组实验数据可知,SOD是一种对胃酸和蛋白水解酶有较强耐受力的蛋白质,这与它含有较多的链内二硫键及两个金属辅因子而具有强稳定性是一致的。通常情况下食物和药物在胃和小肠中停留时间分别为2h和4h左右。SOD在胃酸、胃蛋白酶和胰酶溶液中保温相应长的时间,其残存活性分别为84.0%、82.3%和83.1%。也就是说,口服后,大约有68%的SOD以活性形式参与吸收。这一结果为SOD口服经胃肠道吸收提供了前提条件。
17.1.3.3 125I-SOD灌胃后在小鼠体内的分布
本研究采用同位素示踪技术探讨了125I-SOD灌胃后在小鼠体内的吸收和分布。
动物和给药:取体重(20±2)g的ICR纯种、健康、雄性小鼠,随机分成5组,每组3只,试验前禁食10h,自由饮水,将125I-SOD标记产品用适量生理盐水稀释,每只鼠给予0.2mL,示踪剂为166.5KBq。
样品和测量:小鼠均摘除眼球放血处死,用肝素抗凝、离心、分离血浆和血细胞,量取一定体积于测定管内直接测量;剖取心、肝、脾、肺、肾全量,分别用滤纸吸干血迹、称重、待测;取下全部胃肠道(包括从食管、胃、小肠、大肠至直肠)于测量管内测量,作为灌胃后胃肠道的余留放射性;然后把管腔剪开,用大量自来水冲洗、浸泡数小时,彻底除去残留血液和腔内的内容物,再进行测量;此为胃肠道存留的放射性,样品均用FJ-2008γ免疫计数器进行放射性测量。
血中放射性:小鼠灌流125I-SOD后在各时间内测得血中的放射性,以每100μL血细胞或血浆中的放射性表示,见表17-3,灌流30min后,血中即能出现放射性,且血细胞中的放射性随时间推移略有升高,在3h达到高峰,随后缓慢下降,至9h血细胞中的放射性仍有高峰值的63%,而血浆中125I-SOD在灌流后持续一段时间放射性即保持恒定,随后升高,至9h放射性仍在增加。
表17-3 125I-SOD灌胃后小鼠血液中放射性分布(cpm/100μL)(x±SD)

组织分布:以每100mg湿组织中的放射性表示,结果列于表17-4,灌流后30min,125I-SOD广泛分布于小鼠的各组织器官内。在各时相中,肾脏的放射性分布为各脏器之首位,依次序为肾>肝>肺>脾>心,肾脏在高峰时的放射性为肝的8倍、肺的33倍、脾的72倍、心的73倍。给药后0.5h,肝、脾中的放射性出现高峰,肾脏于1h达峰值,而心和肺基本保持恒定水平。
表17-4 125I-SOD灌胃后小鼠脏器中放射性分布cpm/100mg(x±SD)

胃肠道中的放射性:由表17-5可见,存留在胃肠道中的放射性水平是很高的,尤其是125I-SOD灌流后1h内,胃肠腔内容物存留的放射性约占给入量的60%,随时间延长明显下降,至9h只有10%左右。胃肠道经自来水充分洗涤后,存留在胃肠壁上的放射性是极少的。经水冲洗后,存留在胃肠壁上的放射性不到存留量的4%,可见SOD经胃肠道进入后主要随粪便排除(见表17-5)。
表17-5 125I-SOD灌胃后小鼠胃肠中的放射性cpm(x±SD)

SOD由胃肠道进入体内后,是以原形物代谢还是以分解产物代谢排出体外,还有待进一步研究。
关于hSOD经胃肠系统给药的药代动力学实验,目前尚未见有文献报道。本文125I-SOD灌流后小鼠血浆中的放射性比血细胞中要高得多(P《0.01)。国内有关资料介绍用猪125I-SOD给小鼠iv或im后,血浆放射性占全血放射性的比例比血细胞要多,分别为74.6%和26.6%。本结果与文献相似,进入血液中的SOD主要集中在血浆中,少量存留在红细胞中。
小鼠组织放射性测定结果表明,hSOD灌流后主要分布在肾脏,这与文献报道的非胃肠系统给药以肾组织存留最多是相符合的。可以看出,不论是哪一种属性的SOD,也不分是什么途径用药,都在肾组织存留多。这表明进入体内的SOD主要从肾中排出。
17.1.3.4 牛主动脉内皮细胞对FITC-SOD的透过实验
将培养三代的健康细胞在含有FITC-SOD及20%小牛血清的培养基199中,5%CO2,37℃培养,分别在6h和24h取出部分细胞载片,H2O冲洗,晾干后在荧光显微镜下观察荧光分布。实验表明牛主动脉内皮细胞在含有荧光标记SOD的培养基中培养,FITC-SOD可缓慢地少量透过内皮细胞膜而进入胞内。培养至6h,在少量细胞内呈现点状分布的荧光亮斑,培养24h后,呈现荧光的细胞数目有所增加,且胞内荧光强度也增加。可以说,随着培养时间延长,更多的SOD荧光标记物透过细胞膜而进入胞内,实验表明,确有部分FITC-SOD能透过细胞膜而进入细胞质中。
17.1.3.5 口服外源SOD完整分子的吸收实验
A.实验方法
(1)小鼠灌胃及取血样。取2g ICR小鼠,禁食24h,每只灌胃0.2mL,内含目标物溶于NaHCO3溶液(1.5g/100mL,pH=8.2),而Cu2+溶于PBS缓冲液(NaCl 8g,KH2PO4 0.24g,Na2HPO40.24g,KCl 0.2g,1 000mL,pH=7.4);对照组灌胃相应的0.2mL缓冲液;每组5只。于灌胃后一定时间眼眶放血,取血0.8mL,肝素抗凝,加入预冷的PBS缓冲液,3 500r/min,15min离心;然后PBS缓冲液洗3次,每次1 500r/min,5min离心。取血红细胞0.3mL,加入等量去离子水溶血,然后乙醇、氯仿沉淀,取上清液测SOD活性及进行SDS-PAGE。
(2)小鼠抗单亚基SOD血清的制备。取一定量SOD,于变性缓冲液中(50mmol/L,pH=6.8Tris-HCl,2%SDS,100mmol/L二硫苏糖醇,20%甘油),混匀,沸水浴3~5min,在4℃下置PBS缓冲液透析过夜,得到变性的单亚基SOD。常规免疫小鼠,共4次,用免疫双扩散实验测得其对变性单亚基SOD的效价为1∶32,分装后于-20℃下保存备用。
变性SOD的制备。取单亚基SOD 10mg,在人工胃液(胃蛋白酶50mg、pH为1.5~2的稀HCl溶液5mL)中降解2~4h,用1mol/L NaOH调pH至7.4终止反应。
(3)Western-blotting。SDS-PAGE后,电转移至硝酸纤维素膜,脱脂奶粉封闭液(5%脱脂奶粉,0.02%Tween 20,溶于PBS缓冲液)封闭1~2h,一抗用1∶100稀释的小鼠抗血清,PBS洗3×10min,再用TNB缓冲液(50mmol/L Tris-HCl,150mmol/L NaCl,pH=7.5)洗,二抗用AP标的羊抗小鼠Ig(脱脂奶粉,0.02%Tween,溶于TNB缓冲液)。TNB缓冲液洗3×10min,NBT/BCIP显色至适度。
B.结果分析
(1)Cu2+灌胃对血红细胞SOD活性的影响。用含Cu2+,0.1~10mol/L的PBS缓冲液0.2mL给ICR小鼠灌胃,取血红细胞上清液测SOD活性,未见其活性的显著变化。
(2)降解的SOD对血红细胞SOD活性的影响。降解的SOD经测活证实无SOD活性,而且15%的SDS-PAGE凝胶已显示不出降解SOD片段的大小,可见SOD被降解成小分子的肽段。按每只鼠以0.5mL灌胃,以时间对SOD活性变化的百分数作图,结果见图17-1。从图17-1可知,降解的无活性SOD可引起细胞内SOD活性升高,至7h达到121.4%。
(3)灌胃完整SOD对血红细胞SOD活性的影响。分别用每只0.5mg、2mg,5mg和50mg的量给小鼠灌胃,测其SOD的活性,了解其对血红细胞活性的影响,以时间对SOD活性变化的百分数作图,见图17-2。
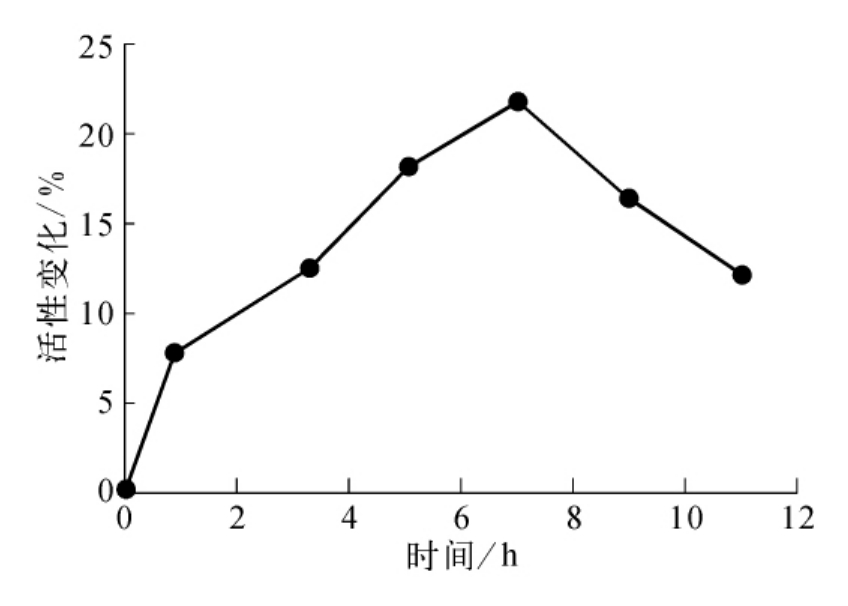
图17-1 降解SOD对血红细胞SOD活性的影响

图17-2 灌胃SOD对血红细胞SOD活性的影响
从图17-2可以看出,口服完整SOD能使血红细胞中的SOD活性随时间变化渐渐升高,然后达到高峰,再慢慢恢复到原有水平。而且随SOD剂量的不同其到达活性最高峰的时间和变化程度略有不同。
(4)SDS-PAGE及Western-blotting分析。从血红细胞SOD提取物的SDS-PAGE,可以看到在Mr为16kD附近有一清晰的条带,为SOD带。Cu,Zn-SOD分子由两条相同亚基组成,牛血SOD的Mr约为32kD,在变性条件下两个亚基会分开,所以SDS-PAGE上可见其Mr为16kD。从对照来看,其内源SOD带亦存在。因为内源小鼠SOD和外源牛的SOD的Mr相差不多,所以从SDS-PAGE上显示不出差别。
从Western-blotting的图谱分析,标准品加入小鼠血红细胞及小鼠血红细胞样品。小鼠免疫得到的抗血清与内源的SOD的反应检测不到。而牛血SOD与其发生免疫反应,产生清晰的条带。
C.结果分析
SOD是生物大分子,Mr为32kD。虽然实验表明其免疫原很低,但有报道,多次注射仍有抗体产生,所以口服不仅是一条方便而简单的途径,而且可以避免免疫反应的残存活性均超过80%,小鼠口服10~100u/g(体重)SOD后,12h内血红细胞中SOD活性均呈峰型增加,峰值变化为44%~100%;吸收的动力学曲线符合Michaelis-Menten方程。此外,牛主动脉内皮细胞培养实验表明:细胞对荧光标记SOD有透过作用。黄维华等从放射性标记的125 I-SOD和酶活性两方面证实:口服SOD后,提高了红细胞内SOD的活性,并探讨了其可能的作用机制。Regnault等研究了鼠口服0.5~20mg SOD/kg SOD和脂质体包裹的SOD以及在脂质体中含N-脂酰鞘氨醇包裹的SOD,其生物利用度分别为14%、22%和51%。
本文认为:口服SOD可能通过降解的外源SOD诱导内源SOD产生和完整生物大分子进入的途径使血红细胞的活性升高,进一步证实了SOD口服的有效性和持久性。但是究竟是降解片段的哪一部分诱导内源SOD的合成以及完整SOD大分子进入细胞膜的这种机制是否与报道的特异性SOD受体有关等,都还有待进一步的研究;另外,口服吸收的生物利用度也有待通过添加佐剂、降低胃肠道消化酶的影响等方法来提高。
口服吸收实验一般用放射性标记或荧光标记,事实上,如果SOD在胃肠道降解成小分子进入血液循环,其放射性强度和荧光仍然可在血液中检测出来;另一方面,SOD降解的某一些小肽段能穿过细胞膜,也许仍具有SOD的部分活性,因此活性检测不具有专一性。而且据报道,一般细胞和非分化细胞中存在脱辅基SOD(Apo-SOD pool),在人的淋巴细胞中脱辅基SOD占总SOD的35%左右,因此降解的Cu2+、Zn2+若穿过细胞膜,仍会引起SOD活性的升高,但本实验表明直接灌胃Cu2+并没有引起血红细胞SOD的活性显著变化,可能是因为被抗重金属系统所吸收。所以找到直接的证据对阐明SOD生物大分子的吸收和作用机制具有重要的意义。
另一方面,SOD作为外源生物大分子,在血液中的半衰期很短;但有实验证明,注射酶与药物动力学的快速清除不同的是,其作用可持续几周甚至几个月。Edeas等用免疫细胞化学方法检测不同量的外源SOD孵育的外周血淋巴细胞中的Mn和Cu,Zn-SOD,证实SOD穿过了细胞膜,且24h后总的SOD活性提高。
本研究发现,口服降解的无活性SOD能使红细胞中SOD活性升高,可见降解后的SOD片段可能诱导了内源SOD的生成,这进一步证实了文献的推论。Emerit等用流动细胞仪和共聚焦激光光谱,可见荧光标记的SOD快速吸附到单细胞、淋巴细胞表面,缓慢地被吞入细胞内。而本研究则通过Western-blotting分析,找到了完整的SOD分子。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。















