第三节 各种核酸杂交方法
采用核酸探针杂交进行定性和定量的核酸片段检测和分析,常根据被检测核酸的性质如DNA或RNA,以及检测方式的不同命名为各种不同的杂交方法。传统的杂交方法包括Southern印迹杂交、Northern印迹杂交、组织原位杂交、菌落原位杂交和斑点杂交。随着分子生物学的发展又出现消减杂交、夹心杂交、比较基因组杂交、差异性甲基化杂交分析、基因芯片等各种不同的方法和用途。
一、Southern杂交
Southern印迹杂交指DNA片段转移到膜上后与DNA或RNA探针进行杂交,检测靶DNA片段中是否存在与探针同源的序列,以它的发明者ER Southern命名的。其基本原理就是核酸的变性和根据碱基互补原则进行配对的复性。Southern杂交的主要步骤包括:①基因组DNA的限制性酶切;②DNA酶切片段的电泳分离,经变性、转移并固定于膜上;③与标记的探针进行杂交;④杂交结果的检测——放射自显影或化学显色反应;⑤若有多于一种探针,且杂交是在尼龙膜上进行的,可去除探针,再进行第2种探针的杂交。
1.基因组DNA的制备和限制性酶切 从组织或细胞中制备基因组DNA一般采用蛋白酶、RNA酶和酚/氯仿提取纯化方法。人DNA的分子很大,相对分子质量为106~1012,一般提取方法难以得到完整的DNA分子,只能得到107~108大小的DNA分子。为了尽可能保持分子的完整性,要避免高温、过酸或过碱的环境,缩短提取过程,防止机械剪切作用,操作必须轻缓,还加入EDTA防止DNA酶的降解作用。基因组DNA的制备一般包括以下步骤:①破细胞(或细胞器);②去除蛋白质;③沉淀核酸;④去除其他杂质。破细胞方法有:超声波、搅碎和匀浆、冷冻研磨法、去污剂、蛋白质变性剂、溶菌酶、蛋白酶等处理。
核酸的浓度可通过紫外吸收法和溴化乙啶染色来测定。核酸中碱基的苯环共轭结构使其在波长为260nm处有最大吸收,可通过分光光度计进行定量分析。双链DNA的浓度(μg/ml)=50(μg/ml)×A260×稀释倍数,单链DNA和RNA的浓度(μg/ml)=40(μg/ml)×A260×稀释倍数,寡核苷酸的浓度=33(μg/ml)×A260×稀释倍数。
紫外吸收法只适用于测定浓度>0.25μg/ml的DNA溶液,当溶液较稀时,可通过溴化乙啶对双链DNA的结合,测量EB的荧光强度(300nm处效果最好)来测定,可检测出1~5ng DNA。此外,DNA的浓度还可通过凝胶电泳进行,有连续稀释法和标准浓度对比法。
2.酶切 限制性内切酶可识别DNA内部特异性的碱基序列,并在该部位切断DNA双链。有3种类型内切酶,Ⅰ和Ⅲ型内切酶的识别位点与切割位点分开,不产生特定的片段而较少使用,Ⅱ型内切酶在识别的特异性碱基序列内特异部位切断DNA,产生特异片段。大多数Ⅱ型酶的识别顺序为4~12个核苷酸,含有回文结构。Ⅱ型内切酶作用时一般需Mg2+,对NaCl的需求大致可分为低(0mmol/L)、中(50mmol/L)、高(100mmol/L)3种浓度,>5%甘油和10mmol/L EDTA会抑制酶的活性。选择限制性内切酶是否适合直接影响到结果分析。选择适当的内切酶,能得到较理想长度DNA片段,一般为0.5~10kb。酶切后DNA片段过短,则影响其印迹效率,因为大多数固定DNA的膜结合小片段DNA的能力较差;而片段过大,不但影响其转移时的效率,而且也影响其相对分子质量的准确判断。
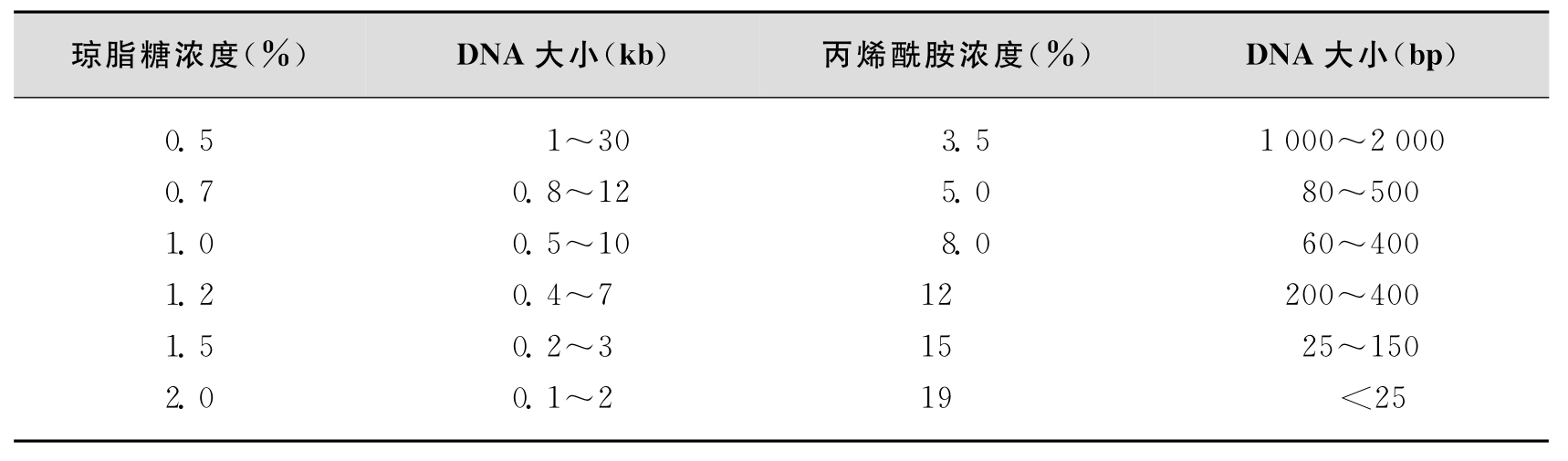
3.电泳、转移与固定 酶切后的DNA片段通过凝胶电泳进行分离。在凝胶电泳中,核酸分子的泳动速度与相对分子质量成反比,相对分子质量越大,泳动越慢。反之,相对分子质量越小,泳动越快。DNA的凝胶电泳常使用两种材料:琼脂糖或丙烯酰胺凝胶,可根据目的DNA片段的大小,选择不同浓度的琼脂糖或丙烯酰胺凝胶,见表4-2。有时用两种材料的混合凝胶。因为低浓度的丙烯酰胺凝胶易碎,添加琼脂糖可加强其机械强度。如用2.2%的聚丙烯酰胺加0.7%琼脂糖的混合凝胶,可有效分离150bp~5.7kb的核酸分子。
表4-2 核酸相对分子质量与凝胶浓度关系
DNA酶切和电泳后,目的片段若>10kb的则经0.25mol/L HCl脱嘌呤,将DNA链切成小片段,再经碱变性成为单链,然后转移至尼龙膜或硝酸纤维素膜上。转移方法有:毛细管转移法、电转移法和真空转移法。毛细管法为经典方法,也是最常用的方法,有向上转移法和向下转移法,向上转移法简单,易操作,但速度慢、效率低(图4-10);向下转移法需要特殊设备,或将存放转移液的盘子放在高处(图4-11)。
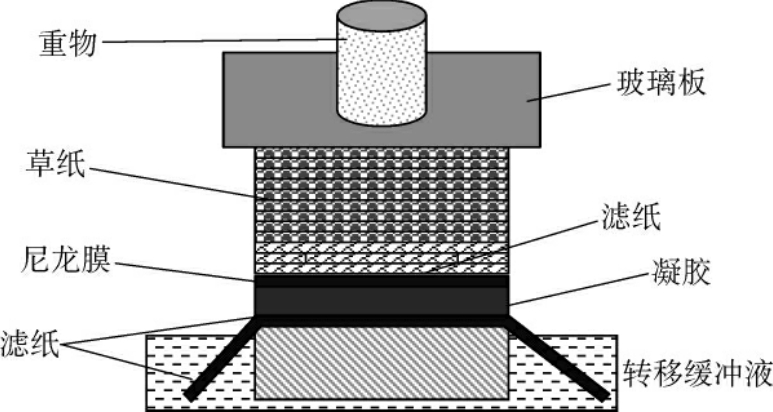
图4-10 向上毛细管转移装置示意图
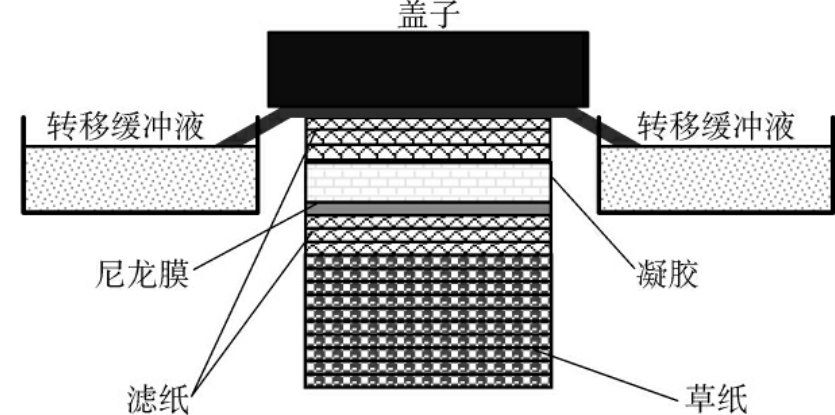
图4-11 向下毛细管转移装置示意图
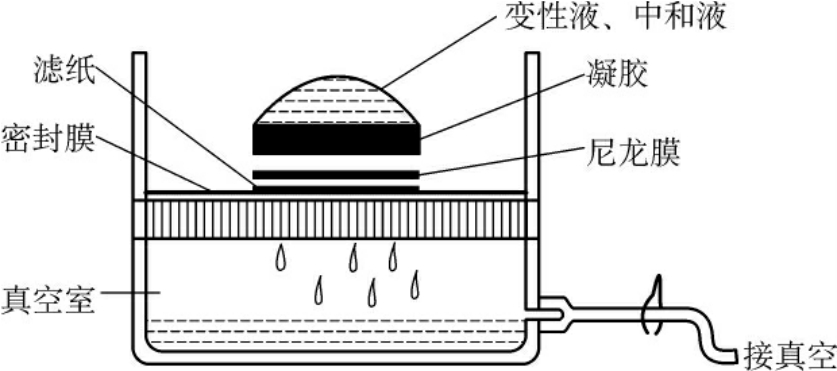
图4-12 真空转移
真空转移的原理与毛细管转移相同,但需要特殊转移设备(图4-12)。其特点是快速、转移效率高,同样条件下,可提高杂交灵敏度2~5倍。
电转移法有湿式和半干式,简便、快速,不需要脱嘌呤,但电转移产生大量热量,往往难以使缓冲液维持在一定的温度,以适合DNA的有效转移,所以一般只在毛细管转移和真空转移无效时使用,多用于蛋白质的转移。
将核酸片段固定于膜上,可通过紫外交联或高温烘烤。若采用尼龙膜,可用碱液转移,转移后无需固定。
4.杂交 一般在含5或6×SSC和封闭剂的溶液中进行,杂交温度一般为(Tm-25)℃,水溶液中65~70℃,50%甲酰胺中37~42℃。封闭剂大致可分为3种类型:①蛋白质和多糖;②去污剂;③竞争性小分子DNA。硫酸葡聚糖可作为杂交链形成的增强剂,SDS可抑制单链DNA的吸附,除去不结合的探针。使用甲酰胺可降低杂交的温度和RNA的降解速度。
洗膜条件有:低严格度(低温、高盐)、中严格度和高严格度(高温、低盐)。
5.检测 用放射性核素标记的探针,杂交结果可通过放射自显影显示。非放射性标记探针的杂交结果检测,以地高辛(Dig)为例,简述于图4-13。
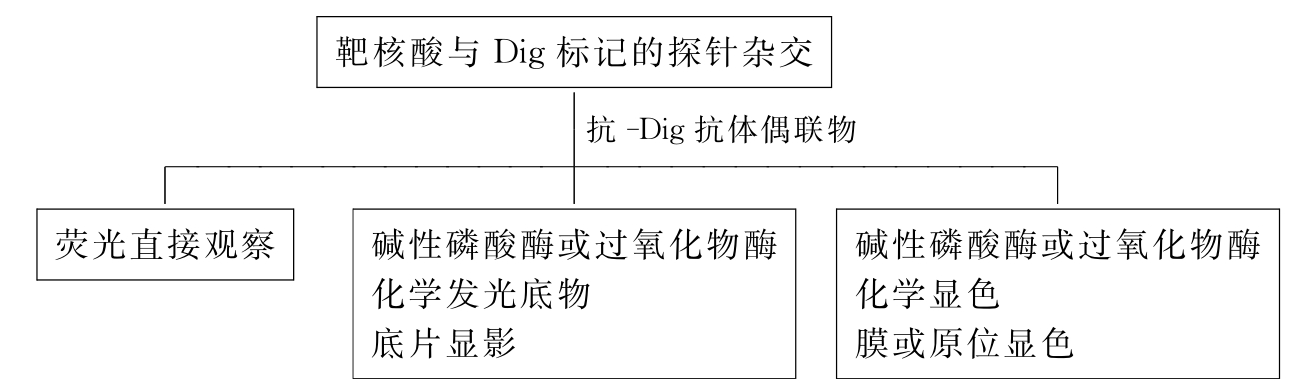
图4-13 杂交结果检测
Southern杂交的结果取决于很多因素,包括目的基因在基因组中所占的比例、探针的浓度和标记率(放射性核素标记时为比活性)、转移到膜上的DNA量、探针与目的基因的配对情况等。如果采用32P标记的比活性达109cpm/μg的探针,在最佳条件下,可检出0.1pg的DNA或10μg基因组DNA中长度为1kb的单拷贝基因。
6.应用 ①克隆鉴定。②基因同源性分析;DNA限制性片段长度多态性分析(RFLP)是一种鉴别不同生物的遗传标记及独特的遗传特征的强有力工具。对于大分子染色体DNA,各种长度的酶切DNA片段在胶上相互交盖,不能分辨,要借助于分子杂交。③表观遗传调控研究。④病毒感染、遗传疾病及癌症的分子诊断。⑤环境微生物的检测。
二、Northern杂交
继Southern杂交后,GR Stark首创了相似的方法用于检测RNA,为了与先前已有的Southern杂交对应,被趣称为Northern杂交。Northern杂交的过程和方法与Southern杂交相似,首先经异硫氰酸胍/酚/氯仿抽提总RNA,经电泳分离,然后转移、固定、杂交和结果检测。所不同的是Northern杂交的检测对象为RNA,总RNA不需要进行酶切,即是以各个RNA分子的形式存在,可直接应用于电泳。此外,由于碱性溶液可使RNA水解,因此不进行碱变性,但因单链RNA会形成部分双链结构而影响其电泳行为,所以RNA电泳是在变性条件下进行的,这样才能保证RNA按分子大小进行分离。变性凝胶电泳主要有3种:乙二醛变性电泳、羟甲基氢氧化汞变性电泳和甲醛变性电泳,其中甲醛变性电泳最常用。因为变性剂的存在,电泳缓冲液不能使用Tris-HCl,要用丙磺酸(MOPS)或乙酸钠。电泳后的琼脂糖凝胶用与Southern转移相同的方法将RNA转移到膜上,然后与探针杂交,从杂交条带位置和量判断某特异RNA的表达。因DNA迁移率与RNA不同。因此,需采用RNA标准相对分子质量(RNA ladder),并且不在凝胶中加入溴化乙啶,以免影响转膜。
Northern杂交的主要检测对象为mRNA,其含量低且不稳定,易被RNA酶(RNase)所降解,因此防RNA酶的污染是Northern杂交的关键。首先,所有试剂要用无RNA酶的纯净水配制;其次,所有器皿都要进行去RNA酶处理,可采用RNA酶AWAY或RNase ZAP试剂处理,也可用氯仿浸泡枪头,或直接购买无RNA酶枪头和离心管;最后,所有操作都是戴手套进行的,并要经常更换。

图4-14 基因表达水平的Northern杂交检测
Northern转移杂交常用于对基因的表达调控、基因的结构和功能、遗传变异以及病理研究中,主要测量表达量的多少和表达物的变化,如是否使用的第2个转录起始位点、是否发生无义突变使转录流产、转录后的修饰如剪切是否改变等。在进行基因表达水平变化的分析时,必须采用管家基因如肌动蛋白(β-actin)、3-磷酸甘油醛脱氢酶(GAPDH)等作为对照(图4-14),以相对量进行比较。
三、原位杂交
原位杂交(in situ hybridization,ISH)也称为杂交组织化学(in situ hybridization histochemistry,ISHH)或细胞学杂交,即采用核酸探针与组织、细胞或染色体上DNA或RNA进行杂交的方法称为原位杂交组织(或细胞)化学技术,与Southern印迹杂交和Norhtern印迹杂交同属于固相核酸分子杂交的范畴。但Southern和Norhtern杂交是将DNA或RNA提取后进行的,无法与组织病理或细胞形态异常相联系,而原位杂交则通过分析组织、细胞或染色体上DNA或RNA将分子生物学与形态分析相结合,能在成分复杂的组织中进行单一细胞的研究而不受同一组织中其他成分的影响,对于那些数量少且散在其他组织中的细胞内DNA或RNA的研究更为方便,并能反映组织细胞之间的关系和功能状态。
(一)原位杂交的基本方法
原位杂交的基本过程大致可分为:①杂交前准备:固定、取材、玻片和组织的处理,包括如何增强核酸探针的穿透性、减低背景染色等;②杂交;③杂交后处理;④显示:包括放射性自显影和非放射性标记的显色。
1.组织固定 原位杂交在固定剂的应用和选择上应兼顾到3个方面:保持细胞结构、最大限度地保持细胞内DNA或RNA的水平、使探针易于进入细胞或组织。DNA是比较稳定的,而RNA却非常容易被降解。因此,对于DNA的定位来说,固定剂的种类和浓度并不十分重要。相反,在RNA的定位上,如果要使RNA的降解减少到最低限度,那么不仅固定剂的种类浓度和固定的时间十分重要,而且取材后应尽快予以冷冻或固定。最常用的固定剂是多聚甲醛,它不会与蛋白质产生广泛的交叉连接,因而不会影响探针穿透入细胞或组织中。其他固定剂包括戊二醛、醋酸-乙醇的混合液等。戊二醛能较好地保存RNA和组织形态结构,但由于和蛋白质产生广泛的交叉连接,从而大大地影响了核酸探针的穿透性,而乙醇/醋酸混合液能为增加核酸探针的穿透性提供最佳条件,但它们不能最大限度地保存RNA,而且对组织结构有损伤。因此,多聚甲醛是目前最好的固定剂。
2.玻片和组织切片的处理
(1)玻片的处理:玻片包括盖片和载片应彻底清洗,高温烘烤以去除任何RNA酶。玻片用多聚赖氨酸液涂盖以增强组织黏附效果;盖玻片最好用硅化处理。
(2)增强组织的通透性和核酸探针的穿透性:此步骤根据应用固定剂的种类、组织的种类、切片的厚度和核酸探针的长度而定。比如用戊二醛固定的组织由于其与蛋白质产生广泛的交叉连接就需要应用较强的增强组织通透性的试剂。增强组织通透性常用的方法如应用稀释的酸洗涤、去垢剂或称清洗剂Triton X-100、乙醇或某些消化酶如胃蛋白酶、胰蛋白酶、胶原酶和淀粉酶等。这种广泛的去蛋白作用无疑可增强组织的通透性和核酸探针的穿透性,提高杂交信号,但同时也会减低RNA的保存和影响组织结构的形态。因此,在用量及孵育时间上应慎为掌握。
(3)减低背景染色:与免疫细胞化学染色一样,ISH实验程序中,如何减低背景染色是一个重要的问题。不少实验室工作者在多聚甲醛固定后,浸入乙酸酐和三乙醇胺中以减低静电效应,减少探针对组织的非特异性背景染色。
预杂交是减低背景染色的一种有效手段。预杂交液和杂交液的区别在于前者不含探针。将组织切片浸入预杂交液中可达到封闭非特异性杂交点的目的,从而减低背景染色。
有的实验室在杂交后洗涤中采用低浓度的RNA酶溶液(20μg/ml)洗涤一次,以减低残留的RNA探针,降低背景染色。
(4)防止RNA酶的污染:若原位杂交检测的对象为RNA,则与Northern杂交相似,防RNA酶污染是实验成功的关键,由于在手指皮肤及实验用的玻璃器皿上均可能含有RNA酶,为防止其污染影响实验结果,在整个杂交前处理过程都需戴消毒手套。所有实验用玻璃器皿及镊子都应于实验前一天置高温(240℃)烘烤以达到消除RNA酶的目的。所有器皿都要进行去RNA酶处理,试剂也要用无RNA酶纯净水配制。
3.杂交
(1)杂交液:杂交是在预杂交后进行的,即将杂交液滴于切片组织上,加盖硅化的盖玻片,防止孵育过程中的高温(50℃左右)导致杂交液的蒸发。在孵育时间较长时,为保证杂交所需的湿润环境,可将复有硅化盖玻片进行杂交的载片放在盛有少量5×SSC溶液的盒中进行孵育。在原位杂交细胞化学中,探针浓度为0.5~5.0μg/ml,杂交液以10~20μl/每张切片为宜。杂交液过多不仅浪费,而且液量过多易致盖玻片滑动脱落,影响杂交效果,过量的杂交液含核酸探针浓度过高,反易导致高背景染色等不良后果。
(2)探针的长度:一般应用于ISH探针的最佳长度应在50~100bp。探针短易进入细胞,杂交率高和杂交时间短。据报道,长500bp的探针,其杂交时间约需20小时。200~500bp的探针仍可应用,如超过500bp的探针则在杂交前最好用碱或水解酶进行水解,使其变成短的片段,达到实验所需求的碱基数。实际上通过切口平移法和随机引物延伸法标记的探针一般在此范围内。
(3)杂交的温度和时间:杂交的温度也是杂交成功与否的一个重要环节。原位杂交中,高温对保存组织形态完整和保持组织切片黏附不利。因此,在常规杂交液中加入50%甲酰胺,可降低杂交温度,使RNA和cRNA探针的杂交温度在37~42℃。杂交时间一般为16~20小时,寡核苷酸探针的杂交时间大大缩短。杂交的时间如过短会造成杂交不完全,而过长则会增加非特异性染色。当然,杂交反应的时间与核酸探针长度与组织通透性有关,在确定杂交反应时间应予考虑,并经反复实验确定。
4.杂交后处理 杂交后处理包括系列不同浓度,不同温度的盐溶液的漂洗。在原位杂交组织化学的实验程序中,这也是一个重要的环节。特别因为大多数的原位杂交实验是在低严格度条件下进行的,非特异性的探针片段黏附在组织切片上,从而增强了背景染色。RNA探针杂交时产生的背景染色特别高,但能通过杂交后的洗涤有效地减低背景染色,获得较好的反差效果。在杂交后漂洗中的RNA酶液洗涤能将组织切片中单链RNA除去。洗涤的条件如盐溶液的浓度、温度、洗涤次数和时间因核酸探针的类型和标记的种类不同而略有差异,一般遵循的共同原则是盐溶液浓度由高至低,而温度由低至高。必须注意的是在漂洗的过程中,切勿使切片干燥。干燥的切片即使大量的溶液漂洗也很难减少非特异性结合,从而增强了背景染色。
5.显示 又可称为检测系统。根据核酸探针标记物的种类分别进行放射自显影、荧光显微镜观察或利用酶检测系统进行不同显色处理。细胞或组织的原位杂交切片在显示后均可进行半定量的测定,如放射性核素可直接在放射测定仪上测量计数,或放射自显影后利用人工或计算机辅助的图像分析检测仪检测银粒的数量和分布的差异。非放射性核酸探针杂交的细胞或组织可利用酶检测系统显色,然后利用显微分光光度计或图像分析仪对不同类型和数量的核酸的显色强度进行检测。荧光显示的可用荧光图像定量仪分析。
6.对照实验和ISH结果的判断 原位杂交较易出现假阳性,故必须同时有对照实验以证明其特异性。对照实验的设置需根据核酸探针和靶核苷酸的种类和现有的可能条件去选定。从理论上讲,对照实验设置越多其靶核苷酸特异性确定越可靠,但现实是不可能的。因此,在上述对照实验中应任选设至少3~4种用以证实原位杂交结果的可靠性。①Northern和Southern印迹杂交法证明的方式和用Western印迹法检测抗体(蛋白质)的特异性一样,是比较可靠的。②可结合的免疫组织化学在相邻切片或同一切片中证明同一种多肽和相应mRNA共存于同一细胞中。③预先将切片用DNA酶或RNA酶消化,作为阴性对照。④采用同义RNA探针杂交,由于同义RNA探针和组织内mRNA序列顺序是相同的,应用其进行杂交,结果应为阴性。⑤采用大大过量的未标记探针进行竞争结合,结果应为阴性。⑥省去探针,即检测系统的对照如乳胶或酶显色系统在无标记探针的情况下进行。⑦省去检测抗体等。
(二)原位杂交的应用
1.荧光原位杂交(fluorescence in situ hybridization,FISH) 是一种利用非放射性的荧光信号对原位杂交样本进行检测的技术。它的基本原理是:如果被检测的染色体或DNA纤维切片上的靶DNA或细胞中RNA与所用的核酸探针是同源互补的,两者经变性-退火-复性,即可形成靶DNA或RNA与核酸探针的杂交体。将核酸探针的某一种核苷酸标记上报告分子,如生物素和地高辛,可利用该报告分子与荧光素标记的特异亲和素之间的免疫化学反应,经荧光检测体系在镜下对待测DNA或RNA进行定性、定量或相对定位分析。它将荧光信号的高灵敏度、安全性,荧光信号的直观性和原位杂交的高准确性结合起来,通过荧光标记的探针与待测样本的核酸进行原位杂交,在荧光显微镜下对荧光信号进行辨别和计数,从而对染色体或基因异常的细胞、组织样本进行检测和诊断,为各种基因相关疾病的分型、预前和预后提供准确的依据。FISH技术作为非放射性检测体系,具有以下优点:①荧光试剂和探针经济、安全;②探针稳定,一次标记后可在2年内使用;③实验周期短、能迅速得到结果、特异性好、定位准确;④FISH可定位长度在1kb的DNA序列,其灵敏度与放射性探针相当;⑤多色FISH通过在同一个核中显示不同的颜色可同时检测多种序列;⑥既可以在玻片上显示中期染色体数量或结构的变化,也可以在悬液中显示间期染色体DNA的结构。
随着FISH相关技术M-FISH、基因组杂交(CGH)等的不断发展,以及近年来微阵列技术(Microarray)的不断成熟,Abbott-Vysis公司还推出了世界上第一个染色体组芯片GenoSensor Array 300,将287个疾病相关的基因集成在一张芯片上,通过一次扫描即能检测287个疾病相关基因的正/异常,使大规模筛查基因相关疾病成为可能。笔者相信,FISH技术作为直观的基因、染色体检测技术,必将在临床的疾病诊断中发挥更大的作用。
2.其他应用
(1)以基因组为探针的基因组原位杂交(GISH)技术可以定位外源DNA片段在染色体上的位置、大小、插入点等。Durnam(1985)首先将GISH应用于体细胞杂种的异源染色体检测。
(2)以不同的荧光素标记探针的多色荧光原位杂交(muticolor-FISH,M-FISH),可以同时定位不同探针序列的分布。1990年Nederlof等创建了多色荧光原位杂交技术。他们用生物素、AAF(氨基乙酰荧光素)和CP 3种半抗原对不同探针做单、双、三标记,再用这3种半抗原相应的分别标记了异硫氰酸荧光素(FITC,绿色)、氨甲香豆素乙酸(AMCA,蓝色)和碱性蕊香红(TRITC,红色)的抗体来检测荧光,该技术最多可同时观察7个靶染色体。
(3)以正常基因组DNA与异常基因组DNA混合为探针,以正常中期染色体为靶目标的比较CGH技术可以根据两种探针信号的强度差异找出基因组中DNA增加或缺失区域。目前CGH在实体瘤研究中得到了最先和最广泛的应用,如小细胞癌、乳腺癌、神经胶质癌、膀胱癌和前列腺癌等。
(4)以单一染色体文库为探针,以异常染色体为靶目标的染色体涂色技术特别适合于检出染色体多体和易位。
(5)以显微分离的异常染色体区段为探针,以正常染色体为靶目标的反向染色体涂色技术可以确定异常染色体区段的来源。
(6)直接在靶DNA上以探针为引物进行原位合成的引物原位DNA合成技术(primed in situ DNA synthesis,PRINS)和原位PCR技术(PCR in situ)提高了原位杂交的效率和检测的灵敏度。前者是由Koch等人1989年建立的,将重复序列α-卫星DNA定位到了人类染色体上。该技术不但可用于已知基因或序列的染色体定位,而且也可用于未克隆基因或遗传标记及染色体畸变的研究。在基因定性、定量、整合和表达等方面的研究中颇具优势。
除了以上应用外,ISH还应用于基因表达定位(localization of gene expression)、核DNA和RNA的排列分析、mRNA的排列和运输(arrangement and transport of mRNA)及细胞的分类(sorting of cells)等。
四、其他固相杂交方法
1.斑点杂交和狭缝杂交 斑点杂交(dot hybridization)和狭缝杂交(slot hybridization)为直接将核酸点在膜上进行的杂交。主要用于分析细胞基因拷贝数的变化和转录水平的变化。与Southern和Northern杂交相比,其优点为简便、快速地检测微量核酸,且可以半定量分析,不需要酶切和电泳,在一张膜上可同时进行多个样品的检测,如斑点杂交的一张膜可点96个样品,可应用于大量样品的筛选。斑点杂交一般采用真空抽滤加样器点样,斑点为圆形(图4-15),狭缝杂交采用线槽点样,斑点为线状,多为比较核酸量的多少(图4-16)。但由于是直接点样,所有的DNA和RNA都在一个孔中,无关核酸容易导致非特异杂交,造成假阳性结果,因此斑点杂交多用于初筛。

图4-15 斑点杂交
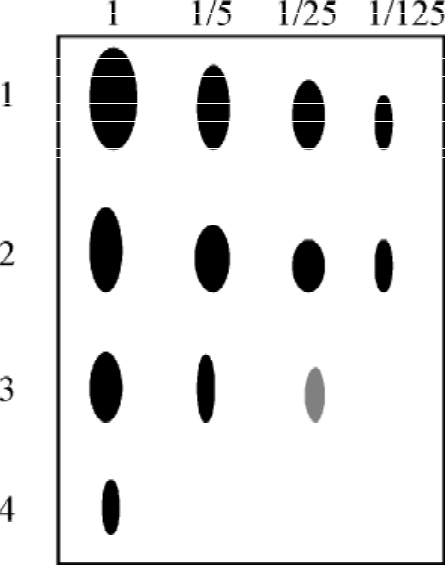
图4-16 狭缝杂交
2.菌落原位杂交 是将培养板上生长的菌落转移到膜上,然后与探针进行杂交,筛选具有特定DNA片段的菌落,用于克隆鉴定,过程见图4-17。
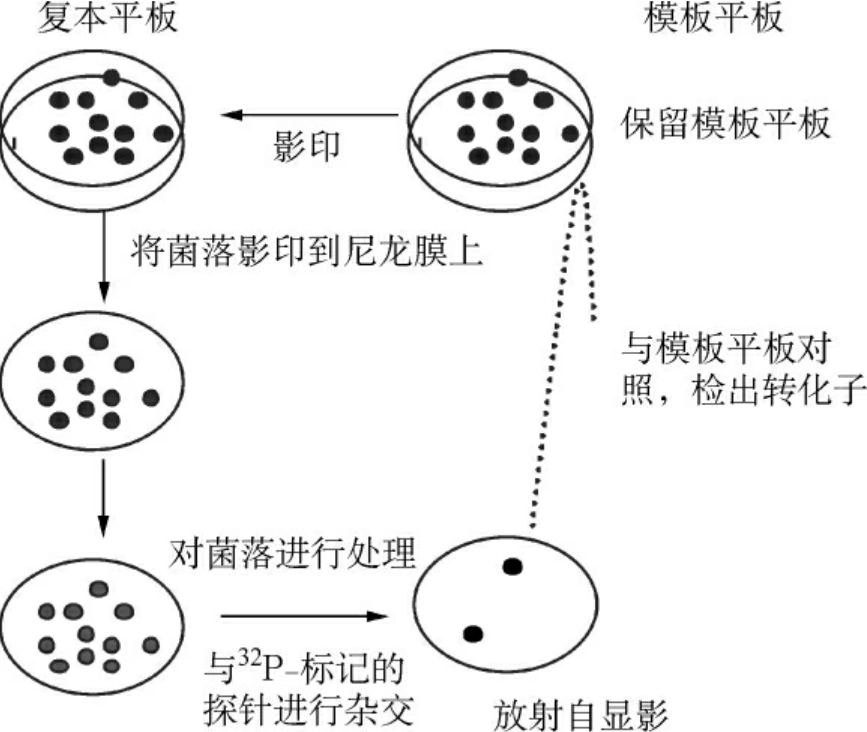
图4-17 菌落原位杂交
3.固相夹心杂交 夹心杂交是在固相支持物上连着捕捉探针,可与液相中的靶基因的一段序列杂交。而带有标记物的检测探针与靶基因的另一段序列杂交而进行检测。夹心杂交的优点是对样品纯度要求不高、特异性更高和定量较准确。
五、液相杂交
液相杂交是指待测核酸和标记的探针都存在于杂交液中,碱基互补的核酸单链在液体中配对形成杂交体。有以下几种杂交双链的分离和检测方法。
1.核酸酶S1保护分析法 首先利用M13噬菌体体系合成高放射活性的单链DNA探针,然后探针与待测RNA样品在液相中进行杂交;形成DNA/RNA杂交双链。核酸酶S1能专一性地降解未形成杂交的DNA和RNA单链,而DNA/RNA杂交双链则受到保护而不被降解。回收杂交双链进行电泳分析。选择适当的探针,还可进行基因转录起始位点分析及内含子剪切位点分析等。
2.RNA酶保护分析法(RNase protection assay,RPA) 其原理与核酸酶S1保护分析法基本相同,只是所采用的探针为单链RNA探针,杂交后形成RNA/RNA双链。RNA酶A和T1专一性降解单链RNA而双链RNA则受到保护。其灵敏度较之Northern杂交法高,甚至比核酸酶S1保护分析法还要高数倍。此法也对mRNA进行较为准确的定量,也可进行mRNA末端定位和内含子在基因中位置的确定。
3.吸附杂交
(1)HAP吸附杂交:羟基磷灰石(HAP)层析或吸附是液相杂交中最早使用的方法。在液相中杂交后,DNA∶DNA杂交双链在低盐条件可特异地吸附到HAP上,通过离心使吸附有核酸双链的HAP沉淀,再用缓冲液离心漂洗几次HAP,然后将HAP置于计数器上进行放射性计数。
(2)亲和吸附杂交:生物素标记DNA探针与溶液中过量的靶RNA杂交,杂交物吸附到酰化亲和素包被的固相支持物(如小球)上,用特异性抗DNA/RNA杂交物的酶标单克隆抗体与固相支持物上的杂交物反应,加入酶显色底物,这个系统可快速检测RNA。
(3)磁珠吸附杂交:应用吖啶翁酯(acridinium ester)标记DNA探针,这种试剂可用更敏感的化学发光来检测。探针和靶杂交后,杂交物可特异地吸附在磁化的有孔小珠(阳离子磁化微球体上)。溶液中的磁性小珠可用磁铁吸出,经过简单的漂洗步骤,吸附探针的小珠可用化学发光测定。
4.发光液相杂交
(1)能量传递法:Heller等设计用两个紧接的探针,一个探针的一端用化学发光基团(供体)标记;另一个探针的一端用荧光物质标记,并且这两个探针靠得很近。两个靠得很近的探针用不同的物质标记(标记光发射),当探针与特异的靶杂交后,这些标记物靠得很近。一种标记物发射的光被另一种标记物吸收,并重新发出不同波长的光,调节检测器使自动记录第2次发射光的波长。只有在两个探针分子靠得近时,才能产生受激发光,因此这种方法具有较好的特异性。
(2)吖啶翁酯标记法:吖啶翁酯标记探针与靶核酸杂交后,未杂交的标记探针分子上的吖啶翁酯可以用专门的方法选择性除去,所以杂交探针的化学发光是与靶核酸的量成比例的。该法的缺点是检测的敏感度低(约1ng的靶核酸),仅适用于检测扩增的靶序列,如rRNA或PCR扩增产物。
5.液相夹心杂交 在靶核酸存在下,两个探针与靶杂交,形成夹心结构,杂交完成后,杂交物可移到新的管或凹孔中,在其中杂交物上的吸附探针可结合到固相支持物上,而杂交物上的检测探针可产生检测信号。用生物素标记吸附探针,用125I标记检测探针,这个系统的敏感性可检测出4×106靶分子。该实验保持了固相夹心杂交的高度特异性。
6.复性速率液相分子杂交 这个方法的原理是细菌等原核生物的基因组DNA通常不包含重复顺序。它们在液相中复性(杂交)时,同源DNA比异源DNA的复性速度要快。同源程度越高,复性速率和杂交率越快。利用这个特点,可以通过分光光度计直接测定变性DNA在一定条件下的复性速率,进而用理论推导的数学公式来计算DNA-DNA之间的杂交(结合)度。
(潘銮凤 朱华庆)
参考文献
1.董玉玮,等.PCR和随机引物标记探针的方法比较.生物学杂志,2007,24(1):63~66
2.武永飞,张建华,李生斌.地高辛标记的原位杂交法检测神经肽Y表达的条件优化.西安:第四军医大学学报,2004,25(14):1260~1262
3.王卉放,许化溪,王胜军等.磁珠捕获技术在定量液相杂交中的应用.镇江:江苏大学学报(医学版),2003,13(4):285~288
4.章晓波,徐洵.荧光探针研究新进展.生物工程进展,2000,20(2):14~16
5.陈成忠,于洪芹.荧光原位杂交技术及其应用.生物学教学,2007,32(1):2~4
6.王全喜.染色体荧光原位杂交技术的原理及其应用.畜牧与饲料科学,2005,3:36~38.
7.孙崇秀,宗卉,单祥年.比较基因组杂交近期应用及进展.国外医学·遗传学分册,2001,24(2):57~60
8.冯作化主编.医学分子生物学.北京:人民卫生出版社,2001
9.张钦宪,何丽娅,李平法主编.医学分子生物学.郑州:郑州大学出版社,2003
10.杨吉成,陈子兴主编.医用分子生物学.北京:化学工业出版社,2004
11.王廷华,冯忠堂,Jean Philippe Merlio主编.分子杂交理论与技术.北京:科学出版社,2005
12.谷志远主编.现代医学分子生物学.北京:人民军医出版社,1998
13.萨姆布鲁克等主编,金冬雁等译.分子克隆实验指南.第二版.北京:科学出版社,1995
14.高天祥主编.医学分子生物学.北京:科学出版社,2000
15.Varshavsky A.Discovering the RNA double helix and hybridization.Cell,2006,127:1295~1297
16.Coleman WB and Tsongacis GJ.Molecular Diagnostics for Clinicial Labortory.Humana Press,1997
17.Southern EM.Detection of specific sequences among DNA fragments separated by gel electrophoresis.J Mol Biol,1975,98:503~517
18.Nederlof PM et al.Multiple fluorescence in situ hybridisation.Cytometry,1990,11:126~131
19.Chudoba I et al.High resolution multicolor-banding:a new technique for refined FISH analysis of human chromosome.Cytogenet Cell Genet,1999,84:156~160
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。
















