第三节 细胞损伤、衰老与死亡
“生、老、病、死”是生命的四重奏。人类自出生总要经过生长、发育、成熟、衰老直至死亡的几个阶段,这是生命的必然规律。人体是由细胞组织起来的,组成细胞的化学物质在运动中不断受到内外环境的影响而发生损伤,致使人体内某些细胞不断地衰老与死亡。细胞的衰老与死亡是新陈代谢的自然现象。
一、细胞损伤
细胞损伤是许多疾病发生的基础,导致细胞损伤的因素包括缺氧,物理因素(机械性、高低温、高低气流、电流、射线等),化学因素,药物和生物因素(细菌、病毒、真菌、寄生虫等),营养失衡,内分泌,免疫反应,遗传变异,医源性因素,心理因素等。细胞损伤可分为可逆性损伤和不可逆性损伤。第3种情况是细胞损伤后产生了适应,在形态上表现为萎缩、肥大、增生和化生(图1-17)。
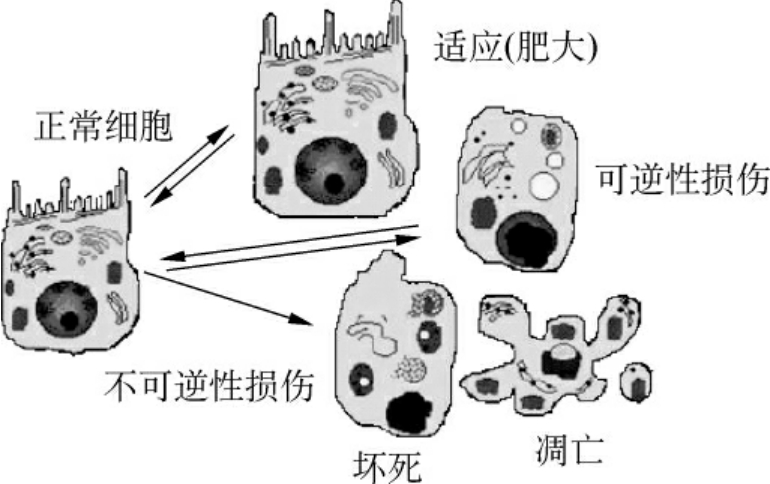
图1-17 细胞损伤及其反应
1.可逆性损伤 指损伤的刺激轻微且当去除时,所发生的细胞改变可以恢复。可逆性损伤可表现为形态正常而功能异常的损伤,也可表现出细胞形态的改变,如非致死性缺氧细胞损伤的早期,主要表现为细胞水肿。因有害物导致细胞膜通透性增加,Na+和Ca2+进入细胞内,钾流出,水进入细胞内。此外,感染和中毒引起的肝的脂肪变性,血管壁及结缔组织和细胞内的玻璃样变性、淀粉样变性、黏液样变性、病理性色素沉着、病理性钙化均为细胞或组织的可逆性损伤。
2.不可逆性损伤 常常由严重而持续的损伤所造成的,最终导致细胞死亡。不可逆性损伤表现有严重的线粒体空泡化,溶酶体肿胀和线粒体内出现大的无定形致密体。特别是ATP生成的减少和细胞膜的损伤为两个关键性变化。不可逆性损伤细胞的死亡有两种形式,即坏死和凋亡,将在下面描述。
3.细胞损伤的发生机制
(1)细胞膜的损伤:细胞损伤常引发细胞质内Ca2+增加,活化细胞内蛋白酶和磷脂酶,造成细胞骨架成分和膜磷脂的降解,导致细胞膜完整性丧失。另外,细胞膜表面的变化会激活补体通路,损伤细胞膜。细胞膜损伤常导致膜通透性的改变,进而引起细胞水肿和裂解。线粒体膜的损伤则会损害细胞的能量代谢。溶酶体膜的破坏将水解酶释放到细胞质中,引发了细胞蛋白的自主消化。
(2)能量生成的破坏:细胞的代谢和生物合成都是需要能量的驱动,能量主要以ATP形式存在于细胞内。ATP的形成需要糖类作为原料和氧气的供给。低糖、缺氧都会导致细胞产能的降低,影响了细胞正常生存所需要的结构和功能蛋白质的合成。同时,细胞产能需要一系列酶的参与,损伤因素若破坏了其中关键酶的活性,会导致急性ATP缺乏,引起细胞死亡。另一方面,细胞损伤时所造成的线粒体肿胀或线粒体膜的损坏,使氧化磷酸化失偶联,有氧呼吸不能产生ATP。
(3)代谢的异常:正常细胞代谢是在一系列酶和能量作用下,并以严格调控方式定序、定量、定位进行的。一方面,细胞能量生成的减少和破坏,代谢酶合成的减少,酶的失活,使正常代谢受阻;另一方面,一些蛋白水解酶的释放、有些蛋白酶的激活使细胞骨架蛋白遭受破坏,均使细胞损伤加剧。
此外许多损伤因素,特别是化学和生物因素以及射线常引发过量自由基的产生,包括超氧自由基和羟自由基。这些自由基非常活泼,具有高度反应性,与细胞重要成分发生反应,使蛋白质交联和脂质过氧化,并诱导DNA突变以及干扰细胞生长等作用引起细胞损伤。
(4)基因的改变:辐射、致突变化学品和药品以及病毒都可能引起DNA的损伤。DNA损伤可大致分为碱基损伤和DNA链损伤两类。DNA损伤的结果:①使其复制受到影响;②基因的表达失控;③基因产物的结构和功能异常。
基因改变对细胞的影响取决于:①损伤的严重程度;②损伤施与的时期;③受影响的基因性质。不可修复的基因改变可能会导致病变如肿瘤,严重的可导致细胞死亡。
二、细胞衰老
细胞衰老是指细胞在正常环境条件下发生的功能减退,逐渐趋向死亡的现象。衰老是生物界的普遍规律,细胞作为生物有机体的基本单位,也在不断地新生和衰老死亡。衰老是一个过程,这一过程的长短即细胞的寿命,它随组织种类而不同,同时也受环境条件的影响。高等动物体细胞都有最大分裂次数,细胞分裂一旦达到这一次数就要死亡。各种动物的细胞最大分裂次数各不相同,人细胞为50~60次。一般说来,细胞最大分裂数与动物的平均寿命成正比。根据人体细胞寿命情况将细胞分为3种类型:第一类,细胞的寿命接近于动物的整体寿命,如神经元、脂肪细胞、肌细胞等;第二类,是缓慢更新的细胞,其寿命比机体的寿命短,如肝细胞、胃壁细胞等;第三类,是快速更新的细胞,如皮肤的表皮细胞、红细胞和白细胞等,它们在正常情况下终身保持分裂能力或不断由前体细胞进行分化补充。细胞衰老时会出现水分减少、老年色素——脂褐色素累积、酶活性降低、代谢速率变慢等一系列变化。关于细胞衰老目前已有不少假说,主要包括遗传因素学说、细胞损伤学说、生物大分子衰老学说等,有整体水平的,有器官、组织水平,也有细胞和分子水平的。都有一定的实验基础,但都是从一个侧面来解释衰老这一复杂现象,都有局限性,还不能全面地说明衰老的全过程。
1.细胞衰老的特征
(1)形态变化:衰老细胞的形态变化主要表现在细胞皱缩,膜通透性、脆性增加,核膜内折,细胞器数量特别是线粒体数量减少,胞内出现脂褐素等异常物质沉积,最终出现细胞凋亡或坏死。总体来说老化细胞的各种结构呈退行性变化。
(2)分子水平的变化:衰老细胞会出现脂类、蛋白质和DNA等细胞成分损伤,细胞代谢能力降低,主要表现在以下方面。①DNA:复制与转录受到抑制,但也有个别基因会异常激活,端粒DNA丢失,线粒体DNA特异性缺失,DNA氧化、断裂、缺失和交联,甲基化程度降低。②RNA:mRNA和tRNA含量降低。③蛋白质:合成下降,细胞内蛋白质发生糖基化、氨甲酰化、脱氨基等修饰反应,导致蛋白质稳定性和可消化性下降。自由基使蛋白质肽链断裂、交联而变性;氨基酸由左旋变为右旋。④酶分子:活性中心被氧化,金属离子Ca2+、Zn2+、Mg2+、Fe2+等丢失,酶分子的二级结构、溶解度等电点发生改变,总的效应是酶失活。⑤脂类:不饱和脂肪酸被氧化,引起膜脂之间或与脂蛋白之间交联,膜的流动性降低。
2.细胞衰老的机制:关于衰老的机制具有许多不同的学说,概括起来主要有差错学派和遗传学派两大类,前者强调衰老是由于细胞中的各种错误积累引起的,后者强调衰老是遗传决定的自然演进过程。其实,现在看来两者是相互统一的。
(1)差错学派:细胞衰老是各种细胞成分在受到内外环境的损伤作用后,因缺乏完善的修复,使“差错”积累,导致细胞衰老。根据对导致“差错”的主要因子和主导因子的认识不同,可分为不同的学说,代谢废物积累、大分子交联、自由基学说、线粒体DNA突变、体细胞突变与DNA修复和重复基因失活,这些学说各有实验证据,但都不完全。
(2)遗传学派:认为衰老是遗传决定的自然演进过程,一切细胞均有内在的预定程序决定其寿命,而细胞寿命又决定种属寿命的差异,外部因素只能使细胞寿命在限定范围内变动。其中程序性衰老理论、复制性衰老理论为遗传学派的两大学说,包括细胞凋亡、端粒衰老、内分泌功能减退、中枢神经系统衰退、免疫衰老等学说。另外,还认为DNA链上可能存在一些“长寿基因”和“衰老基因”来决定个体的寿限。
三、细胞死亡
细胞死亡(cell death)的一般定义是细胞生命现象不可逆的停止。细胞死亡有两种形式:一种为坏死性死亡,是由外部的化学、物理或生物因素的侵袭而造成的细胞崩溃裂解;另一种为细胞凋亡,是细胞在一定的生理或病理条件下按照自身的程序结束其生存。
1.细胞坏死(necrosis) 是细胞受到外部的化学、物理或生物因素的侵袭而造成的细胞崩溃裂解,引起细胞死亡的现象。坏死细胞的形态改变主要是由下列两种病理过程引起的,即酶性消化和蛋白变性。参与此过程的酶,如来源于死亡细胞本身的溶酶体则称为细胞自溶(autolysis);若来源于浸润坏死组织内白细胞溶酶体则称为异溶(heterolysis)。由于坏死细胞内容物流出,引起周围组织炎症反应。
2.细胞凋亡(cell apoptosis) 是借用古希腊语,表示细胞像秋天的树叶一样凋落的死亡方式。1965年澳大利亚科学家发现,结扎大鼠门静脉后,电镜观察到肝实质组织中有一些散在的死亡细胞,这些细胞的溶酶体并未被破坏,显然不同于细胞坏死。这些细胞体积收缩、染色质凝集,从其周围的组织中脱落并被吞噬,机体无炎症反应。1972年Kerr等首次提出了细胞凋亡的概念,宣告了对细胞凋亡的真正探索的开始。在此之前,关于胚胎发育生物学、免疫系统的研究、肝细胞死亡的研究都为这一概念的提出奠定了基础。
形态学观察细胞凋亡的变化是多阶段的,细胞凋亡往往涉及单个细胞,即便是一小部分细胞也是非同步发生的(图1-18)。首先出现的是细胞体积缩小,连接消失,与周围的细胞脱离,然后是细胞质密度增加,线粒体膜电位消失,通透性改变,释放细胞色素C到胞质,核质浓缩,核膜核仁破碎,DNA降解成为180~200bp片段,电泳呈现出梯状(1adder)谱型(图1-19);胞膜有小泡状形成,膜内侧磷脂酰丝氨酸外翻到膜表面,胞膜结构仍然完整,最终可将凋亡细胞遗骸分割包裹为几个凋亡小体(apoptotic body),无内容物外溢,因此不引起周围的炎症反应,凋亡小体可迅速被周围专职或非专职吞噬细胞吞噬。
虽然凋亡与坏死的最终结果极为相似,但它们的过程与表现却有很大差别。坏死是细胞受到强烈理化或生物因素作用引起细胞无序变化的死亡过程。表现为细胞体积肿胀变大,胞膜破裂,细胞内容物外溢,核变化较慢,DNA降解不充分,引起局部严重的炎症反应。凋亡是细胞对环境的生理性病理性刺激信号,环境条件的变化或缓和性损伤产生应答的有序变化过程。其细胞及组织的变化与坏死有明显的不同(表1-1)。
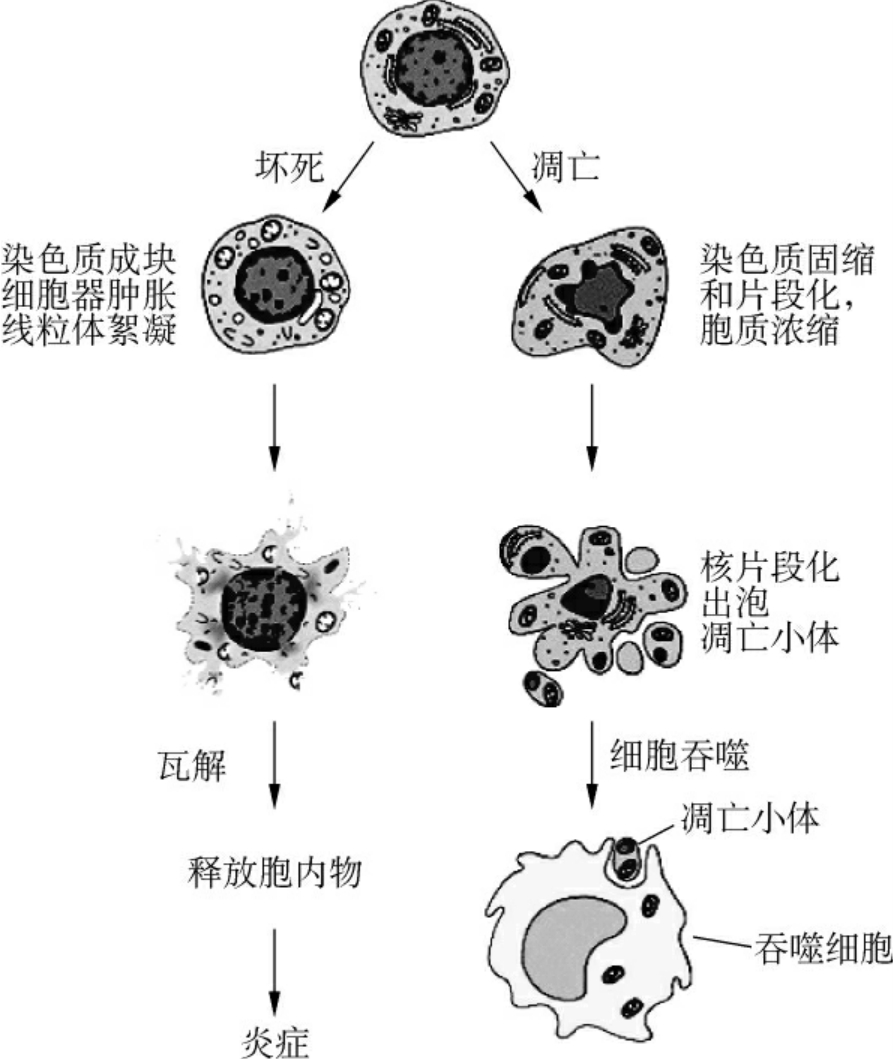
图1-18 细胞凋亡与细胞坏死

图1-19 细胞凋亡的DNA梯状谱型
表1-1 细胞凋亡与细胞坏死的比较

细胞凋亡通常又称为程序性细胞死亡(programmed cell death,PCD),是指为维持内环境稳定,由基因控制的细胞自主有序性的死亡。它涉及一系列基因的激活、表达以及调控等的作用,因而是具有生理性和选择性的。它在多细胞生物的组织分化、器官发育、机体稳态的维持中有着重要的意义。机体在产生新生细胞的同时,衰老和突变的细胞被通过凋亡机制而清除,使器官和组织得以正常地发育和代谢。细胞凋亡也参与一些病理过程,如肿瘤、自身免疫性疾病、病毒感染和神经退化性疾病等。在细胞凋亡一词出现之前,胚胎学家已观察到动物发育过程中存在着细胞程序性死亡现象,它是胚胎正常发育所必需的。
近年来PCD和细胞凋亡常被作为同义词使用,但两者实质上是有差异的。首先,PCD是一个功能性概念,描述在一个多细胞生物体中,某些细胞的死亡是个体发育中一个预定的,并受到严格控制的正常组成部分,而凋亡是一个形态学概念,指与细胞坏死不同的受到基因控制的细胞死亡形式。其次,PCD的最终结果是细胞凋亡,但细胞凋亡并非都是程序化的。目前一般认为凋亡和程序性死亡两个概念可以交互使用,具有同等意义。
3.细胞凋亡的分子机制 细胞凋亡是基因调控作用的结果。有很多基因参与调控细胞凋亡过程,调控环节包括信号转导、基因表达、蛋白质生物合成和代谢过程等。细胞凋亡的调控涉及许多基因,包括一些与细胞增殖有关的原癌基因和抑癌基因。这些基因又称为细胞凋亡相关基因,其中研究较多的有ICE、Apaf-1、bcl-2、Fas/APO-1、c-myc、p53、ATM等。这些基因在细胞凋亡过程的不同阶段发挥作用。
细胞凋亡的过程大致可分为以下几个阶段:①接受凋亡信号;②凋亡调控分子间的相互作用;③蛋白水解酶(caspase)的活化;④进入连续反应过程,直到细胞死亡。
(1)凋亡的启动阶段:细胞凋亡的启动是细胞在感受到相应的信号刺激后胞内一系列控制开关的开启或关闭,不同的外界因素启动凋亡的方式不同,所引起的信号转导也不相同,客观上说对细胞凋亡过程中信号传递系统的认识还是不全面的。如果细胞外的信号促进程序性细胞死亡,则属于死亡的正控制。若细胞外信号抑制细胞的程序性死亡,则是死亡的负控制,将这种信号称为存活因子(survival factors)。
1)细胞凋亡的膜受体通路:细胞表面的凋亡受体是属于肿瘤坏死因子受体(TNFR)家族的跨膜蛋白,它们包括Fas(Apo-1/CD95)、TNFR1、DR3/WSL、DR4/TRAIL-R1和DR5/TRAIL-R2。其配体属于TNF家族,目前已比较清楚的是Fas介导的细胞凋亡途径。
Fas具有3个富含半胱氨酸的胞外区和一个称为死亡结构域(death domain,DD)的胞内区。Fas的配体(Fas ligand,FasL)与Fas结合后,Fas三聚化使胞内的DD区构象改变,然后与接头蛋白FADD(Fas-associated death domain)的DD区结合,而后FADD的N端DED区(death effector domain)就能与caspase-8(或10)前体蛋白结合,形成诱导死亡信号复合物(death-inducing signaling complex,DISC),引起caspase-8或10通过自身剪切激活,然后它们启动caspase的级联反应,使caspase-3、6和7激活,这几种caspase可降解胞内结构蛋白和功能蛋白,最终导致细胞凋亡。
2)细胞内信号对细胞凋亡的激发:线粒体是细胞生命活动控制中心,它不仅是细胞呼吸链和氧化磷酸化的中心,而且是细胞凋亡调控中心。实验表明了细胞色素C从线粒体释放是细胞凋亡的关键步骤。释放到细胞质的细胞色素C在dATP存在的条件下能与凋亡相关因子1(apoptotic protease-activating factor,Apaf-1)结合,使其形成多聚体,并促使caspase-9与其结合形成凋亡小体,被激活的caspase-9能激活其他的caspase如caspase-3等,从而诱导细胞凋亡。
(2)细胞凋亡的执行:尽管细胞凋亡过程的详细机制尚不完全清楚,但已了解所有的动物细胞都有一种相类似的控制细胞凋亡的机制,即通过一个自杀性蛋白酶家族的介导,这种蛋白酶在诱导程序化死亡信号的作用下通过自我切割而激活。激活的自杀性蛋白酶又可激活家族中的其他成员,引起蛋白质酶解的级联反应。在该反应系统中,上一级的信号激活下一级的一个关键蛋白,并快速将其水解,从而使信号得以放大。最后被激活的蛋白酶切割了细胞与程序性细胞死亡相关的关键蛋白,如核纤层蛋白,从而快速引起有控制的细胞死亡。
级联反应中的自杀性蛋白水解酶就是caspase,即天冬氨酸特异性半胱氨酸蛋白酶,简称胱解酶。到目前为止,至少已有14种caspase被发现。caspase分子间的同源性很高,结构相似,都是半胱氨酸家族蛋白酶,根据功能可把caspase基本分为两类:一类参与细胞的加工,如Pro-IL-1β和Pro-IL-1δ,形成有活性的IL-1β和IL-1δ;第二类参与细胞凋亡,包括caspase-2、3、6、7、8、9和10。
参与细胞凋亡的caspase归成两类:一类是起始者,另一类是执行者。起始caspase在外来蛋白信号的作用下被切割激活,激活的起始caspase对执行者caspase进行切割并使之激活,被激活执行者caspase通过对caspase靶蛋白的水解,导致程序性细胞死亡。
研究表明,能够被caspase切割的靶蛋白包括以下几种类型。
1)蛋白激酶:caspase能够切割10多种蛋白激酶,如黏着斑激酶(focal adhesion kinase,FAK)、PKB、PKC以及Raf1。如果黏着斑激酶被破坏了,即破坏了细胞的黏着,使得细胞与相邻细胞失去黏着而导致程序性死亡。
2)核纤层蛋白:是位于细胞核内膜下的一层纤维结构,对内膜具有支撑作用。核纤层蛋白被切割,导致核纤层解体、核被膜浓缩。
3)细胞结构蛋白:一些维持细胞结构必需的蛋白质,如中间纤维、肌动蛋白和凝胶溶解蛋白(gelsolin)等,被caspase切割后导致细胞形态的改变。
4)与DNA修复相关的酶类:遭caspase切割后失活。由于DNA的修复是维持细胞内环境稳定的主要因素,这一因素遭到破坏,合成的DNA难以保证正确,因而导致程序性细胞死亡。
5)caspase激活的DNase(CAD)抑制蛋白:caspase能够将CAD抑制蛋白水解,导致这种酶被激活。该酶是一种内切核酸酶,被激活后从细胞质转移到细胞核,与核DNA结合并将DNA切割成片段。
(3)细胞凋亡的调节:细胞凋亡受到严格调控,在正常细胞caspase处于非活化的酶原状态,凋亡程序一旦开始,caspase被激活,随后发生凋亡蛋白酶的层叠级联反应,发生不可逆的凋亡。细胞凋亡通过正负两个方面进行调控,即诱导因子和抑制因子参与的过程。诱导因素较多,前面已提及细胞外和细胞内的启动信号,在此仅介绍部分抑制因子。
1)凋亡抑制分子:迄今为止,已发现多种凋亡抑制分子,包括p35、CrmA、IAPs、FLIPs以及Bcl-2家族的凋亡抑制分子。杆状病毒蛋白p35和牛痘病毒蛋白CrmA是广谱凋亡抑制剂,体外研究结果表明p35以竞争性结合方式与靶分子形成稳定的具有空间位阻效应的复合体并且抑制caspases活性。Crm A(cytokine response modifier A)是血清蛋白酶抑制剂,能够直接抑制多种蛋白酶的活性,但目前还未发现在哺乳动物中存在p35和Crm A的同源分子。
FLIPs(FLICE-inhibitory proteins)能抑制Fas/TNFR-1介导的细胞凋亡。它有多种变异体,但其N端功能前区(prodomain)完全相同,C端长短不一。FLIPs通过DED功能区,与FADD和caspase-8和10结合,拮抗它们之间的相互作用,从而抑制caspase-8和10募集到死亡受体复合体以及死亡受体复合体的起始化。
凋亡抑制蛋白(inhibitors of apoptosis protein,IAPs)为一组具有抑制凋亡作用的蛋白质,首先从杆状病毒基因组中克隆到,发现其能够抑制由病毒感染引起的宿主细胞死亡应答。它们主要抑制caspase-3和caspase-7,但不结合它们的酶原;对caspase-8则既可以结合活化的caspase-8,又可结合caspase-8酶原,进而抑制细胞凋亡。
2)Bcl-2家族:这一家族有众多成员,目前已经在哺乳动物、线虫和细菌中发现并鉴定出了Bcl-2家族的20余种蛋白质,根据它们在细胞凋亡中的作用可分为两类:一类是抗凋亡蛋白,包括Bcl-2、Bcl-xL、Bcl-w、Mcl-1、Al、Boo和Ced-9等10余个成员;另一类是促凋亡蛋白,包括Bax、Bak、Bc-xS、Bid、Bad和Egl-1等10余个成员。多数成员间有两个结构同源区域,在介导成员之间的二聚体化过程中起重要作用。Bcl-2成员之间的二聚体化是成员之间功能实现或功能调节的重要形式。Bcl-2生理功能是阻遏细胞凋亡,延长细胞寿命,在一些白血病中Bcl-2呈过度表达。Bcl-2的亚细胞定位已经明确,它在不同的细胞类型可以定位于线粒体、内质网以及核膜上,并通过阻止线粒体细胞色素C的释放而发挥抗凋亡作用。此外,Bcl-2具有保护细胞的功能,Bcl-2的高表达可引起细胞核谷胱甘肽(GSH)的积聚,导致核内氧化还原平衡的改变,从而降低了caspase的活性。Bax是Bcl-2家族中参与促进细胞凋亡的一个成员,具有对抗Bcl-2蛋白抑制凋亡的作用。研究发现Bcl-2/Bax两种蛋白之间的比例是决定对细胞凋亡抑制作用强弱的关键因素。因此认为,Bax是极重要的促细胞凋亡的因子之一,它可能是通过形成Bcl-2-Bax复合物或通过其他Bcl-2作用靶的竞争来实现的。Bax与线粒体膜结合,释放细胞色素C、凋亡诱导因子(AIF)等。细胞色素C等与凋亡促进因子-1(Apaf-1)和caspase-9结合形成复合物,激活CAD,造成基因组DNA裂解,并失活DNA修复相关酶(DNA-PK、PARA),造成DNA修复能力低下,分解细胞骨架等凋亡执行过程。
总之,细胞凋亡的调节是非常复杂的,参与的分子也非常多,还有很多不为人们所知的机制需要进一步的探索。
4.细胞凋亡与医学 细胞凋亡之所以成为人们研究的一个热点,在很大程度上决定于细胞凋亡与临床疾病的密切关系。这种关系不仅表现在对凋亡及其机制的研究阐明了一大类免疫病的发病机制,而且由此可以导致疾病新疗法的出现,特别是细胞凋亡与肿瘤及艾滋病之间的密切关系备受人们关注。
(1)HIV病毒感染造成CD4+细胞减少是通过细胞凋亡机制:获得性免疫缺陷综合征(acquired immunodeficiency syndrome,AIDS),简称艾滋病,是由人类免疫缺陷病毒(human immunodeficienc virus,HIV)感染所致的以循环CD4+T细胞显著下降、机会感染及恶性疾病为特征的继发性免疫缺陷综合征。AIDS的发病机制尚未完全阐明,但病毒和宿主因素相互作用的复杂过程是其主要原因。AIDS的最主要的特征之一是CD4+T细胞的逐渐丢失。HIV通过合胞体依赖凋亡和HIV产物依赖凋亡杀死淋巴细胞。这一细胞凋亡机制不仅阐明了AIDS时CD4+T细胞减少的主要原因,同时也为AIDS的治疗研究指明了一个重要的探索方向。
(2)从细胞凋亡角度看,肿瘤的发生是由于凋亡受阻所致:一般认为恶性转化的肿瘤细胞是因为失控生长、过度增殖,从细胞凋亡的角度看则认为是肿瘤细胞的凋亡机制受到抑制,不能正常进行细胞死亡清除的结果。肿瘤细胞中有一系列的癌基因和原癌基因被激活,并呈过表达状态。这些基因的激活和肿瘤的发生发展之间有着极为密切的关系。这些癌基因及其表达产物也是细胞凋亡的重要调节因子,许多种类的癌基因表达以后,即阻断了肿瘤细胞的凋亡过程,使肿瘤细胞数目增加。较多资料表明在肿瘤发生中,Bcl-2、c-my和ras基因可协同转化并使细胞永生化。另外,本属程序性死亡的细胞如未按时凋亡,则这种“老化”细胞的染色体会不稳定,基因易突变,对致癌物的易感性升高,从而增加了恶变概率。抑癌基因p53的缺失使细胞凋亡大大减少,自发肿瘤发生率上升。因此,肿瘤不仅是细胞增殖和分化异常的疾病,也是细胞凋亡的疾病。细胞凋亡异常与肿瘤的发展、转移和预后等许多生物学行为密切相关。因此,通过细胞凋亡机制来设计对肿瘤的治疗方法就是重建肿瘤细胞的凋亡信号传递系统,即激活死亡基因的表达,抑制肿瘤细胞生存基因的表达。
(3)细胞凋亡与自身免疫病:自身免疫病包括一大类难治性的免疫紊乱而造成的疾病,自身反应性T细胞及产生抗体的B细胞是引起自身免疫病的主要免疫病理机制细胞。正常情况下,免疫细胞的活化是一个极为复杂的过程。在自身抗原的刺激作用下,识别自身抗原的免疫细胞被活化,从而通过细胞凋亡的机制得到清除。但如这一机制发生障碍,那么识别自身抗原的免疫活性细胞的清除就会产生障碍。系统性红斑狼疮(SLE)是一种常见的典型自身免疫性疾病,以自身抗体产生和免疫复合物形成特征,可引起多器官损害。近年来研究发现,SLE患者外周血淋巴细胞凋亡水平异常可引起机体内多种自身抗体产生,形成免疫复合物沉积,因此推断细胞凋亡可参与SLE的发病机制。在IPr或gld小鼠中,Fas和FasL分别发生了基因突变。这些小鼠由于细胞凋亡减少而导致淋巴细胞聚集,临床表现类似SLE。
(4)神经系统的退行性病变:神经退行性疾病是一类严重影响人类健康的常见病,有肌萎缩性侧索硬化症(amyotrophic lateralsclerosis,ALS)、阿尔茨海默病(Alzheimer disease,AD),帕金森病(Parkinson disease,PD),亨廷顿病(Hunt-ington disease,HD)等。AD是一种不可逆的退行性神经疾病,来自淀粉样前体蛋白(APP)的β淀粉样蛋白(amyloid proteinβ,Aβ)、早老蛋白-1(PS1)、早老蛋白-2(PS2)的突变导致家族性阿尔茨海默病(FAD)。Aβ毒性作用的基本特征是神经元凋亡。研究结果表明,Aβ是各种原因诱发AD的共同通路,是AD形成和发展的关键因素。早老蛋白也参与了神经细胞凋亡的调控,PS1、PS2的过表达能增强细胞对凋亡信号的敏感性。Bcl-2基因家族两个成员Bcl-xl和Bcl-2参与了对神经细胞凋亡的调节。
(5)细胞凋亡与动脉粥样硬化(AS):近年研究认为,细胞凋亡在AS的发病中可能起着重要作用。通过凋亡检测方法——末端脱氧核苷酸转移酶介导的dUTP生物素断端标记(TUNEL)法检测人AS冠状动脉和颈动脉,结果发现病变内膜中TUNEL阳性细胞数明显高于无病变的内膜,AS斑块中可检出凋亡寡核苷酸片段,表明AS病变中有细胞凋亡发生。动物试验也证明AS斑块中有细胞凋亡发生。其中发生凋亡的细胞多数是平滑肌细胞和巨噬细胞。平滑肌细胞凋亡失调和凋亡小体清除不足可能是加剧AS发展的重要因素。
(潘銮凤)
参考文献
1.杨恬主编.细胞生物学.北京:人民卫生出版社,2005
2.杨抚华,胡以平主编.医学细胞生物学.第4版.北京:科学出版社,2002
3.王金发主编.细胞生物学.北京:科学出版社,2003
4.陈诗书,汤雪明主编.医学细胞与分子生物学.第2版.北京:科学出版社,2004
5.陈主初主编.病理生理学.北京:人民卫生出版社,2001
6.高燕等.细胞周期调控的研究进展.生命科学,2005,17(4):319~322
7.储琳等.细胞周期蛋白依赖性激酶活化激酶(CAK)的研究进展.生命科学,2006,18(2):127~132
8.沈林海等.SCF和APC/C的结构及功能.细胞生物学杂志,2007,29:487~492
9.覃吉超等.一种新的细胞周期分析方法.癌症,2001,20(2):206~210
10.高志清,海春旭.胸腺嘧啶核苷诱导肝癌HepG2细胞同步化.疾病控制杂志,2007,11(1):44~46
11.付晓兰,李雪峰.DNA甲基化与细胞分化.广西农业生物科学,2006,25卷增刊:135~139
12.杨秀娣,钱文斌.白血病干细胞研究的新进展.浙江医学,2007,29(8):893~897
13.王磊等.成体干细胞的研究现状与展望.中国畜牧兽医,2007,34(4):79~81
14.刘怡,王松灵.干细胞的研究进展.北京口腔医学,2006,14(4):289~293
15.刘英,瓦龙美.胚胎干细胞的研究进展.首都医科大学学报,2006,27(5):699~701
16.任莉萍,曹小汉.胚胎干细胞的研究进展及应用前景.阜阳师范学院学报(自然科学版),2006,23(1):51~54
17.赵明,任彩萍.胚胎干细胞诱导分化的研究结果.生命科学,2005,17(1):19~24
18.杨阿聪,金颖.人胚胎干细胞优化培养的进展.生命科学,2006,18(4):402~406
19.何明生,郭涛,肿瘤干细胞.中国组织工程研究与临床康复,2007,11(28):5618~5621
20.王晓,裴雪涛.造血干/祖细胞研究进展.生物学通报,2000,35(10):1~3
21.李斌,吴岩.造血干细胞研究进展.内蒙古医学院学报,2006,28(6):592~595
22.贺鹏程,张梅,王芳.早幼粒细胞白血病蛋白功能的研究进展.癌症,2003,1359~1362
23.冯茹.干细胞治疗的应用.中国临床康复,2006,10(5):133~135
24.樊伟,李尚为.胚胎干细胞定向分化的研究进展.生物医学工程学杂志,2004,21(6):1051~1054
25.潘耀谦,于艳,高丰.细胞凋亡的常用调控基因研究近况.动物医学进展,2002,22(3):1~4
26.刘伟,李庆军,卢绮萍.Caspase与细胞凋亡,新乡医学院学报,2005,22(1):67~70
27.李奎,刘英,康相涛.主要凋亡基因对细胞凋亡的调控.解剖科学进展.2007,13(1):62~65
28.付永锋,樊廷俊.Bcl-2家族蛋白与细胞凋亡.生物化学与生物物理学报,2002,34(4):389~394
29.刘景峰,王淑娟.现代医学衰老机理研究.辽宁中医学院学报,2002,4(2):106~107
30.郭强,刘娜,张倩.凋亡基因在恶性肿瘤中的研究进展.山西中医学院学报,2006,7(1):61~62
31.张敏燕,张正民,韩仲明.凋亡调控基因Bcl-2、Bax与肿瘤.国外医学·耳鼻咽喉科学分册,2004,28(1):40~43
32.李莉平等.HIV致病机制的研究进展.细胞与分子免疫学杂志,2007,23(9):886~888
33.钱淑凤,高桂生,郑翠玲.细胞凋亡与疾病.中国畜牧兽医,2007,34(9):88~91
34.张勤丽,牛侨.细胞凋亡机制概述.环境与职业医学,2007,24(1):102~107
35.刘振虹,任立群,胡亚涛.Caspase家族与细胞凋亡.承德医学院学报,2002,19(4):308~310
36.陈德华.系统性红斑狼疮细胞凋亡相关基因及细胞因子研究进展.医学文选,2006,25(3):525~527
37.郭磊,祝文娴,刘克洲.细胞凋亡在自身免疫发病机制中的作用.国外医学·免疫学分册,1999,22(1):17~21
38.周语平,杨志军,陈彻.细胞凋亡与肿瘤.甘肃中医学院学报,2003,20(4):48~51
39.王建枝,刘世杰.神经退行性疾病神经细胞死亡机制.国外医学·分子生物学分册,2003,25(1):41~44
40.Lodish,et al,Molecular Cell Biology.4th ed,New York:W H Freeman & Co.1999
41.Alberts,et al.Molecular Biology of the Cell,2nd ed.New York and London:Garland Publishing,Inc,1994
42.Lodish,et al.Moleculer Cell Biology.3th ed.New York and Oxford:Scientific American Books,Inc.,1995
43.Evans,et al.Cyclin:aprotein specified by maternal mRNA in sea urchin eggs that is destroyed at each cleavage division.Cell,1983,33(2):389~96
44.Waldren,et al.Analysis of interphase chromosome damage by means of premature chromosome condensation after X-and ultraviolet-irradiation.Proc Natl Acad Sci U S A,1974,71(4):1137~1141
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。

















