候选方法经过初步实验做出符合实验要求判断后,就需要对该方法进行系统评价。方法学评价是指通过一系列的评价实验,对各项试验得到的结果进行统计学分析和处理,得出该方法能够达到的精密度、准确度、线性范围,以及其他性能指标,作为该方法能否被接受的依据。实验方法评价的过程就是对实验误差的测定。
(一)实验误差
实验误差简称误差(error),是量值的给出值与其客观真值之差。给出值包括测量值、标称值等,具有广泛性。标本中待测物的真实浓度为真值,它是客观存在的,但在有限次的测定中,不可能求得真值。在实际工作中,采用严格的实验条件和最准确精密的方法,以多次重复测定所得测定值的平均值代表相对意义的真值,即约定真值。
1.实验误差的分类 按照来源性质不同,实验误差可分为系统误差和随机误差两大类。
(1)系统误差(systematic error,SE):在重复性条件下,对同一被测物质无限多次测量所得结果的平均值(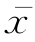 )与被测物质的真值(T)之差。具有单向性,没有随机性,常有一定的大小和方向(符号),或总是偏高,或总是偏低;一般由恒定的因素引起,增加测定次数也不能消除。找到引起误差的原因,采取一定措施即可纠正,消除系统误差能提高测定结果的准确度。系统误差相当于不准确度(inaccuracy)或偏倚(bias)。
)与被测物质的真值(T)之差。具有单向性,没有随机性,常有一定的大小和方向(符号),或总是偏高,或总是偏低;一般由恒定的因素引起,增加测定次数也不能消除。找到引起误差的原因,采取一定措施即可纠正,消除系统误差能提高测定结果的准确度。系统误差相当于不准确度(inaccuracy)或偏倚(bias)。
系统误差中常见的是恒定系统误差和比例系统误差。
恒定系统误差(constant error,CE)是指由干扰物引起使测定值与真值存在恒定大小的误差,该误差大小与被测物浓度无关,而与干扰物浓度相关,因此有正、负之分。
比例系统误差(proportional error,PE)又称线性系统误差,是指相对于被测物浓度的变化而呈比例变化的误差,误差的绝对量与被测物浓度成正比。
引起系统误差的主要原因有:①方法误差。这是生化检验中最严重而又最难避免的误差,主要由方法的分析性能存在固有的缺陷所致,如特异性不高、标本中有干扰物的存在等。可以通过方法的选择和评价,减小误差。②仪器和试剂误差。常见仪器波长未校准、量器不准、试剂质量差等原因。
(2)随机误差(random error,RE):又称偶然误差,是指在实际工作中,多次重复测定某一物质引起的误差。误差可正可负,没有一定的大小和方向,数据呈正态分布;具有不可预测性,不可避免,但可控制在一定范围内;分析步骤越多,造成这种误差的机会越多;随测定次数的增加,其算术均数就越接近于真值。人们只能将其控制在一定的范围内,但不能消除。随机误差常用精密度来表示。
随机误差相当于不精密度(imprecision)或绝对偏差(di),即某次测量值(x)与重复测量的均值(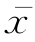 )之差。常用标准差(s)、变异系数(CV)表示随机误差。
)之差。常用标准差(s)、变异系数(CV)表示随机误差。
引起随机误差的主要原因有:①技术人员的操作不规范;②测定仪器、试剂、环境等实验条件的突然改变等。
引起随机误差和系统误差的原因是相对的,有时引起系统误差的因素可以引起随机误差,引起随机误差的因素也可引起系统误差,随机误差和系统误差在一定条件下能相互转化。
2.实验误差的表示方法 根据误差的性质不同,实验误差主要有以下几种表示方法。
(1)平均误差:一组测定值中,测定值与均值之差的平均值,即算术平均偏差,用dm表示。
![]()
(2)标准差:即标准偏差(standard deviation,s)是表示一组正态分布资料的离散程度,是方差(s 2)的平方根值,用s表示,是表示精密度较好的指标。标准差的单位和原始数据相同,测定次数一般要求20次(n=20)以上。
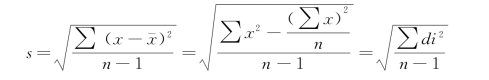
式中:s表示标准差;X表示变量值;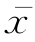 表示变量值均数;n表示变量值个数(样本数);n-1为自由度。
表示变量值均数;n表示变量值个数(样本数);n-1为自由度。
标准差是一个统计量,度量各个数值(如质控数据)相互间一致性的关系。不精密度,常用于表示各个数量值互相离散的程度。使用与计算均值相同的控制品数据计算标准差,可为实验室提供特定浓度下检测一致性的估计。某检测的重复性可以一致(低标准差、低不精密度),或不一致(高标准差、高不精密度)。不一致的重复性可能涉及分析物或检测中的有关问题。若有故障,实验室必须纠正。
(3)绝对误差和绝对偏差:绝对误差指测定值与真值间的差值,绝对误差有正值和负值;而绝对偏差是指测定值与测定均值间的差异。
绝对误差=测定值(x)-真值(T)。
绝对偏差=测定值(x)-测定均值(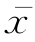 )。
)。
绝对误差、绝对偏差表示误差绝对值的大小,无法比较测定误差之间的大小。
(4)相对误差和相对偏差:相对误差为绝对误差与真值的百分比值,相对偏差为绝对偏差与测定均值的百分比值。

(5)变异系数(coefficient of variation,CV):是样本标准差与样本均数的百分比值,主要用于比较各组数据间的变异情况,没有单位。变异系数值越大,表明测定值离散度越大,精密度越差。
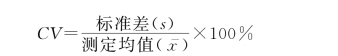
式中:CV表示变异系数,s为样本标准差,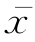 为样本均数。
为样本均数。
CV是一个相对量,没有单位,主要用于均数相差悬殊或单位不同几组资料的比较。
某检测系统不同的均值,具有不同的标准差。因此,在估计随机误差时,应该表示在什么分析物均值下的标准差。如果在检测系统的很大范围内,标准差和均值的比值较恒定,或者临床认为只要误差控制在一定百分数内可接受,直接使用CV更方便。在美国的CLIA’88法则中,室间质量评价的允许范围多用百分数表示,由此推算CV确定随机误差很容易。
(二)方法评价的内容和步骤
1.方法评价的内容 通过实验测定并评价试验方法的精密度和准确度。在实际测量中常以不精密度和不准确度表示,强调的都是误差,评价实验过程就是对误差的测定。
方法学评价的实验是为检测各类型的实验误差而设计。它们间的相互关系见表2-2。
2.方法评价步骤 根据方法选择的要求确定某候选方法,在使用前最好经本实验室进行评价,方法评价的具体步骤如下。
表2-2 方法评价实验与实验误差类型的关系

(1)评价前试验:重点研究候选方法的最适条件。最适条件包括试剂浓度、缓冲体系的种类、离子强度和p H、反应温度和时间、标本与试剂的体积比、检测波长、方法线性范围等。对文献报道的条件做必要的验证。
(2)初步评价试验:也称预试验,该阶段可在较短时间内完成,包括批内和日内重复性试验、回收试验、干扰试验。
(3)最后评价试验:在初步评价试验合格以后进行,评价依顺序作日间重复性试验,方法比较试验和总体判断方法是否可接受。
(4)评价后试验:在方法性能可接受后,进行临床相关研究,包括参考区间确定和特殊标本的测定等。
(5)方法应用:候选方法确认后,引入常规工作,建立质控系统,培训操作人员等。
方法评价是一项科学性强、方法严谨、费时耗力的工作,应将实验方法和结果进行科学的整理和总结。
(三)方法评价指标
实验方法评价指标包括精密度、准确度、检测能力等。
1.精密度(precision) 表示同一标本在一定条件下多次重复测定所得到的一系列单次测定值的符合程度。是表示测定结果随机误差大小的指标。
精密度自身无量度指标,常用标准差(s)或变异系数(CV)表示不精密度。标准差或变异系数愈大,说明检测结果之间的离散程度愈大,重复性愈差;标准差或变异系数愈小,说明重复性愈好。
(1)连续测定的精密度:在相同条件下,对同一标本连续进行n次重复测定结果的符合程度。在有限次测定情况下,一般用σ(总体标准差)的估计值s(样本标准差)来表达这种精密度。
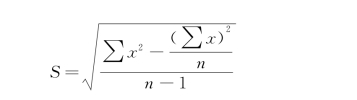
(2)重复性精密度(repeatability precision):又称室(批)内精密度,指在相同条件下(同样方法、同一种试剂和标准品、同样仪器、在同一实验室,由同一人操作并要保持实验期间准确性不变)对同一标本在尽可能短的时间内进行m轮n次重复测定,结果之间相互接近的程度。重复性(批内)精密度(S w)的计算公式为

式中:Si2为m轮(批)各次测定值的方差。先计算出m个平均值x-1,x-2,x-3…x-m及标准差和方差S 12,S 22,S 32…S m2,再将有关数据带入公式,即求出Sw。用变异系数表示批内精密度的计算公式为
![]()
(3)再现性精密度(reproductivity precision):又称室(批)间精密度,指在不同条件下(不同操作者,不同仪器,在不同实验室和不同时间)采用同一方法对同一标本所获得的单次测定结果之间相符合的程度。再现性精密度既包括了不同操作者的误差,也包括了不同条件下的仪器误差,因此,对检验方法的再现性估计,所采用的方法比估计重复性更为复杂。
再现性精密度多用于实验室间的质量评价,其标准差称为室间标准差。室(批)间标准差,是对室(批)间重复性试验结果进行单因素完全随机设计方差分析后进行的计算。
2.准确度(accuracy) 测定值与真值之间的符合程度,常用不确定度的偏差和偏差系数表示。偏差为重复测定均值(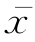 )与真值之差。
)与真值之差。
![]()
要获得准确度首先要知道真值,但真值通常难以得到。在实际工作中,通常用已知含量的标准品来检查分析方法的系统误差,确定分析方法的准确度。在无标准品时,常用已确认标准方法的测定结果作为标准值,判断被检查方法是否存在系统误差,以确定准确度。
准确度主要受系统误差支配(系统误差愈小,准确度越高),也受随机误差的影响,所以准确度是表示测定结果中系统误差和随机误差的综合。公式表示为:A=∑+△a。式中A表示准确度,∑表示已定系统误差的综合,△a表示在显著性水平为a时,未定系统误差和随机误差合并后的不确定度。
近年来ISO对准确度重新定义,并提出了“正确度(trueness)”。而正确度(也译作真度)是大量测定的均值与真值的接近程度。可见,准确度涵盖了正确度和精密度,既正又精密的结果才是准确的,而过去则用准确度表示现在的正确度概念。知识拓展正确度、准确度
评价准确度的方法有:回收试验、干扰实验、方法比较试验和线性范围试验。
不确定度(uncertainty)是表达测定结果的一个组成部分,表明被测标本中真值存在的范围,通常所说的误差是指测定结果与真值偏离的程度;准确度是指测定结果与真值接近的程度。可见误差和准确度从相反角度表达了同一事物。
3.互通性、特异性和干扰 互通性(commutability)又称互换性、替换性,是参考物质的重要属性,指用不同测量程序测定参考物时测定结果之间的数字关系,与测定结果数字关系的一致程度。因此,互通性是指参考物质的理化性质与实际标本的接近程度。造成互通性问题的原因是:制备参考物质时,出于调整浓度,便于贮存和运输等目的,对原料所进行的成分调整和加工,如添加外源性的替代被测物或将原料进行冻干等。
过去常用“基质效应”来描述参考物质与新鲜标本的性质差异,但近年来ISO标准中用互通性表示参考物质与临床标本性质的接近程度。对基质效应(matrix effect)的定义为:被测物以外的某标本特性对被测物数值的影响。如用火焰发射分光光度法测定血清钙时,标本中的磷酸盐浓度和标本黏度可能会影响测定结果。造成基质效应的明确原因是影响量,即被测物以外的影响测定的量,影响量的作用有干扰和非特异性两种。因此基质效应主要是非特异性和干扰易感性问题,是参考物质缺乏互通性的原因之一,另一个主要原因是参考物质中的分析物与实际标本中的分析物性质不同。
特异性(specificity)即专一性,是指在特定实验条件下,分析试剂只对待测物质起反应,而不与其他结构相似的非被测物质发生反应。分析方法特异性越高,测定结果越准确。干扰(interference)是指标本中某些非被测物质本身不与分析试剂反应,但以其他形式使被测物测定值偏高或偏低,这些非被测物质称为干扰物。如果分析试剂与标本中被测物质以外的成分反应,则属特异性差;如果加入的物质影响了被测物质与试剂间的反应,则是被干扰。
例如:用邻甲苯胺试剂测定血糖,除葡萄糖外,半乳糖、甘露糖等也能与试剂反应,产生与葡萄糖相似的吸收光谱,引起正误差,这是特异性不足所致。GOD-POD法测定血糖时,尿酸可与由葡萄糖氧化酶作用产生的H 2 O 2反应,使部分H 2 O2不能参与过氧化物酶的第二步反应,造成显色程度下降。尿酸本身未与试剂直接反应,但对该方法有干扰。
评价特异性与干扰的常用方法为干扰试验。
4.灵敏度、检测限 灵敏度(sensitivity,S)又称敏感度,是指检测信号变化量(Δy)与被测物变化量(Δx)的比值,S=Δy/Δx。灵敏度可反映仪器、试剂对标本浓度变化的反应能力,如在吸收光谱分析中,反应吸光度(A)与标本浓度(C)的关系为一条曲线(A-C曲线),A-C曲线呈线性时的斜率(ΔA/ΔC)即为反应的灵敏度。显色反应的颜色越深,则灵敏度越高。根据朗伯-比尔定律,ΔA/ΔC=吸光系数×比色皿光径=灵敏度,可见,吸光系数与灵敏度成正比。
灵敏度的高低应按照标本的医学决定水平来选择合适的化学反应,并不是灵敏度越高越好。如双缩脲法测定血清总蛋白(g/L)合适,而测定脑脊液和尿蛋白定量(mg/L)因反应的灵敏度较低而不合适;相反,适合微量蛋白测定的高灵敏度方法,如考马斯亮蓝、丽春红等染料反应却不适合血清总蛋白的测定。
检测限(detection limit),即检出限或检测能力,是指在给定的置信水平上能够检出的待测物的最小浓度或最小质量。以浓度表示的称为相对检测限,以质量表示的称为绝对检测限,在生化检验中应用最多的是相对检出限,简称检测限。对于某一分析方法,应确定检出限,便于与其他方法的检测能力比较,避免标本中待测物含量接近或低于检出限。
确定检出限首先要选择合适的空白标本,多次测定(一般20次)其吸光度,求平均吸光度和标准差;再重复测定接近空白的标本,计算标准差;最后选定一合适的单值统计试验及可接受的概率作为有意义的水平。为简便计算,可用“空白读数+3s”代表检出限。
检测限与灵敏度的关系:方法的灵敏度越高,检测限就越低,检测能力就越强。另外,检测限与测定噪声(在没有被测物质时所产生响应信号的波动或变化值)密切相关。为此推荐采用检测限,而不是用灵敏度来衡量分析方法的检测能力。
5.线性范围与测量范围 线性范围(linear range)指检测信号与被测物浓度呈线性时被测物的浓度范围。测量范围(measuring range)即分析范围,指在允许误差极限内能检测的被测物浓度范围。除浊度法外,生物化学检验项目校准曲线(或称剂量反应曲线)都是直线,因此可以检测校准曲线的线性区间,用线性范围代替测量范围,线性范围应足够宽,至少应包含95%的临床标本,线性范围太窄容易导致系统误差。
评价线性范围的常用方法为线性范围试验。
(四)评价实验
评价实验包括精密度测定、回收试验、干扰试验、方法比较试验等。
1.精密度评价 目的是检测候选方法的随机误差,考察其精密度。将同一材料(标准液、质控液、标本等)分成数份标本,对其进行反复多次分析测定,并计算其均数(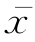 )、标准差(s)和变异系数(CV)。
)、标准差(s)和变异系数(CV)。
(1)试验形式与方法:①批内精密度测定。用同一份标本,在短时间内用候选方法做多次(一般20次)重复测定。②日间精密度测定。将同一标本分成数份,按方法每天测1次,连续测定20d观察结果变异。
结果判断。①推荐标准:允许误差(E A)采用美国临床实验室法案修正案(Clinical Laboratory Improvement Amendment of 1988,CLIA’88)的标准,判断室间质量评价指标的可接受范围(表2-3)。可用批内不精密度小于CLIA’88可接受范围的1/4,日间不精密度小于CLIA’88可接受范围的1/3作为评价标准。②较低标准:见本节“方法性能判断”。
表2-3 临床化学室间质量评价指标可接受范围

T为靶值;T±20%=靶值±(靶值×20%);E A=靶值×20%
(2)质量保证:①分析标本的选择。做精密度评价试验采用标准液、控制物、病人标本均可,视用途而定。使用标准液、控制物,必须要与血清同基质。使用病人标本应注意详细记录标本的特性,如浑浊、溶血、黄疸等。②被测物浓度。宜选择在医学上有决定性意义的浓度(医学决定水平)进行重复性试验,如血糖的医学决定水平分别为2.48mmol/L、6.6mmol/L、10.0mmol/L、16.5mmol/L。③重复测定顺序。不能单独将重复标本设为一组测定20次,而应该与临床血清标本随机排序后穿插测定。
20世纪八九十年代NCCLS(现更名为CLSI)制定了一套关于线性、准确度(方法对比试验)、精密度等的评价方案(EP)。评价方法线性的是EP6-A文件,评价准确度的是EP9-A2文件,评价分析干扰性能的是EP7-A文件,评价精密度的是EP5-A文件。按EP5-A的公式计算批内、批间、日间、总标准差及相应的变异系数判定标准:批内CV< 1/4E、批间CV<1/3E、总CV<E(E来自CLIA’88)。知识拓展美国NCCLS/CLSI的方法评价方案
2.回收试验 回收是用指候选方法准确测定加入常规分析标本的纯分析物的能力,用回收率表示。目的是检测候选方法的比例系统误差(PE),以衡量该方法的准确度。回收试验所得到的PE随被测物浓度的增加而增加。
(1)原理:将已知浓度的含被测物的各标准液加入患者标本(原标本)中成为一系列分析标本(回收标本),在原标本中加入相同体积的无被测物的溶剂作为基础标本,用候选方法对这些标本同步测定,计算回收率和平均回收率,评价候选方法的比例系统误差。
(2)器材与试剂
①器材:加样器、比色计等。
②标本:收集无肝炎病毒污染、无溶血、无黄疸、无脂血的正常人新鲜混合血清一份,将其一分为三,每份2ml,分别用于制备基础标本和分析标本。
③试剂。
a.血清钙测定试剂盒。
b.钙标准液:浓度分别为4.0mmol/L和25.0mmol/L。
(3)操作。
①标本制备。原标本:混合血清
基础标本:混合血清2ml+蒸馏水0.1ml
回收标本1:混合血清2ml+4.0mmol/L钙标准液0.1ml
回收标本2:混合血清2ml+25.0mmol/L钙标准液0.1ml
②血清钙测定:按试剂盒说明对以上各标本进行双份检测,取平均吸光度和平均浓度。(4)计算
①计算公式。


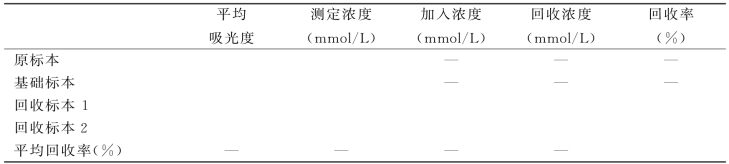
②结果处理:将所有计算结果填入表2-4中。
表2-4 回收实验检测结果
(5)质量保证
①标本类型:基础标本指混合血清中加入不含被测物的溶剂(常为蒸馏水),其总体积与回收标本管的总体积一致,因此,计算回收浓度时可以直接相减。回收标本指混合血清中加入被测物的标准液,其标准液的浓度可根据需要配成数种。
②所加标准液的基质:应尽量与标本的基质相同,使它们的反应性质一致,以免产生的基质效应影响回收率。
③加入标准液的体积:在总体积中所占比例要小,一般不超过标本体积的10%,否则稀释过大,会造成误差的改变或消失。
④准确加量:加入浓度准确地说是加入后浓度,其计算是根据理论上加入的标准液和混合血清的体积计算的,吸量不准则影响计算。
⑤加入标准液的浓度:a.加入被测物的标准液浓度最好使标本中被测物的浓度达到医学决定水平(Xc),即回收试验应在Xc上进行;b.加入标准液后,被测物总浓度必须在测定方法的线性范围内。
⑥重复测定次数:回收试验一般须作高、中、低不同浓度标准液的回收,最后计算平均回收率。分析标本重复测定的次数依加入浓度的高低和方法本身的随机误差而异。基础标本和加入浓度较低时,回收标本一般可增加重复次数。
⑦比较方法的配套测定:如果同时用比较方法测定回收率,既可以估计候选方法回收试验结果的可靠性,又可以评价操作误差。
⑧设置原标本的作用:a.考查标本中被测物的浓度是否达到Xc;b.考查稀释过程的准确性;c.计算该方法对标本所测得的准确值。
(6)应用评价
评价标准:一般的实验方法要求回收率在95%~105%。理想的回收率为100%。理论值与实测值之差为比例系统误差的估量值,比例系统误差=100%-平均回收率,理想的比例系统误差为0。
如果某回收率为96%,原标本的测定值为2.5mmol/L,则其比例系统误差为4%,比例系统误差值为4%×2.5mmol/L=0.1mmol/L,用该方法测得的准确值应为(2.5/96%)mmol/L =2.6mmol/L。
3.干扰试验 干扰试验用来检测候选方法的恒定系统误差。临床生化检验绝大部分反应以血清为介质,在测定某分析物的浓度或活性时,除参与反应的物质外,还有许多复杂成分通过直接参与反应、抑制反应或激动反应等方式对反应过程形成干扰,从而使检测结果出现偏差。干扰物浓度不同,误差大小也不同。
(1)方法:基本与回收试验一样,但在检测标本中加入疑有干扰或非特异性反应的物质。将可能引起干扰的物质配成一系列浓度的溶液,加入标本中成为若干个干扰标本;原病人标本加入相同量无干扰物质的溶剂作为基础标本;然后用候选方法对此两种标本同时测定,各干扰标本与基础标本结果之差即表示一定浓度下该干扰物质产生的误差,即干扰值。
干扰值=干扰标本测定值-基础标本测定值
(2)举例:尿酸对GOD-POD法测定血糖的干扰。
标本制备:制备正常人新鲜混合血清1份,以制备基础标本和干扰标本。
基础标本:混合血清0.9ml+0.1ml蒸馏水
干扰标本1:混合血清0.9ml+4.5mmol/L尿酸0.1ml
干扰标本2:混合血清0.9ml+9.0mmol/L尿酸0.1ml
尿酸标本:蒸馏水0.9ml+9.0mmol/L尿酸0.1ml
血糖测定:用GOD-POD法对上述标本进行双份测定并计算,检测结果见表2-5。
表2-5 干扰实验检测结果


表明正常血清尿酸0.45mmol/L,使血糖测定结果约减少0.32mmol/L。
(3)质量保证
①干扰物质:根据方法的化学反应原理找出可能的干扰物,一般应考虑的主要因素包括黄疸、溶血、脂血、防腐剂、抗凝剂和药物等,设置干扰标本对于黄疸可采用加入胆红素标准液,溶血可采用机械溶血制备溶血标本,脂血采用高脂标本做萃取前后对比。
②干扰物浓度:加入可疑的干扰物浓度应明显高于通常所见浓度的上限,应尽可能达到病理标本的最高浓度,即必须达到有价值的范围,如尿酸升高的变化范围为0.42~0.9mmol/L。在确证有影响后应测定在什么浓度产生的误差无临床意义,即确定使分析结果影响临床应用价值的最低可疑物浓度值。
(4)消除干扰的常用方法
①设立标本和试剂空白试验:标本空白(标本+空白试剂)用来校正标本中被测物以外的其他物质的影响,试剂空白(蒸馏水+试剂)校正标本读数中试剂部分的影响。
②采用各种物理、化学方法分离除去干扰物,如做无蛋白滤液以排除蛋白质的干扰,用脂溶剂抽提萃取除去脂类的干扰,用维生素C氧化酶消除维生素C的干扰,用胆红素氧化酶或亚铁氰化钾消除胆红素的干扰等。
③双波长或多波长检测排除干扰。
④误差较大又无法消除,需对现方法进行改进或更换方法。
评价标准:若干扰值即偏差≤允许误差(E A)的临界值,则干扰物引起的偏差可初步接受,进一步判断见本节的“方法性能判断”。
4.方法比较试验(对比试验) 比较试验用于检测候选方法的系统分析误差。对所得数据进行分析,可提供系统误差的性质[恒定或(和)比例误差]。
(1)方法:对一组病人的标本用候选方法和比较方法同时测定,观察两者之间的差异。这是考验候选方法是否可采用的重要措施。
(2)比较方法的选择:在进行临床化学常规方法的评价时,最好选择参考方法(或公认方法)作为比较方法,在解释结果时,可把方法间的误差归于候选方法。若采用已知偏差法,则部分误差来自比较方法(与已知偏差一致的那部分误差),剩余的误差则属于候选方法。采用未知偏差法,分析误差可能来源于两者之一或两者都有,难以分析。必须认真选择。
(3)结果的图示:以比较方法的测定值为横坐标(x轴),候选方法的测定值为纵坐标(y轴)绘制散点图,可提供初步印象,便于及时发现问题。如果所有测定值的对应点在坐标图中大约呈45°的直线分布,提示两法有较好的相关性。对于有溶血、脂血和黄疸的标本,应在散点图中做出相应的标记,如标以H、L、I等。
(4)统计学处理:方法比较试验所得的结果是配对资料,可进行配对资料的统计学处理,包括配对t检验、相关分析和回归分析等。
①配对t检验:用于比较两法间的系统误差。
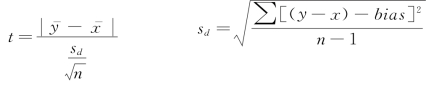
据ν=n-1查双侧t 0.05值,若t>t 0.05,则按α=0.05的水平拒绝H 0(两变量无差别),接受H 1(两变量有差别);否则,结果相反。
②F检验:用于比较方法间的随机误差或精密度。F=s12/s 22,s1、s2分别是两种方法的标准差,且s1>s 2。如果F值>F临界值,则统计学上认为两种方法的精密度存在差别;如F值< F临界值,则表示两种方法的精密度无明显差别。
③相关系数(r):在方法比较时不常用。相关系数对随机误差敏感,其数值与所测定的浓度范围有关,如分析范围广,则r接近1.000。
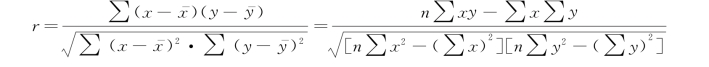
式中:∑(x-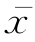 )2为x的离均差平方和,∑(y-y -)2为y的离均差平方和,∑(x
)2为x的离均差平方和,∑(y-y -)2为y的离均差平方和,∑(x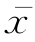 )(y-y -)为x、y的离均差积之和。
)(y-y -)为x、y的离均差积之和。
如果r≥0.975或r 2≥0.950,提示两种方法的结果有相关性。
(5)质量保证
①试验标本数和分析物浓度:要求选择的血液标本至少40例,最好包括临床常见的各种疾病的标本,所得分析物浓度应包括在常规工作中可能遇到的整个分析范围,其中1/2的浓度在生物参考区间以外。选择合适的标本比增加试验标本数目更为重要。
②重复分析:每天测8个标本,连续测定5d,每个标本每天测2次,按照正反各一次的排列顺序检测。编号时不同浓度的标本尽可能随机排列,每份标本应在2h内测完。
③用两种方法测定时,每次测定均应有质量控制,并保证质控品测定值在控。
④对结果有矛盾的标本,取原样重新测定。进行双份测定时,候选方法的第一次结果与比较方法的第一次结果作散点图;第二次结果也如此。
⑤误差大小的评价标准:理想的恒定系统误差a=0、比例系统误差b=1,此时回归曲线通过零点且呈45°分布。但实际上x与y都存在随机误差,a与b只是估计值,都会有波动。将恒定系统误差a、比例系统误差b与允许分析误差(E A)进行比较,若小于E A则候选方法的系统误差可以初步接受,进一步判断见方法性能判断。
(五)方法性能判断
判断候选方法能否被接受,必须将评价实验所得误差与某一确定的允许误差进行比较才能作出结论。不少学者进行了大量的研究,并运用统计方法制定出方法学性能标准(performance standards,PS)。
1.方法性能标准
(1)允许分析误差(allowable analytical error):用E A表示,被规定为95%标本的允许误差限度,或95%的病人标本其误差应小于这个限度。
(2)医学决定水平(medical decision level):用X C表示,是对临床病人的诊疗具有医学判断作用的临界分析物浓度(见本章第二节)。
E A和X C值由临床医师和实验室人员共同研究确定,两者组成了某方法的性能标准,每一医学决定水平都应规定相应的允许误差,即一定X C值下的E A值。现多采用美国(CLIA’88)临床化学室间质量评价指标的可接受范围作为E A值(表2-3)。
2.方法性能判定指标 将评价试验得到的各种误差值与确定的允许误差值E A进行比较,各项指标都小于E A,表示该方法可以接受;任何一项指标大于E A,则表示不能接受。目前,有两套性能判断指标,一套为单值判断指标,判定误差值可否被接受,较简便,可用于初步估量;另一套为可信区间判断指标,判定误差范围是否被接受,较复杂,对方法性能提供更客观的评价,起最后判断作用。
(1)单值判断指标(single-value criteria):利用公式计算(表2-6),初步判断方法能否被接受。
表2-6 单值判断指标

(2)可信区间判断指标:每种测定结果的可靠性随测定次数的增加而增加,不可能对同一标本进行大量的测定。为估量分析误差的不确定性,即在一定标本数下,以最小的代价取得误差测定的最大可能性,对每一误差可计算其可信区间,用可信上限(upper confidence limit)和可信下限(lower confidence limit)代替对单值的估量。EU为误差的可信上限,E L为误差的可信下限。多采用95%可信上限和95%可信下限计算各实验误差。EU将是误差单侧的95%上限,用于判断候选方法的可接受性。可信区间判断指标的计算公式见表2-7。
①若EU<E A,则方法误差大于允许误差的机会只有5%或更少,以95%的可能性接受候选方法。E L为误差另一单侧的95%下限,用于排除某一方法。
②如果E L>E A,则方法误差小于E A的机会只有5%或更少,以95%的可能性拒绝候选方法。候选方法必须改进,以减少误差,否则将被拒绝使用。
③若EU>E A且E L<E A,说明此时仅有的数据不足以作出任何有关可接受或可拒绝的结论,还需继续实验,收集更多的数据,才能对分析误差作出较完整的估量。
表2-7 可信区间判断指标

*特例:当R-U>100>R-L,PEL=0
**特例:当t·sd/ n>|偏差|,CEL=0
n>|偏差|,CEL=0
***特例:当(a+b X C+W)>X C>(a+b X C-W),SEL=0
****特例:当SEL=0,TEL=REL
由表2-7可看出,每种类型的误差分别用两个判断指标,即判断可接受性(EU<E A)和判断拒绝(E L>E A)。对于RE、PE和CE的判断指标仅用误差估量的上限和下限,而在SE、TE的判断指标引入“W”,即回归线可信区间的宽度(与给定的X C相对应的Y C值范围),对某一给定的X C,则Y C=a+b X C,Y C的上下可信限由方程(a+b X C)±W计算得出。W计算公式如下

W的大小取决于选择的百分区间,即和选择的t值有关(这里选双侧t 0.10)。中括号内的公式表明,在n很大、X C=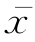 时,W很小。若X C无论在哪一方向逐渐偏离
时,W很小。若X C无论在哪一方向逐渐偏离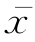 ,则X C-
,则X C-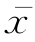 之差增大,W也增大(图2-3)。Y CU和Y CL分别为Y C的上下可信限,即Y CU=Yc+W, Y CL=Yc-W。
之差增大,W也增大(图2-3)。Y CU和Y CL分别为Y C的上下可信限,即Y CU=Yc+W, Y CL=Yc-W。
W也和回归线标准差s Y/X成正比,sY/X直接反映方法对比数据的不确定性。
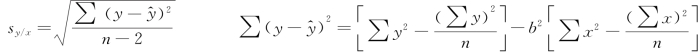
sy/x值愈小,说明实测散点向回归线密集分布,回归效果好。y-y^为实验方法与回归方程计算所得结果之差。
3.评价实验书面报告 评价实验完成后,必须写出书面报告,内容包括方法原理、试剂配制、所用器材、操作步骤等。着重写出候选方法的各性能指标,特别重视实验数据的科学性和客观性。如候选方法可接受,进一步进行评价后实验,进入方法应用阶段。

图2-3 回归线的可信区间和数据的不确定性
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。
















