单元二 免疫细胞检测
临床上免疫细胞的检测主要包括淋巴细胞表面标志和功能的检测以及吞噬细胞的功能检测。
一、淋巴细胞表面标志的检测
不同的淋巴细胞群及亚群表达不同的表面标志,甚至同一淋巴细胞在其发育的不同阶段也可表达不同的表面标志,因此检测淋巴细胞表面标志不但可作为淋巴细胞群及亚群的分类依据,还可反映淋巴细胞的功能状态。CD抗原是主要检测的表面标志,常用的检测技术有以下几种。
(一)抗体致敏细胞花环法
将针对某种CD抗原的单克隆抗体吸附在红细胞上,加入待检的细胞悬液,单克隆抗体与相应的CD抗原结合使红细胞与阳性受检细胞结合而形成玫瑰花样的花环,计数花环形成细胞并计算其在淋巴细胞中的比率。通过本法可测定外周血中T细胞、B细胞的数目。
本法简单易操作,无需重要设备,是较经典的检测方法,但影响因素多,结果的稳定性较差。
(二)免疫荧光法
用荧光素标记CD单克隆抗体,在荧光显微镜下观察,显现荧光的细胞即为阳性细胞,计算阳性细胞占总计数细胞的百分率。该方法对设备要求高,试剂较贵。
(三)免疫细胞化学法
该法是以酶标记抗体,采用细胞酶免疫组化技术完成。在光学显微镜下观察,着色细胞即为阳性细胞,计算阳性细胞占总计数细胞的百分率。本法简单易行,一般实验室均可进行。
(四)流式细胞术
流式细胞术是目前免疫细胞表面标志检测的主要技术,其结果准确、客观,重复性好。
二、淋巴细胞的功能检测
淋巴细胞功能检测可分为体内实验和体外实验。体内实验主要是进行迟发型超敏反应,其实验结果可以间接反映T细胞对抗原的应答反应能力;体外实验是临床上主要进行的实验,包括淋巴细胞对抗原或丝裂原刺激后的活化反应、增殖反应、细胞毒性以及淋巴细胞分泌产物的测定。
(一)T细胞功能检测
1.T细胞增殖试验
在体外T细胞受丝裂原或抗原刺激后,其代谢和形态发生一系列变化,主要表现为胞内蛋白质和核酸合成增加,细胞体积变大、胞质增多、核仁明显、染色质疏松等,这一系列增殖反应使细胞转化为淋巴母细胞(彩图21)。因此,淋巴细胞增殖试验又称淋巴母细胞转化试验。
体外引起T细胞增殖反应的刺激物主要有植物血凝素(PHA)、刀豆蛋白A(ConA)等丝裂原以及破伤风类毒素、纯化蛋白衍生物(PPD)和白色念珠菌等抗原性刺激物。通常应用最多的刺激物是PHA。
检测T细胞增殖反应的方法主要有形态学检查法、3H-TdR掺入法和MTT比色法三种。
(1)形态学检查法:将分离的单个核细胞与适量的PHA混合,置37℃、5%CO2培养箱培养72h,取培养细胞作涂片染色镜检。根据细胞的大小、核与胞质的比例、胞质的染色性以及有无核仁等特征(表10-1),分别计数淋巴母细胞、过渡型母细胞和未转化的淋巴细胞,前两者为转化细胞。每份标本计数200个细胞,按公式计算转化率。转化率在一定程度上可反映细胞免疫功能,正常人的T细胞转化率为60%~80%,小于50%可视为降低。
![]()
形态学检查法简便易行,便于基层实验室推广采用。但依靠肉眼观察形态变化,使结果判断受主观因素影响较大,重复性和可靠性较差。
表10-1 未转化淋巴细胞和转化淋巴细胞的形态特征

(2)3H-TdR掺入法:T细胞在特异性抗原或丝裂原刺激下增殖、转化为淋巴母细胞过程中,胞内DNA的合成增加,且细胞转化程度与DNA的合成成正相关。此时若在细胞培养液中加入3H标记的胸腺嘧啶苷(thymidine,TdR),TdR被发生增殖转化的细胞摄取、掺入新合成的DNA中。TdR掺入的多少可以反映淋巴细胞增殖程度。
技术要点是将单个核细胞悬液加入含培养液的试管中,然后分试验管和对照管进行对比。在试验管中加适量PHA,置5%CO2培养箱37℃培养72h。每管加适量3H-TdR,继续培养4h后,将细胞收集在玻璃纤维膜上,洗涤,用液体闪烁器测量淋巴细胞内放射性核素量,记录每分钟脉冲数(cpm),按公式计算刺激指数(stimulating index,SI)。刺激指数表示淋巴细胞的转化能力。
![]()
3H-TdR掺入法敏感性高,客观性强,重复性好。但对设备有一定要求,有发生放射性核素污染的可能性。
(3)MTT比色法:发生增殖的淋巴细胞能摄取可溶性黄色染料即溴化二甲噻唑二苯四唑(dimethylthiazol diphenyltrazolium bromide,MTT),在细胞内MTT被线粒体脱氢酶还原为不溶性的蓝色甲颗粒。其形成量与细胞增殖的程度成正比。将细胞裂解并用有机溶剂(如盐酸异丙醇或二甲亚砜等)溶解甲后,在酶联仪570nm波长测吸光度(A)值可反映细胞增殖程度。
操作要点是将制备的单个核细胞悬液按一定比例稀释后加入培养板中,设试验孔和对照孔。试验孔中加适量PHA,对照孔加溶解PHA的溶剂,置5%CO2培养箱37℃培养68 h。各孔加适量MTT,继续培养4h,再加入盐酸异丙醇或二甲亚砜,使甲溶解。在酶联仪570nm波长读A值,计算刺激指数判定细胞增殖结果。一般SI≥2时具有意义。
![]()
MTT比色法的敏感性不及3H-TdR掺入法,但操作简单,无放射性污染。
2.T细胞介导的细胞毒试验
淋巴细胞介导的细胞毒性是细胞毒性T细胞(CTL)的特性。CTL经抗原刺激后,可特异性杀伤具有相应抗原的靶细胞,表现出对靶细胞的破坏和溶解作用。一般采用51Cr释放法检测CTL的细胞毒作用。试验原则是用放射性核素51Cr标记靶细胞,若受检CTL能杀伤靶细胞,则51Cr从靶细胞内释放入培养液中,用γ计数仪测定培养上清液中的51Cr量,按公式计算51Cr特异性释放率即可判断CTL的溶细胞活性。
![]()
检测CTL的细胞毒性是评价机体细胞免疫功能的一种常见指标,特别是检测肿瘤患者CTL杀伤肿瘤细胞的能力,常作为临床判断预后和观察疗效的指标之一。
3.体内试验
体内试验主要有特异性抗原皮肤试验和PHA皮肤试验。由于特异性抗原皮肤试验(如结核菌素试验)的试验结果受测试者对所试抗原过去的致敏情况影响,若机体从未被该抗原致敏,则不会出现阳性反应,所以阴性者也不一定就表明细胞免疫功能低下。目前临床上常用PHA皮肤试验检测机体的细胞免疫水平。
在体内PHA可非特异性刺激T细胞活化为母细胞,呈现以单个核细胞浸润为主的炎性反应。将定量PHA注射到受试者前臂皮内,6~12h局部出现红斑和硬结,24~48h达高峰,以硬结直径大于15mm者为阳性反应,反之则为阴性反应。阴性结果表明机体的细胞免疫功能低下。
体内实验不仅可以检测受试者是否对某种抗原具有特异性细胞免疫应答能力,还可以检查受试者总体细胞免疫状态,因此可用于临床诊断某些微生物感染(如结核)和细胞免疫缺陷等疾病,也可用于观察在治疗过程中细胞免疫功能的变化和判断预后。
(二)B细胞功能检测
1.B细胞增殖试验
原理和方法与T细胞增殖试验相同,但刺激物不同。小鼠B细胞可用细菌脂多糖作为刺激物,人B细胞常用抗IgM抗体或含SPA的金黄色葡萄球菌刺激。
2.溶血空斑试验
经典溶血空斑形成试验主要检测实验动物抗体形成细胞的功能,难以检测人类抗体产生细胞的情况,因此主要介绍被动溶血空斑形成试验和反相空斑形成试验。
(1)被动溶血空斑形成试验:试验原理是抗体形成细胞产生的特异性Ig与吸附在SRBC上的相应抗原结合,激活补体导致SRBC溶解,形成肉眼可见的溶血空斑。每个空斑中央含一个抗体形成细胞,空斑数目和大小分别表示抗体形成细胞的数目和产生抗体的量。操作方法是将吸附有已知抗原的SRBC、待检B细胞、补体加入琼脂糖溶液中,混匀,倾注于小平皿上,温育1~3h后,计量肉眼可见的溶血空斑。该试验可检测针对SRBC吸附抗原的抗体形成细胞,应用广泛。
(2)反相空斑形成试验:SPA包被SRBC溶血空斑试验,是现在常用的检测抗体生成细胞的溶血空斑试验。其原理是利用SPA能非特异性结合IgG Fc段的特性,用SPA包被SRBC形成SPA-SRBC复合体。抗人Ig抗体通过其Fab段与受检细胞产生的Ig结合形成复合物,其Fc段则与SRBC上的SPA结合,激活补体而使SRBC溶解形成空斑。操作方法是:将SPA-SRBC、待检的淋巴细胞、抗抗Ig抗体、补体加入琼脂糖溶液中,混匀,倾注于小平皿上,温育3~5h,计数肉眼可见的溶血空斑。此法可用于检测人类外周血中的IgG产生细胞,与抗体的特异性无关。用抗IgA、IgG或IgM抗体包被SRBC,可测定相应免疫球蛋白的产生细胞。
溶血空斑试验在临床上可用于测定药物和手术等因素对体液免疫功能的影响,还可用于免疫治疗或免疫重建后机体产生抗体功能的评价。
3.酶联免疫斑点试验(encyme-linked immunospot assay,ELISPOT)
(1)原理:用特异性抗原包被固相载体,加入待检的抗体产生细胞,若待检细胞过去被包被抗原致敏过,即可被诱导分泌抗体。分泌抗体与包被抗原结合,在抗体产生细胞周围形成抗原抗体复合物,将细胞吸附在固相载体上,随后加入的酶标记的第二抗体与细胞上的抗体结合,根据底物显色的深浅反映生成的抗体量,并计数显色斑点确定抗体生成细胞数,一个显色斑点代表一个抗体生成细胞数(图10-3)。

图10-3 酶联免疫斑点试验示意图
(2)临床应用与评价:ELISPOT试验是一种既可检测抗体生成细胞,又可检测抗体分泌量的方法。此外,ELISPOT还可检测生成特异性细胞因子的T细胞;ELISPOT双色分析可同时测定两种不同抗原刺激分泌的抗体。该试验目前在临床上多用于研究疾病的发病机制和患者的免疫功能状态。
(三)NK细胞功能检测
NK细胞具有细胞毒作用,能直接杀伤肿瘤细胞和病毒感染的靶细胞,因此可将肿瘤细胞作为靶细胞,肿瘤细胞的存活率反映NK细胞的活性,存活率低,NK细胞的活性则高。测定人NK细胞活性的靶细胞多用K562细胞株,而测定小鼠NK细胞活性则采用YAC-1细胞株。体外检测NK细胞活性的方法多样,介绍如下所述。
1.形态学法
(1)原理:NK细胞对靶细胞发挥杀伤作用时,可使靶细胞膜通透性增加,染料则可进入被杀伤的靶细胞内使其着色,而未被作用的活细胞则不被染色。根据着色的细胞数计算靶细胞的死亡率,靶细胞死亡率反映NK细胞的活性。
(2)技术要点:①制备一定浓度的靶细胞;②分离、制备待检的PBMC,作为效应细胞;③将效应细胞与靶细胞按一定比例混合,温育;④用台盼蓝或伊红染料染色,分别计数着色的死细胞和未着色的活细胞,计算靶细胞的死亡率。
(3)方法评价:本法简便,易于掌握,但肉眼判断死细胞与活细胞可使结果出现误差。2.酶释法
(1)原理:乳酸脱氢酶(LDH)是存在于正常活细胞胞质内的一种酶。当靶细胞受NK细胞作用而损伤,LDH释放到胞外,释放量的多少与细胞受损伤的程度成一定的正相关性。释放出来的LDH可催化反应液中的辅酶Ⅰ由还原型变为氧化型,两者在340nm处吸光度显著不同,前者大,后者小,故可利用反应液吸光度的降低量表示LDH的释放量,从而确定NK细胞的细胞毒活性。
(2)技术要点:①制备靶细胞和效应细胞;②将效应细胞与靶细胞按一定比例混合,加入试管中,为测定管;③另设两种对照管,其中自然释放管只加靶细胞,最大释放管加靶细胞和1%TritonX-100;④将上述三管样品温育、离心,取其上清液加入新鲜配制的LDH反应液后,马上用分光光度计测定A340,然后计算NK细胞活性。
![]()
(3)方法评价:本法经济、快速、简便,并可定量。缺点是靶细胞内酶含量低或某些未死亡细胞的自行释放,影响其灵敏度和特异性。此外,LDH分子较大,只有靶细胞膜完全被破坏时才释放,故不能较早地反映效应功能。
3.荧光法
本方法利用荧光素标记靶细胞,经与效应细胞共同温育后,离心去上清液,用荧光计检测剩余的活的靶细胞的荧光,从而确定NK细胞的杀伤能力。
由于荧光细胞自然释放率高,荧光本底强,可影响实验的灵敏度;另外,活细胞释放的荧光常被效应细胞和培养液等所粹灭。为避免以上缺点,可用时间分辨荧光免疫分析,将靶细胞用镧系元素铕(Eu3+)的螯合物标记,按同法与效应细胞共温后,用时间分辨荧光计检测荧光,可除去非特异性荧光本底。该法具有实验时间短,检测速度快,特异性强的特点。
4.放射性核素释放法
根据应用的放射性核素不同,分为51Cr释放和125I-UdR释放两种方法。
(1)51Cr释放试验
①原理:放射性核素51Cr可透过细胞膜与胞浆中小分子蛋白质结合,一旦细胞损伤、细胞膜遭破坏,51Cr随蛋白质外溢,并且不会被完整的细胞再度摄入。故当有51Cr标记的靶细胞被NK细胞破坏时,放射性核素释放出来,测定上清液的放射性强度(cpm值),从而确定NK细胞活性。
②技术要点:利用Na51CrO4标记靶细胞;在反应板的测定孔中加效应细胞和靶细胞,并设对照组(自然释放孔和最大释放孔);温育,离心,取所有的上清液并用γ计数器测定其cpm值,计算NK细胞活性。
![]()
③方法评价:本法操作简便、快速,能定量。缺点是51Cr半衰期短,自然释放率高,所需靶细胞多。近年有用111In(铟)来检测NK细胞活性,111In较51Cr而言其标记率高、用量微、自然释放率低。
(2)125I-UdR释放试验
①原理:125I-UdR作为DNA合成的前体物,可被摄入靶细胞核内,取代胸腺嘧啶核苷酸而掺入DNA链。当有125I-UdR标记的靶细胞被NK细胞杀伤,在胰酶和DNA酶作用下125I-UdR可从受损细胞核内释放出来。测定上清液的cpm值,确定NK细胞活性。
②技术要点:将125I-UdR标记的靶细胞和效应细胞按一定浓度混匀,加入测定孔中,同时设自然释放孔对照;温育;取测定孔培养物离心,去上清液,在沉淀细胞中加胰酶和DNA酶处理、离心取上清液;用γ计数器测定上清液和细胞中的cpm值,计算NK细胞活性。
![]()
NK细胞活性(%)=试验组125I-UdR释放率-自然组125I-UdR释放率
③方法评价:本法自然释放率比51Cr低,半衰期较长,方法的敏感性高,故被大多数实验室所采用。
5.化学发光法
NK细胞杀伤靶细胞时会发生呼吸爆发,产生大量活性氧自由基如O2-和OH-等。这些活性氧产物与细胞内某些可激发物质发生反应,产生微弱的发光现象。发光量与NK细胞杀伤能力成正相关。
6.流式细胞术
碘化丙啶只能渗透到死亡细胞内并与其DNA或RNA结合,在488nm波长激发下产生有色荧光。另外,NK细胞的体积大小以及对光的散射特性均不同于靶细胞。因此,可利用流式细胞术检测受NK细胞作用的靶细胞死亡率来反映其活性。
总之,检测NK细胞活性的方法多种多样,从简单的活细胞计数直至最先进的流式细胞仪分析。不同方法在操作的简繁性、敏感性和特异性上各有特点,因此应根据实验要求和具体条件进行选用。
三、吞噬细胞的功能检测
在机体免疫系统中,吞噬细胞是具有活跃生物学功能的免疫细胞。中性粒细胞在抗细菌感染中发挥重要作用。单核-巨噬细胞不但具有强的吞噬防御作用,还在特异性免疫应答的诱导和调节中起重要作用。因此,检测其功能活性对了解机体的免疫状态是至关重要。
(一)中性粒细胞的功能检测
1.中性粒细胞趋化功能检测
中性粒细胞可在趋化因子,如细菌产物、补体活性片段C5a、某些细胞因子等作用下作定向移动,运动强度反映细胞的趋化能力。测定方法主要有滤膜渗透法和琼脂糖平板法。
滤膜渗透法又称Boyden小室法。用一特制的分上、下两层的小盒,将趋化因子加入下室,待检细胞加入上室,两室用微孔滤膜分隔,37℃温育数小时后,上室的中性粒细胞受下室趋化因子的吸引,由滤膜微孔进入滤膜内,取滤膜清洗、固定、干燥、染色和透明,在高倍镜下观察细胞穿越滤膜的移动距离,从而判断其趋化功能。
琼脂糖平板法是将琼脂糖溶液倾倒在玻片上制成琼脂糖凝胶平板,在凝胶平板上按图10-4打孔,孔径3mm,孔间距2~3mm。中孔加白细胞悬液,左孔加趋化因子,右孔加对照液。37℃温育4~8h行固定和染色后,用显微镜测微器测定中性粒细胞向左孔的移动距离A,和向右孔的移动距离B,计算趋化指数,判断细胞的趋化运动能力。趋化指数越大,中性粒细胞运动能力越强。
![]()
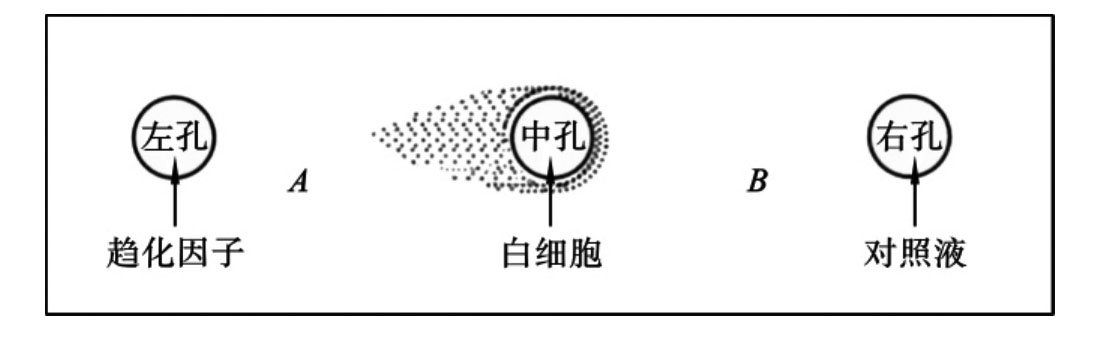
图10-4 白细胞趋化运动示意图
2.吞噬功能检测
常用显微镜检查法检测中性粒细胞的吞噬功能。中性粒细胞能吞噬细菌等颗粒性物质,故可根据吞噬率和吞噬指数判断其吞噬功能。吞噬率是指100个细胞中发挥吞噬作用的细胞数;吞噬指数是指每个细胞平均吞噬的细菌数。
该方法的操作要点是将分离获取的白细胞悬液与金黄色葡萄球菌或白色念珠菌悬液混合,37℃温育,涂片、固定和染色。在油镜下观察中性粒细胞对细菌的吞噬情况,计数吞噬细菌和未吞噬细菌的中性粒细胞数,其中对有吞噬作用的细胞,需记录吞噬的细菌数。按下式计算吞噬率和吞噬指数。

3.杀菌功能检测
主要采用硝基蓝四氮唑(nitroblue tetrazolium,NBT)还原试验。中性粒细胞在吞噬杀菌时,细胞内氧化代谢明显增加,葡萄糖磷酸戊糖旁路途径被激活,在该代谢过程中产生大量H2O2,并在过氧化物酶作用下释放大量单体氧,释放出的单体氧可被吞噬到或渗透到中性粒细胞胞质中的硝基蓝四氮唑接受,使NBT还原成甲臜。NBT是一种淡黄色的水溶性染料,其还原产生的甲臜为蓝黑色颗粒,沉积于细胞质中。因此,这种胞浆中有大小不等的深蓝色颗粒的中性粒细胞称NBT阳性细胞。计数100~200个中性粒细胞,算出NBT阳性细胞百分率而反映中性粒细胞杀菌功能。
(二)巨噬细胞功能检测
巨噬细胞功能检测常用于实验室的基础研究,如探讨巨噬细胞与疾病的关系、筛检免疫增强药物时。常用的检测方法有以下几种。
1.炭粒廓清试验
正常小鼠肝中枯否细胞可吞噬清除90%炭粒,脾巨噬细胞约吞噬清除10%炭粒。据此给小鼠静脉注射定量印度墨汁(炭粒悬液),间隔一定时间反复取静脉血,测定血中炭粒的浓度,根据血流中炭粒被廓清的速度,判断巨噬细胞的功能。此方法可应用于动物实验研究。
2.吞噬功能的检测
巨噬细胞具有较强的吞噬功能,若将巨噬细胞与某种可被吞噬而又易于计数的颗粒物质进行作用后,根据细胞吞噬颗粒物质的多少,可计算吞噬率和吞噬指数,粗略地了解其吞噬功能。例如将待检巨噬细胞与适量鸡红细胞(CRBC)悬液混合后,温育,涂片,染色,油镜检查200个巨噬细胞,确定其吞噬率和吞噬指数。

3.巨噬细胞促凝血活性测定
活化的巨噬细胞可产生一种与膜结合的凝血活性因子,这种因子能加速正常血浆的凝固。取经37℃预温了的正常兔血浆和CaCl2的混合液,加入已黏附有单层巨噬细胞的试管中,移置37℃,及时记录血浆凝固时间。实验证明在细菌LPS、肿瘤相关抗原或HbsAg等作用下巨噬细胞活化,血浆凝固时间明显缩短。本法稳定方便,是检测不同疾病患者巨噬细胞功能的指标之一。
四、免疫细胞检测案例
(一)T细胞数量检测
【要求】
(1)学会外周血T细胞的分离。
(2)能正确计数,分析结果意义和规范出具报告。
【用途】
(1)测定受检者外周血中T细胞的含量。
(2)了解机体的细胞免疫水平和动态变化。
【内容】
E花环试验检测T细胞数量。
【相关知识点】
原理:成熟T细胞膜表面表达CD2分子即绵羊红细胞受体,在体外一定条件下,当T细胞与绵羊红细胞混合时,绵羊红细胞可通过该受体结合在T细胞表面,形成以T细胞为中心的花环样细胞团。一个花环即表明一个T细胞。
【准备】
(1)Alsever液(阿氏血细胞保存液):葡萄糖2.05g、氯化钠0.42g、枸橼酸钠0.80g,蒸馏水加至100mL,置沸水浴中30min,无菌分装备用。
(2)pH值为7.4含10%小牛血清和5.0g/L水解乳蛋白的Hanks液:90mL Hanks液加10mL小牛血清和0.5g水解乳蛋白;0.8%戊二醛液。
(3)其他试剂:肝素62.5U/0.5mL;淋巴细胞分离液;Hanks液。
【操作步骤】
(1)配制淋巴细胞悬液:取单个核细胞悬液,用pH值为7.4含10%小牛血清和5.0 g/L水解乳蛋白的Hanks液配成(1×106)~(2×106)个细胞/mL。
(2)取0.1mL淋巴细胞悬液于一小试管内,加入0.1mL 1%绵羊红细胞悬液,混匀,37℃水浴5min,500r/min离心5min,4℃冰箱2h。
(3)加入0.8%戊二醛0.2mL,于4℃固定20~30min,弃去上清液,轻轻吹吸沉淀细胞,制片、自然干燥。
(4)Wright-Giemsa染液染色10min,水洗、干燥,高倍镜或油镜下观察。
【注意事项】
(1)0.8%戊二醛液应在临用前新鲜配制,用4.3g/L盐水配制比用Hanks液好。
(2)死亡淋巴细胞不能形成花环,因此待检标本放置不宜超过4h,分离所得的淋巴细胞应检测活细胞数,活细胞数小于90%不宜做E花环实验。
(3)绵羊红细胞与淋巴细胞的比值以(100∶1)~(200∶1)为好。
(4)E花环实验在15~23℃下操作为宜,4℃形成的花环在37℃环境中极易解离,细胞悬液从4℃取出后应及时检查。
【结果判断】
计数200个淋巴细胞,凡一个淋巴细胞周围吸附3个或3个以上绵羊红细胞为花环形成细胞,计算花环形成率。
【结果分析及临床意义】
(1)正常值:正常人E花环形成率为(64.4±6.7%)。
(2)花环形成率高于或低于正常值均有意义。
(3)临床意义:
①有助于细胞免疫缺损性疾病的诊断和疗效观察。原发性细胞免疫缺损性疾病,E花环形成率可明显降低。当用胸腺素治疗时,E花环形成率可增高。
②有利于恶性肿瘤疗效观察及预后判断。恶性肿瘤者其E花环形成率明显降低。
③辅助诊断某些疾病。某些病毒感染(如流感、带状疱疹等)、自身免疫性疾病、放射治疗以及应用激素、免疫抑制剂时,E花环形成率可降低;而甲状腺功能亢进症或甲状腺炎、移植排斥反应时E花环形成率可增高。
(二)淋巴细胞应答功能检测
【要求】
(1)学会光镜下观察和鉴别淋巴细胞形态特征。
(2)能正确判断T细胞转化率,分析其临床意义。
【用途】
(1)测定受检者外周血中T细胞的转化率,了解T细胞的应答能力。
(2)了解机体的总体细胞免疫状态。
【内容】
淋巴细胞转化试验(形态学检查法)检测T细胞功能。
【相关知识点】
1.原理
T细胞表面特有植物血凝素(PHA)受体,当T细胞与PHA在体外共同培养时,PHA可通过PHA受体作用于T细胞,使静止状态的T细胞活化为淋巴母细胞。这个过程与T细胞受到特异性抗原刺激后发生的变化相同,因而可用此试验来反应T细胞的功能状态。
2.有关概念
丝裂原是指在体内外活化淋巴细胞,使其发生有丝分裂的物质。丝裂原通过与细胞上的特异性受体结合发挥作用。T细胞特异性表达PHA受体,故试验中选用PHA特异性刺激T细胞向母细胞转化。
【准备】
(1)试剂:Wright-Giemsa染液;植物血凝素(PHA)、细胞培养液(RPMI1640)、待检标本(肝素抗凝血)。
(2)器材:CO2孵箱等。
【操作步骤】
(1)无菌取静脉血0.2mL加入预先装有1.8mL RPMI1640培养液的培养瓶中,混匀,置37℃、5%CO2孵箱培养72h,其间每天旋转摇匀一次。同时做生理盐水对照。
(2)培养结束后,摇匀细胞,进行1000r/min离心10min,倒净上清液,残留于管壁的少量液体回流至管底后,轻轻摇匀细胞。
(3)用毛细滴管取一滴细胞悬液,置于载玻片上,涂片,自然干燥,染色镜检。
【注意事项】
(1)严格无菌操作,杜绝微生物污染是实验成功的关键。
(2)RPMI1640细胞培养液的pH值、培养瓶的空间和玻璃质量等均可影响淋巴细胞转化率。pH值7.2~7.6转化良好,pH值低于6.2细胞不转化甚至死亡。宜选用中性玻璃小瓶。
(3)每批试验应设不加PHA的培养液对照组,以排除非特异的母细胞转化和患者血液中原已存在的母细胞对结果的干扰。
【结果判断】
(1)计数转化的淋巴细胞:按头、体、尾三段1~2个纵列进行计数。观察200个淋巴细胞中的转化细胞数。
(2)计算淋巴细胞转化率。
【结果分析及临床意义】
(1)淋巴细胞转化率正常参考值为60.1±7.6%。
(2)细胞免疫缺陷或功能低下者,其转化率可明显低于正常。
(3)估计疾病的疗效和预后,恶性肿瘤或白色念珠菌病患者,经转移因子或免疫增强剂治疗后,其转化率可由治疗前的低值转变为正常,反之则预后不良。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。















