第二节 病毒的增殖
一、病毒的增殖方式
病毒缺乏增殖所需要的酶系统和细胞器,只能在易感的活细胞内,借助宿主细胞提供的原料、能量和场所,以复制的方式增殖。
二、病毒的复制周期
从病毒进入易感活细胞开始,经过基因组复制,形成子代病毒并释放到细胞外的过程,称为一个复制周期。可人为地将其分为吸附、穿入、脱壳、生物合成、组装、成熟与释放等步骤,各个阶段发生的改变及周期的长短随病毒种类而异(图10-4)。
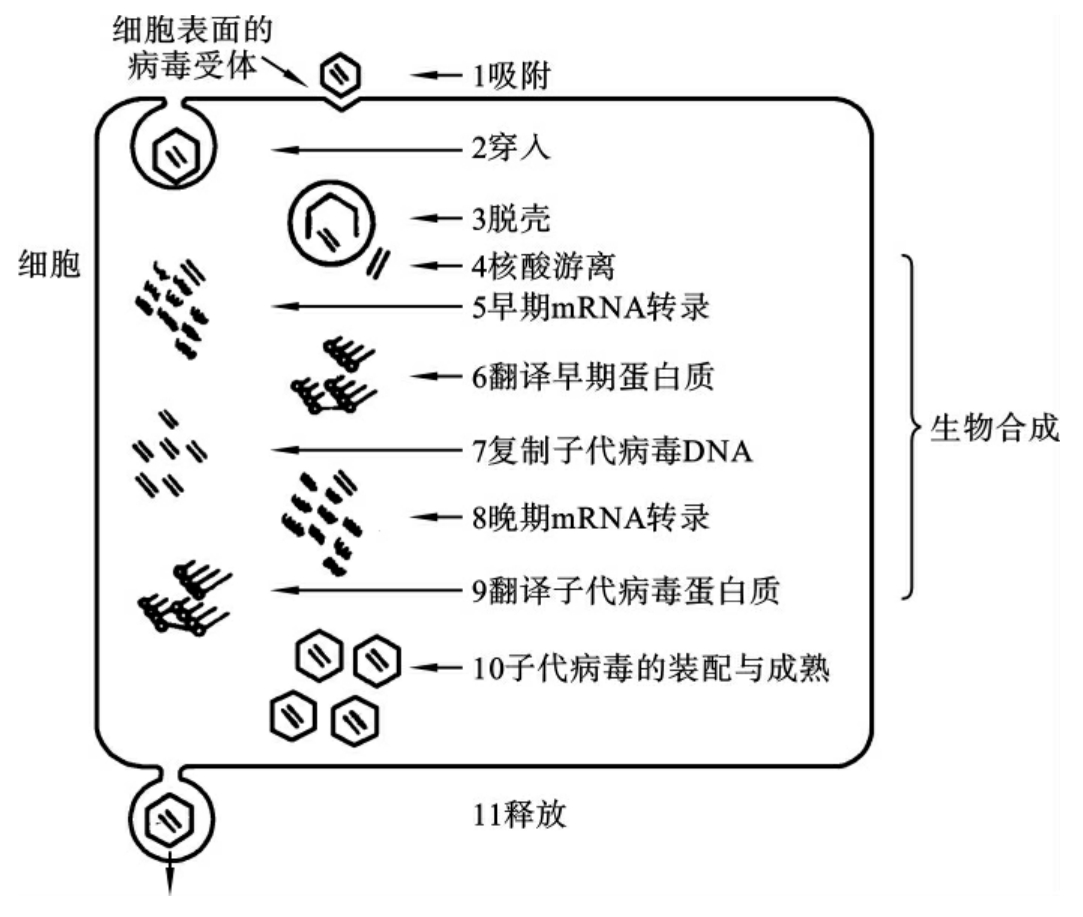
图10-4 病毒复制周期示意图
1.吸附
吸附是病毒感染的第一步,一般在几分钟至几十分钟内完成。病毒需先吸附在宿主细胞上才能进入宿主细胞进行增殖。吸附具有组织特异性,决定了病毒侵入的细胞类型。例如:脊髓灰质炎病毒主要侵犯神经细胞,是因为脊髓灰质炎病毒的衣壳蛋白与神经细胞表面的蛋白受体结合;HIV选择性地侵犯CD4+T淋巴细胞,是因为细胞表面的CD4分子是HIV的蛋白成分gp120的主要受体。
2.穿入
病毒吸附在易感宿主细胞表面后,病毒的基因组可以不同方式进入细胞内,这个过程称为穿入。病毒穿入细胞膜的方式有如下三种。①吞饮:裸露病毒多以此种方式进入易感细胞内,即细胞膜内陷将病毒包裹其中,形成类似吞噬泡的结构使病毒原封不动地进入细胞质。②融合:包膜病毒多以此种方式进入易感细胞内,即病毒包膜与宿主细胞膜融合,将病毒的核衣壳释放至细胞内。③转位:有的病毒体表面位点与细胞受体结合后,由细胞表面的酶类协助病毒脱去衣壳,使病毒核酸直接进入胞质,这种方式很少见,如噬菌体。
3.脱壳
病毒脱去蛋白质衣壳的过程称为脱壳。进入胞质内的核衣壳脱去衣壳后,病毒核酸暴露出来才能发挥作用。无包膜病毒衣壳并不进入细胞内。包膜病毒核衣壳进入胞浆后,在宿主细胞溶酶体酶的作用下,裂解衣壳释放出核酸。
4.生物合成
生物合成是指病毒基因组从衣壳中释放后,利用宿主细胞提供的低分子物质大量合成病毒核酸和蛋白质的过程。用血清学方法和电镜检查在细胞内找不到病毒颗粒,故称其为隐蔽期。各种病毒该期的时间长短不一,如脊髓灰质炎病毒为3~4h,腺病毒为16~17h。
在生物合成阶段,根据病毒基因组转录mRNA及转译蛋白质的不同,病毒生物合成过程可归纳为六大类型,即双链DNA病毒、单链DNA病毒、单正链RNA病毒、单负链RNA病毒、双链RNA病毒和逆转录病毒。指导病毒成分合成的程序包括三个重复的过程:①病毒mRNA的转录;②病毒复制子代病毒核酸;③特异性mRNA转译子代病毒结构蛋白和功能蛋白。详细过程在各有关章节中叙述。
5.组装、成熟与释放
子代病毒核酸和蛋白质合成后,在宿主细胞中组装形成新的成熟病毒体,并转移至胞外的过程,称为组装、成熟与释放。有包膜病毒还需在核衣壳外加一层包膜。包膜中的蛋白质是由病毒基因编码合成的,脂质及糖类都来自宿主细胞的细胞质膜。个别病毒(如疱疹病毒)则来自细胞核膜。
成熟病毒从宿主细胞游离出来的过程称为释放。病毒的释放方式主要有如下几种。①破胞释放:裸露病毒和RNA病毒都以这种方式释放,即病毒装配完成后,宿主细胞破裂而把病毒全部释放到周围环境中。②芽生释放:有包膜的病毒,在装配完成后,以出芽方式释放到细胞外。宿主细胞通常不死亡,仍可分裂增殖。③其他方式:有些病毒(如巨细胞病毒)很少释放到细胞外,而是通过细胞间桥或细胞融合,在细胞之间传播;另有些致癌病毒的基因组与宿主细胞染色体整合,随细胞分裂而出现在子代细胞中。
病毒感染细胞后可表现出不同的过程和结局:①病毒在细胞内增殖形成完整的传染性颗粒;②病毒进入细胞后,其部分基因整合入细胞染色体内,不产生子代病毒颗粒;③病毒进入细胞后不增殖,形成有缺陷的病毒颗粒,即缺陷病毒。
三、病毒的异常增殖与干扰现象
(一)病毒的异常增殖
1.顿挫感染(abortive infection)
当病毒感染的宿主细胞缺乏病毒复制所需的酶、能量及必要的成分时,病毒不能合成自身成分,或虽能合成部分或全部成分,却不能组装和释放出有感染性的病毒体,称为顿挫感染。构成顿挫感染的细胞称为非容纳细胞。例如,人腺病毒感染人胚肾细胞能正常增殖,若感染猴肾细胞则发生顿挫感染。猴肾细胞对人腺病毒而言,被称为非容纳细胞,在非容纳细胞内,病毒可以存在,但不能完成正常的增殖周期。如果条件改变,病毒可以经非容纳细胞介导而进入容纳细胞出现完整病毒的增殖。
2.缺陷病毒(defective virus)
一些病毒的基因组不完整或者某一基因位点改变,不能进行正常增殖,复制不出完整的有感染性病毒颗粒,此病毒即为缺陷病毒。缺陷病毒本身不能复制,但当与另一种病毒共同培养时,若后者能为前者提供所缺乏的物质,则能使缺陷病毒完成正常的增殖,这种具有辅助作用的病毒称为辅助病毒(helper virus)。如丁型肝炎病毒必须在乙型肝炎病毒或其他嗜肝DNA病毒的辅助下才能进行增殖。
(二)干扰现象(interference)
两种病毒同时或先后感染同一宿主细胞时,可发生一种病毒抑制另一种病毒增殖的现象,称为病毒的干扰现象。干扰现象不仅在活病毒间发生,灭活病毒也能干扰活病毒。常常是先进入的干扰后进入的,死的干扰活的,缺陷病毒干扰完整病毒。病毒间发生干扰的原因可能是:①与病毒诱导宿主细胞产生的干扰素(IFN)有关;②病毒的吸附受到干扰或改变了宿主细胞代谢途径;③缺陷病毒所引起的干扰。
病毒之间的干扰现象能够阻止、中断发病,也可以使感染终止,导致宿主康复。构成机体非特异性免疫的一部分。对疫苗的应用方面有重要意义,用干扰现象可指导疫苗的合理使用,避免由于干扰而影响疫苗的免疫效果。
四、病毒的变异
(一)病毒的变异
大多数病毒具有明显的遗传稳定性,但一些病毒在自然条件或人工条件下,也可发生诸如抗原性变异、毒力变异、耐药性变异、温度敏感性变异等方面的变异。病毒遗传与变异机制的明晰对于阐明某些病毒性疾病的发病机制、病毒疫苗的制备和病毒性疾病的防治具有重要意义。
1.抗原性变异
病毒抗原免疫原性的改变可帮助病毒逃避免疫系统的监视,造成病毒在人群间的流行。此外,抗原性变异也可影响抗原或抗体的检出,影响病毒性疾病的诊断。
2.毒力变异
某些病毒在传代过程中其致病性可由弱变强,也可能由强毒株变为弱毒株或无毒株,如从自然感染动物新分离出的狂犬病病毒(野毒株),对人和犬致病力强,但若将此毒株连续在家兔内传代50代后,其致病力减弱,可用于狂犬病疫苗的制备。
(二)病毒变异的机制
1.基因突变
基因突变是由病毒基因组中核苷酸发生碱基置换、缺失或插入引起的。病毒在增殖过程中常发生自发突变,当用理化因素(如温度、紫外线、亚硝基胍、氟尿嘧啶等)处理病毒时,可诱发病毒的基因突变。
2.基因重组
两种或两种以上的病毒感染同一宿主细胞时,有时会发生基因的交换,产生具有两个亲代病毒特征的子代病毒,并能继续增殖,称为基因重组(gene recombination)。其子代病毒称为重组体。基因分节段的病毒(如流感病毒、轮状病毒等)发生基因重组的频率明显高于不分节段的病毒。
五、理化因素对病毒的影响
病毒受理化因素作用后失去传染性,称为灭活(inactivation)。灭活的病毒仍可保留某些活性,如免疫原性、红细胞吸附、血凝及细胞融合等。了解理化因素对病毒的影响,对消毒、防治病毒感染、制备疫苗等均有指导意义。
(一)物理因素的影响
1.温度
大多数病毒耐寒不耐热,0℃以下存活良好,在干冰温度(-70℃)和液氮中(-196℃)可保存数月至数年。多数病毒加热56℃30min或100℃数秒钟即可被灭活。但乙型肝炎病毒则需要100℃10min才能灭活。
2.pH值
多数病毒在pH值为5.0~9.0的范围内比较稳定,在pH值为5.0以下或pH值为9.0以上迅速灭活,但也因病毒种类而异。在pH值为3.0~5.0时肠道病毒稳定,而鼻病毒则很快被灭活。因此,耐酸试验可鉴别这两种病毒。
3.射线和紫外线
X射线、γ射线或紫外线均可使病毒灭活。但有些病毒(如脊髓灰质炎病毒)经紫外线灭活后,若再用可见光照射可发生光复活,故不宜使用紫外线消毒法来制备灭活疫苗。
(二)化学因素的影响
1.脂溶剂
病毒的包膜含有丰富的脂类,对脂溶剂敏感,易被乙醚、氯仿、丙酮、阴离子去垢剂等溶解。但脂溶剂对无包膜病毒几乎无作用。在脂溶剂中,乙醚对病毒包膜破坏作用最大,所以乙醚灭活试验可鉴别有包膜病毒和无包膜病毒。
2.醛类及酚类
甲醛可灭活病毒并保留其免疫原性,故常用于制备病毒灭活疫苗。酚及其衍生物可使病毒的蛋白质发生变性而灭活病毒,如1%~5%苯酚可灭活多种病毒。
3.氧化剂、卤素及其化合物
70%乙醇能灭活大多数病毒;次氯酸盐、过氧乙酸等对肝炎病毒等有较好的消毒作用。
4.抗生素与中草药
现有抗生素对病毒无抑制作用,但可抑制某些待检标本中的细菌,有利于分离病毒。某些中草药(如大青叶、板蓝根、大黄及七叶一枝花等)对某些病毒有一定的抑制作用。病毒对丙三醇(甘油)的抵抗力较强,常用50%的甘油盐水保存和运送病毒标本。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。
















