第三节 T淋巴细胞介导的细胞免疫应答
T淋巴细胞介导的特异性免疫应答称为细胞免疫应答(cellular immune response),简称为细胞免疫。它是指T淋巴细胞在受到抗原刺激后,活化、增殖、分化为效应T淋巴细胞,最后通过效应T淋巴细胞发挥免疫效应的过程。它通常仅仅由TD抗原诱发。效应T淋巴细胞可分为效应Tc、效应Th1两种,其形成的过程及免疫应答效应大致如下。
一、细胞免疫应答的过程
(一)抗原提呈与识别阶段
1.APC提呈抗原
APC提呈抗原分为外源性抗原和内源性抗原两种情况。
(1)外源性抗原(侵入机体后,存在于机体细胞外的细菌、病毒、异种红细胞等抗原):被抗原提呈细胞(APC)以吞噬、吞饮等方式摄入细胞内,在细胞内被降解、加工成外源性抗原肽,该抗原肽再与机体细胞内质网中的MHCⅡ类分子结合为复合物,移动到APC细胞表面,供Th细胞的抗原识别受体识别、结合(图6-6)。
(2)内源性抗原(侵入机体后,存在于机体细胞内的细菌、病毒及肿瘤细胞等抗原):此类抗原见于病毒感染细胞、胞内菌感染的细胞、肿瘤细胞等。这些细胞虽然也可通过MHCⅠ类分子提呈其内源性抗原,但由于其最终将被杀伤、破坏、清除,故通常称为靶细胞或抗原靶细胞。这些细胞内的抗原(病毒抗原、细菌抗原、肿瘤抗原等)被称为内源性抗原,它们首先被细胞内的蛋白酶等降解、加工成内源性抗原肽,然后该抗原肽再与靶细胞内质网中的MHCⅠ类分子结合为复合物,移动到靶细胞表面,供Tc细胞的抗原识别受体识别、结合(图6-6)。
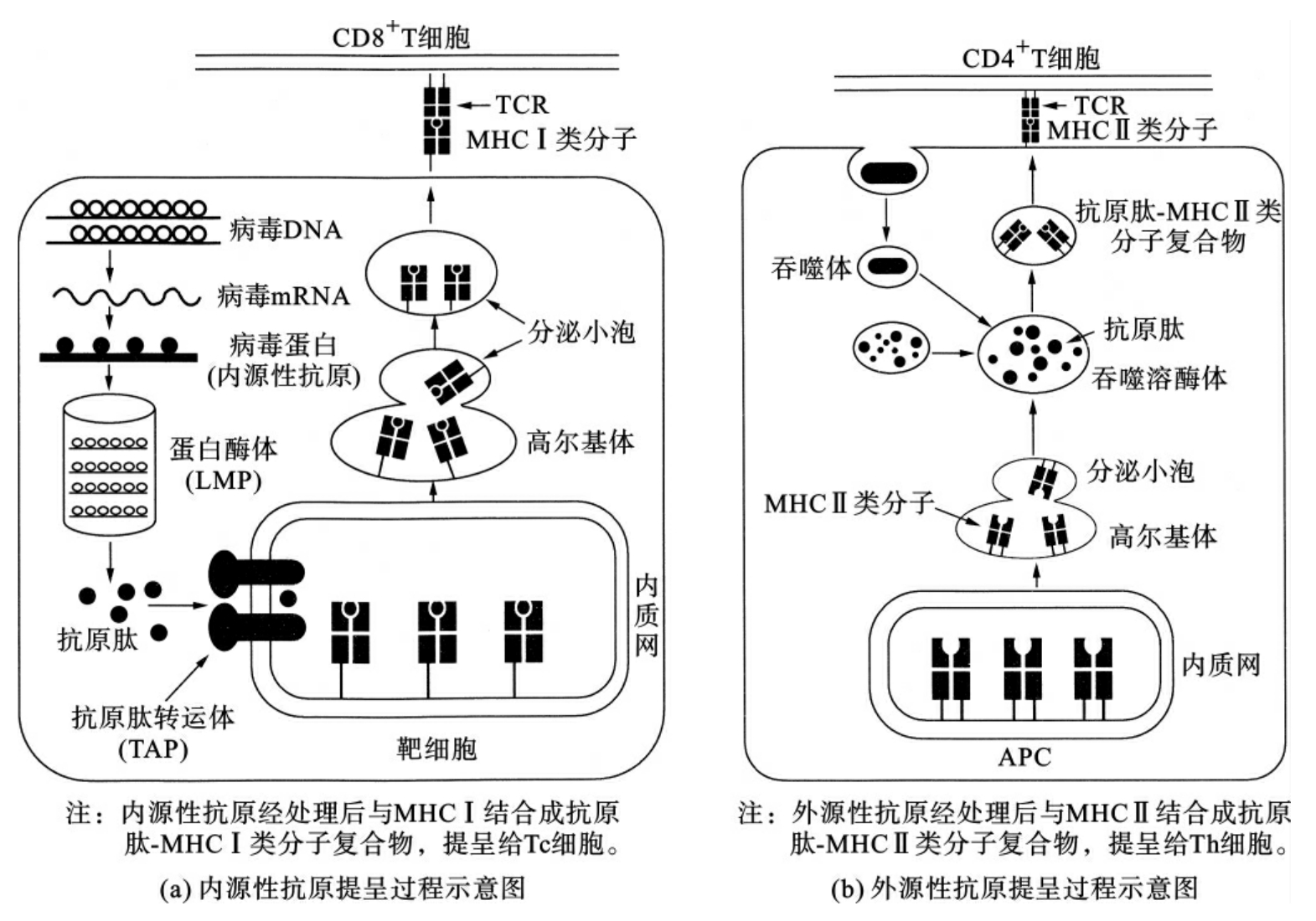
图6-6 抗原提呈过程示意图
2.T淋巴细胞识别抗原
Th细胞的抗原识别受体识别、结合外源性抗原肽的过程见前所述。参见机体对TD抗原的体液免疫应答过程相关内容。
Tc细胞仍然需要进行“双受体识别”。首先是Tc细胞表面的CD8分子识别靶细胞膜上的MHCⅠ类分子,然后是Tc细胞表面的抗原识别受体识别与MHCⅠ类分子结合的内源性抗原肽(图6-7)。此过程必须遵循这个先后顺序,并受到MHCⅠ类分子的遗传特征、个体差异及该种分子种类的限制,即也存在“MHC限制性”。
(二)T淋巴细胞活化、增殖、分化阶段
Th细胞和Tc细胞识别、结合抗原后,受到抗原刺激,活化、增殖、分化,最终形成大量的效应T淋巴细胞(CD4+效应Th1和CD8+效应Tc细胞)。该两类细胞的形成过程大致如下。
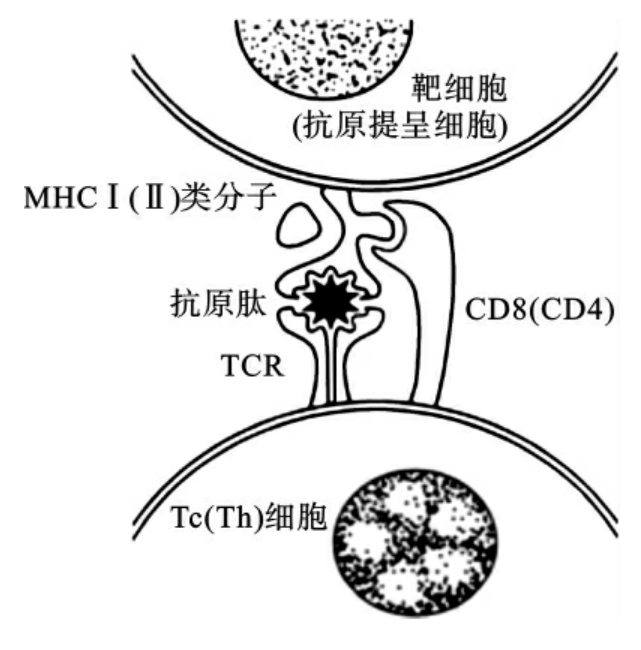
图6-7 T淋巴细胞(Tc/Th)“双受体识别”启动免疫应答示意图
1.CD4+效应Th1细胞的形成
CD4+Th细胞表面的CD4分子识别并结合抗原提呈细胞(APC)细胞膜上的MHCⅡ类分子,CD4+Th细胞表面的抗原识别受体(TCR)识别并结合MHCⅡ类分子提呈的外源性抗原肽(双受体识别),形成活化第一信号,Th与APC之间依靠黏附分子(协同刺激分子),互相黏附(刺激),形成活化第二信号,见前所述。
Th细胞在双信号的刺激作用下活化,活化的Th细胞其细胞膜上陆续出现各种细胞因子受体,当其受到自己分泌的以白细胞介素12(IL-12)为主的细胞因子作用后,增殖、分化为大量的CD4+效应Th1细胞(受到以IL-4为主的细胞因子作用后,则增殖、分化为大量的CD4+效应Th2细胞,参与对体液免疫的辅助,参见体液免疫应答相关内容)。
知识链接
CD分子
不同谱系的白细胞在分化成熟的不同阶段以及活化过程中,不断出现或消失的细胞表面分子称为白细胞分化抗原。应用单克隆抗体技术,将不同实验室来源的白细胞分化抗原统一鉴定、归类为一个分化群,则简称CD(cluster of differentiation)。它是白细胞分化抗原统一命名、归类的符号或代号。迄今为止,人类的CD分子已从CD1命名至CD339。
CD分子除可出现在淋巴细胞等白细胞表面外,还可见于红细胞系、巨核细胞/血小板系等细胞表面。它们不仅在免疫应答中免疫细胞的识别、活化、效应过程中发挥重要作用,还广泛参与体内的细胞生长、成熟、分化、发育以及炎症反应、肿瘤转移等生理、病理过程。
2.CD8+效应Tc细胞的形成
CD8+Tc细胞的活化也需要双信号的刺激。CD8+Tc细胞表面的CD8分子识别并结合靶细胞膜上的MHCⅠ类分子,CD8+Tc细胞表面的抗原识别受体(TCR)识别并结合MHCⅠ类分子提呈的内源性抗原肽(双受体识别),形成活化第一信号,Tc细胞与靶细胞之间依靠黏附分子(协同刺激分子),互相黏附(刺激),形成活化第二信号(图6-8)。
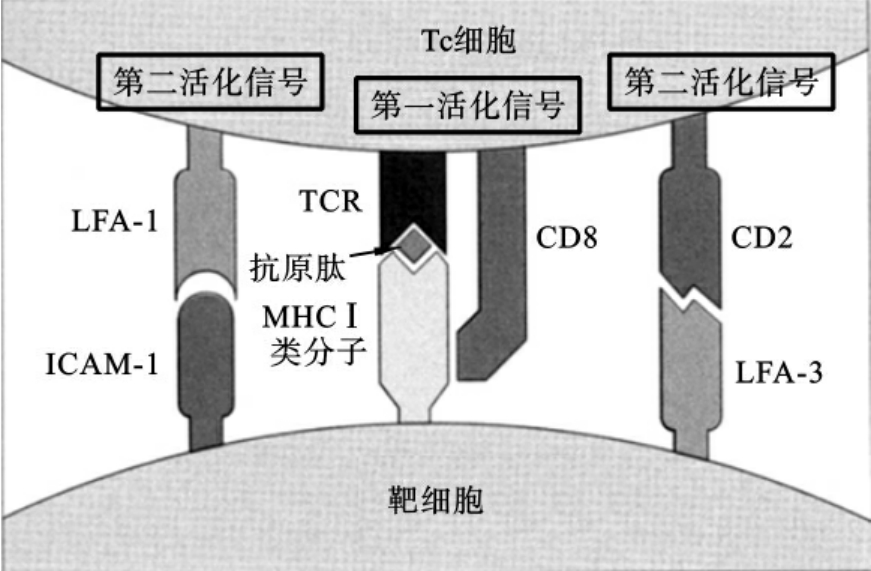
图6-8 Tc细胞的“双信号活化”过程示意图
在双信号的刺激作用下,Tc细胞活化。活化的Tc细胞其细胞膜上也陆续出现各种细胞因子受体,当其受到效应Th1细胞分泌的以白细胞介素2(IL-2)为主的细胞因子作用后,增殖、分化为大量的CD8+效应Tc细胞。
(三)效应阶段(清除抗原阶段)
效应Tc细胞直接杀伤抗原靶细胞,效应Th1细胞释放细胞因子间接杀伤抗原靶细胞,并产生对Tc细胞的辅助作用,同时形成炎症反应及其他免疫扩大效应,最终将细胞内的病原生物及其他抗原物质清除干净,发挥细胞免疫效应。详细过程如下。
1.效应Tc细胞的直接杀抗原细胞作用(细胞毒作用)
效应Tc细胞特异性识别并结合相应抗原靶细胞后,释放或表达(在Tc细胞的细胞膜上出现)穿孔素、颗粒酶、FasL等三大杀伤性物质。
穿孔素可在靶细胞膜上形成许多跨膜孔道(即可在细胞膜上形成许多穿过细胞膜的小孔,有类似于补体的膜攻击复合物的作用),使水分子通过小孔进入到靶细胞内,导致靶细胞死亡、裂解。
颗粒酶则可顺着孔道进入到靶细胞内,激活细胞内的DNA内切酶等细胞凋亡酶类,导致靶细胞的DNA裂解,细胞器破坏崩解,引起靶细胞凋亡,同时也导致靶细胞内存在的一切其他生物(如病毒、胞内菌等)的DNA裂解,细胞器崩解,引起各种病原生物的死亡。效应Tc细胞的杀抗原细胞作用如图6-9所示。
FasL(Fas配体)与靶细胞膜上的Fas受体(机体细胞膜上的一种细胞凋亡受体)结合后,则能启动细胞的凋亡程序,激活细胞内的DNA内切酶等凋亡酶类,导致靶细胞凋亡。
效应Tc细胞特异性杀伤抗原靶细胞时,自身不受损伤,短时间内可反复杀伤多个抗原靶细胞。该作用在Tc细胞的活化、增殖、分化及发挥效应等免疫特点上,与B淋巴细胞介导的体液免疫应答类似,同样需要效应Th细胞(另一种效应Th细胞——Th1细胞)辅助,同样具有特异性、MHC限制性、高效性等特性。
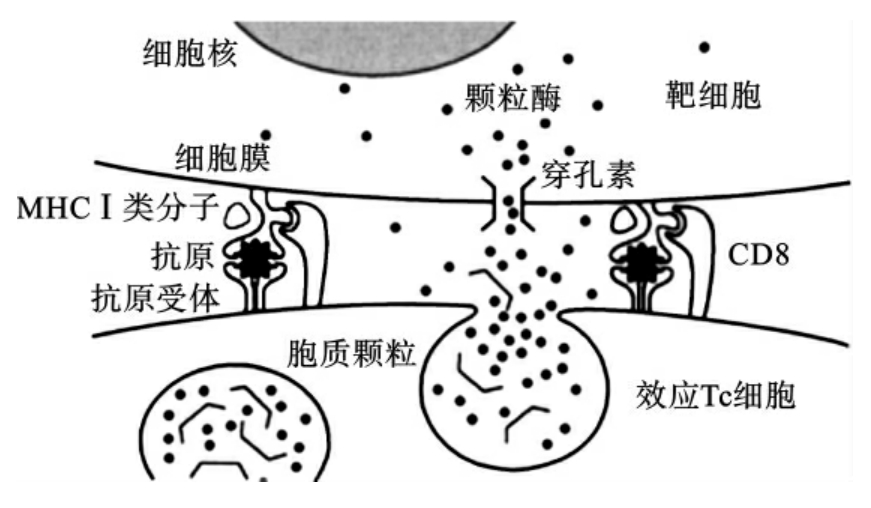
图6-9 效应Tc细胞的杀抗原细胞作用示意图
2.效应Th1的间接杀抗原细胞作用及引起的炎症反应
效应Th1细胞与靶细胞上的相应抗原特异性结合后,通过释放白细胞介素2(IL-2)、干扰素γ(IFN-γ)、肿瘤坏死因子β(TNF-β)等细胞因子,促进自身及Tc细胞、NK细胞、单核巨噬细胞、中性粒细胞等杀伤性细胞或吞噬细胞活化、增殖、分化,增强它们的杀伤活性或吞噬溶解能力,扩大它们的种群和数量,依靠它们间接杀伤或消灭抗原靶细胞,并扩大免疫效应;同时引起以淋巴细胞和单核/吞噬细胞浸润为主的慢性炎症反应(炎症反应的扩毛细血管作用,也有增大局部血流量,增加局部免疫细胞、免疫物质的正向免疫效应,并非完全有害。它是有一定积极意义的)。其中的肿瘤坏死因子还有直接杀伤肿瘤细胞等抗原细胞的作用。
二、细胞免疫的整体免疫效应
如上所述,细胞免疫通过效应Tc细胞直接杀伤抗原靶细胞,又通过效应Th1细胞分泌的细胞因子间接杀伤抗原靶细胞并发挥其他细胞免疫效应。由于这个特点,细胞免疫在机体的整体抗感染及排异过程中,所承担的免疫责任(或所作用的对象),主要是机体细胞内的病原生物、肿瘤细胞及其他细胞内抗原物质,故名细胞免疫。总括起来,大致有如下几点。
1.抗细胞内各种病原生物感染
某些胞内寄生菌(如结核分枝杆菌、麻风分枝杆菌、伤寒沙门菌、布鲁菌等)、其他胞内寄生微生物(如各种病毒、某些真菌)、胞内寄生虫(如疟原虫、弓形虫等原虫),均可在机体细胞内寄生,体液中的抗体由于不能进入到细胞内,很难对它们发生作用。所以对细胞内寄生的微生物及其他病原生物,主要是通过细胞免疫来清除和消灭的。往往是把它们连同它们所寄生的机体自身细胞一起破坏、消灭。所以,细胞免疫不可避免地会对机体自身组织细胞带来一定的、或多或少的损伤。
2.抗肿瘤
T淋巴细胞介导的细胞免疫,在机体的抗肿瘤免疫中担负主要作用。两大效应T淋巴细胞之一的效应Tc细胞,通过释放杀伤性物质,特异性地直接杀伤自身组织细胞中突变的并带有相应肿瘤抗原的肿瘤细胞;另一位重要成员效应Th1细胞,则分泌大量细胞因子,通过细胞因子调动各类吞噬细胞和杀伤性细胞间接杀伤和消灭肿瘤细胞,其中的肿瘤坏死因子还有直接杀伤肿瘤细胞效应。
3.引起免疫病理损伤——Ⅳ型超敏反应
免疫病理损伤之一的Ⅳ型超敏反应,其机制与细胞免疫应答的基本相同,可以看成是细胞免疫应答的副作用,是细胞免疫应答过程中几乎不可避免的对自身细胞的损伤。只要细胞免疫造成的这种自身损伤是严重的,已经给机体带来了明显的病害,就是Ⅳ型超敏反应。常见的Ⅳ型超敏反应有传染性超敏反应、器官移植排斥反应、接触性皮炎、某些自身免疫病等。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。














