第五节 肾小球/肾小管功能检查
肾小球功能仍多采用血肌酐来计算肌酐清除率,方法各异,目前比较公认的是Cockcroft-Gault方程,但近年来胱抑素C(CysC)正逐渐引起人们的重视。而肾小管功能检查则敏感性和特异性更逊色一些,因此临床上常采用组合法进行检查(见图2-7)。
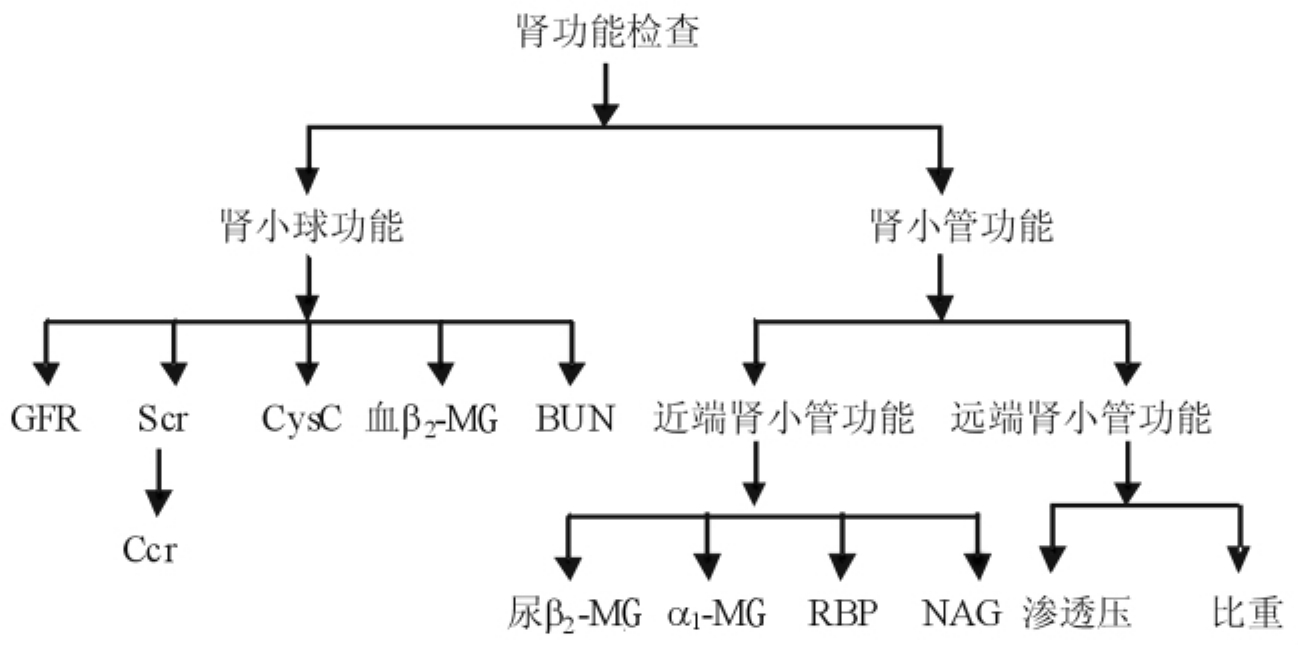
图2-17 常见肾功能检查
一、肾小球功能检查
肾小球滤过功能的指标很多,但特异性和敏感性各异。内源性指标存在一定的局限性,并且不同程度受到一些其他因素的影响(如肌酐受肌肉含量的影响),而外源性指标被认为是“金指标”,但由于操作复杂、成本高,限制了临床的广泛开展。
(一)肾小球滤过率(glomerular filtration rate,GFR)
GFR是指肾脏在单位时间内清除血浆中某一物质的能力,要求该物质全部由肾小球滤出,不被肾小管吸收,也不被肾小管分泌,菊糖清除率是理论上最理想的肾功能检查,但由于菊糖清除率的操作繁杂,造价较高,临床不实用。近年来一些学者用测定血肌酐来间接计算肾小球滤过率,简单、方便,值得借鉴。实际上大多数物质经肾小球滤过后,在肾小管内或多或少地被部分重吸收,此时其清除率低于GFR,还有少数物质不仅经肾小球滤过,还会由肾小管分泌,此时其清除率大于GFR。
美国K/DOQI指南推荐的MDRD-GFR:是1995年Levey在肾脏病膳食改良实验(Modification of diet in renal disease,MDRD)中使用的公式,认为其估算结果比Cockcroft-Gault得出的Ccr要理想,包括简化的MDRD-GFR。但是否适合我国,需要更多中心的研究。
MDRD-GFR=170×(Scr)0.999×(年龄)-0.176×(BUN)-0.170×(白蛋白)0.318×(0.762女性)×(1.180黑人)
简化MDRD-GFR=186×(Scr)-1.154×年龄-0.203×(0.742女性)×(1.210非裔美国人)
注:Scr单位为mg/dl,BUN单位为mg/dl,白蛋白单位为g/dl
MDRD-GFR是目前评估肾小球滤过功能的相对最好指标。国内陈楠等对汉族患者(n=101)进行的验证,得出的MDRD-GFR在CKD各期与99mTC-GFR均有较好的相关性,在肾功能严重受损时MDRDGFR有所下降,可能与肾外排泌肌酐有关。
(二)内生肌酐清除率(endogenous creatinine clearance rate,Ccr)
这是目前临床上仍为最常用的、仅次于GFR的反映肾小球滤过功能的指标。
1.几种常用实验方法
(1)经典Ccr。测定比较麻烦,要细心、准确留取24小时尿液,用甲苯做防腐剂,测量尿量,然后将标本混在一起并摇匀,取5ml与血标本一同送检,还要标明性别、身高和体重,以便校正体表面积。
Ccr(ml/min)=尿肌酐/血肌酐×24小时总尿量/1440×1.73/体表面积
注:肌酐单位为mg/L,尿量为ml,体表面积为m2
(2)CG-Ccr(Cockcroft-Gault方程)
CG-Ccr=(140-年龄)×体重×72-1×Scr-1(女性×0.85)
注:Scr单位为mg/dl,体重为kg
(3)肌酐倒数法。这是最简单的计算公式,多在临床上用于初步估测。
Ccr(ml/min)=1/Scr×100%
注:Scr单位为mg/dl
附:体表面积的计算方法
表2-29 几种体表面积(body surface area)的常用公式

摘自:中国运动医学杂志2003,22(6):576~580
2.临床意义
与GFR基本相同。
3.评价
由于近端肾小管可以分泌少量肌酐,因此尿中的肌酐是肾小球滤过和肾小管分泌的总和,所以肌酐清除率过高地反映了GFR,在正常人,这一偏差大概是10%~40%,在CKD患者,可以更高,而且是不可预测的。正常人血浆中的肌酐分为外源性(来自蛋白质食物如鱼、肉)和内源性(体内肌酸分解而来,每日生成量恒定,不受食物影响)。用经典法测定Ccr时,为准确测定内源性肌酐清除率,要求实验前2~3天要限制肉食,尿量的范围最好在1~2ml/min,低于0.5ml/min,Ccr会明显降低,此时不能代表真正的肾功能(GFR)。年龄也会影响Ccr,一般认为40岁以后,年龄每增长1岁,GFR会下降1%。凡是影响肌酐代谢的因素(详见肌酐测定),因会造成肌酐测定的误差,所以必然也影响到Ccr的结果。CG-Ccr是目前应用最多的方法,适应不同的年龄、性别和体重。
(三)血肌酐(Creatinine,Cr)
肌酐的分子式为C3H7N3O2,分子量113。外源性肌酐不断地从尿中排出,内源性肌酐是肌酸代谢的终末产物,它的生成和肌肉的重量呈一定的比例,每kg肌肉每天代谢产生肌酐50mg,约1mg/min,并且固定。肌酐因分子量小,基本由肾小球滤过,肾小管不吸收,相反还会少量分泌,尤其在血肌酐增高时,其由肾脏的排出量男性为0.9~1.5g,女性为0.8~1.2g(见图2-18)。血肌酐是目前临床上应用最普遍的关于肾功能的检查。

图2-18 血肌酐和尿素氮排泌示意图
1.临床意义
血肌酐增高是反映肾功能较粗的一项指标,当GFR下降50%以下时,血肌酐才会升高。此外血肌酐增高还可见于进食大量蛋白质、肌肉损伤和炎症、心功能不全、妊高症,血肌酐降低见于妊娠、肌肉萎缩、肝功障碍、营养不良。
2.评价
肾功能损伤早期由于肾小管对肌酐分泌的增加,血肌酐水平并不随GFR的下降而升高,只有当肌酐达到140~170μmol/L时,肾小管肌酐分泌达最大值,此后GFR的下降才会导致血肌酐的相应升高,在终末期肾衰透析的患者其肌酐值可能更无重要意义,其绝对值下降可能更提示有营养不良的存在。此外,肌酐的产生量还受饮食当中肉类摄入量的影响,因为肉类在烹调过程中可以使肉中18%~65%的肌酸转化成肌酐,食入后可使血肌酐浓度暂时增高,但相对影响小,不足以影响到早晨空腹肌酐的测定。所以低蛋白饮食的病人,血肌酐水平低于实际GFR所对应的肌酐水平。肾功能正常者,肌酐只能从肾脏排出,但对于CKD病人,肾外组织对肌酐的清除增加,患有严重肾脏病的的病人,其每日肌酐排泄量的2/3是通过肾外组织完成的,其排出量与血肌酐水平有关,排出量为0.026ml/kg·min,从肠道排出的肌酐在小肠中被细菌降解,所以CKD病人的尿肌酐排泄量是低的,这就造成了单独使用血肌酐会过高地估计GFR。综上所述,血肌酐既不是敏感反映肾功能的指标,也不是准确反映肾功能的指标,K/DOQI指南也强调单独使用血肌酐不能用于CKD的分级(见表2-30)。
表2-3 影响血肌酐测定值的常见因素
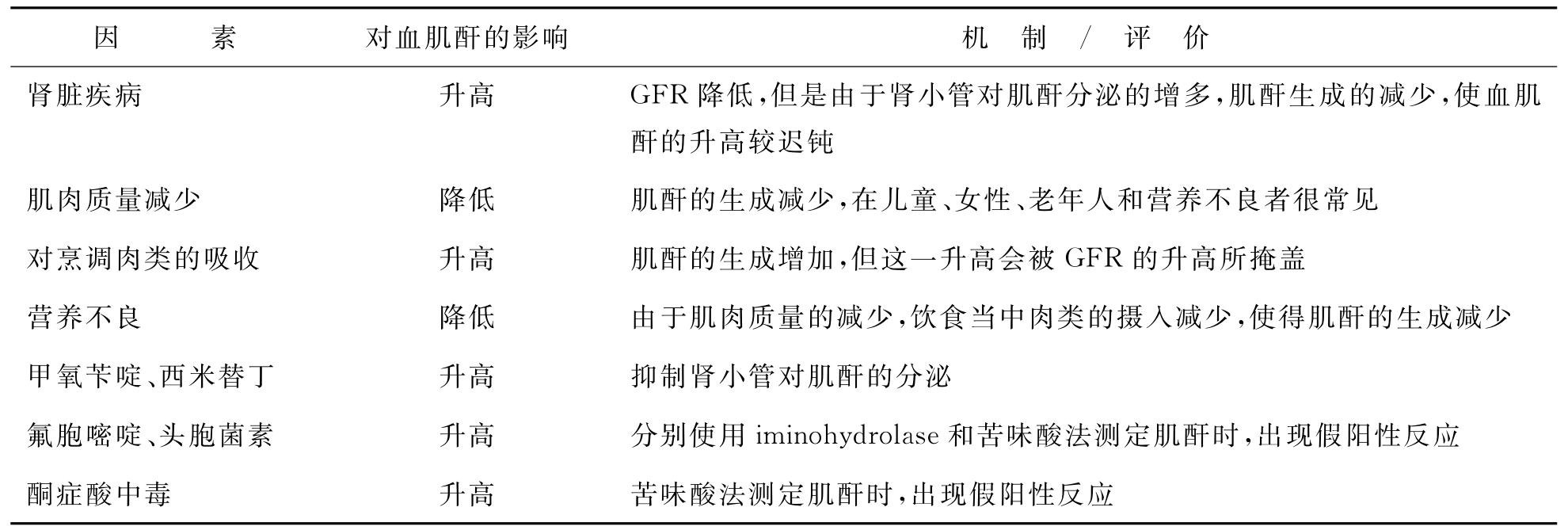
摘自:美国K/DOQI指南
(四)尿素氮(Blood Urea Nitrogen,BUN)
分子量60,BUN是人体蛋白质代谢的终末产物,肝脏是合成尿素的主要器官,其量取决于饮食中蛋白质的摄入量、组织蛋白分解代谢和肝功能情况。90%以上由肾脏排出,少部分由皮肤汗腺排出,从肾脏排出部分的30%~40%又被肾小管重吸收,同时肾小管也少量排泌尿素,并与肾功能程度成正比。每天由肾脏排出的尿素为10~30g。肠道内尿素分解成NH3,吸收后又经肝脏合成尿素并由肾脏排出(见图2-18)。
1.临床意义
(1)肾前性氮质血症:脱水、出血、心衰等引起的肾脏低灌注,急性感染、大面积烧伤、大手术后、甲亢、使用大剂量激素、消化道出血等引起的蛋白质分解过多。
(2)各种原因导致的肾功能损伤
2.评价
BUN的测定虽然可以反映肾小球的滤过功能,但只有在GFR下降到正常的1/2时,BUN才会升高。BUN不仅生成不固定(随高蛋白饮食、组织分解、出血而升高,肝脏病和低蛋白饮食降低),而且在尿量减少时,BUN在肾小管的重吸收也增加,也就是BUN的升高并不一定是肾小球滤过功能受损,所以只能做为粗略判断肾功能的指标。早在1992年的黄山会议上,我国就已经取消了用BUN做为肾功能分期的标准。
(五)血β2微球蛋白(β2-microglobulin,β2-MG)
β2-MG是一种低分子量(11800)蛋白质,存在于有核细胞的表面。存在于细胞外液,包括血清、尿、唾液、脑脊液和胸、腹腔积液中。正常人血清内β2-MG浓度相当恒定,0.8~2.0mg/L(平均为1.8mg/L,临界范围是2.0~2.4mg/L,2.5mg/L以上为异常。β2-MG是小分子蛋白,可自由通过肾小球滤过,在近曲小管几乎全部重吸收并降解为氨基酸,但肾小管不分泌。
1.临床意义
(1)肾小球滤过功能。敏感度显著高于血肌酐测定,可以检测出血肌酐在“盲区”(即GFR已降低而血肌酐仍正常的区域,相当于GFR在50~80ml/min之间)的早期肾功能损害者。但β2-MG最大的缺点是特异性不强。
(2)肿瘤(何杰金氏病、淋巴瘤、白血病)、免疫性疾病(系统性红斑狼疮、干燥综合征、类风湿性关节炎)、炎症(肝炎)等情况下,由于β2-MG合成加快,导致血β2-MG升高。正是由于这些原因,它不是理想的内源性标志物。
(3)长期血液透析病人,血清β2-MG浓度明显升高,其水平与血液透析的疗程长短呈正相关。长期血液透析可出现β2-MG相关性淀粉样变。
(六)血胱抑素C(Cystatin C,CysC)
关于Cystatin C的命名还未统一,如“半胱氨酸蛋白酶抑制剂C”、“胱蛋白酶抑制剂C”、“胱抑素”等。CysC广泛存在于各种体液中,由122个氨基酸组成的一种碱性非糖化的蛋白质,分子量为13300d。CysC由于分子量小,可自由通过肾小球滤过,在近曲小管重吸收,并迅速分解代谢,而且肾小管不分泌,其血浓度不受肌肉量、性别、炎症等影响。尿CysC做为早期肾小管的损伤标志物,已引起重视,但血CysC更是作为肾小球损伤的敏感标志物,也被人们关注。
1.临床意义
(1)早期发现肾功能改变(AKI、CKD)
(2)早期高血压肾病、早期糖尿病肾病
(3)药物性肾损伤的早期诊断
(4)其他肾小管损伤包括急性肾小管坏死、间质性肾炎等。
2.评价
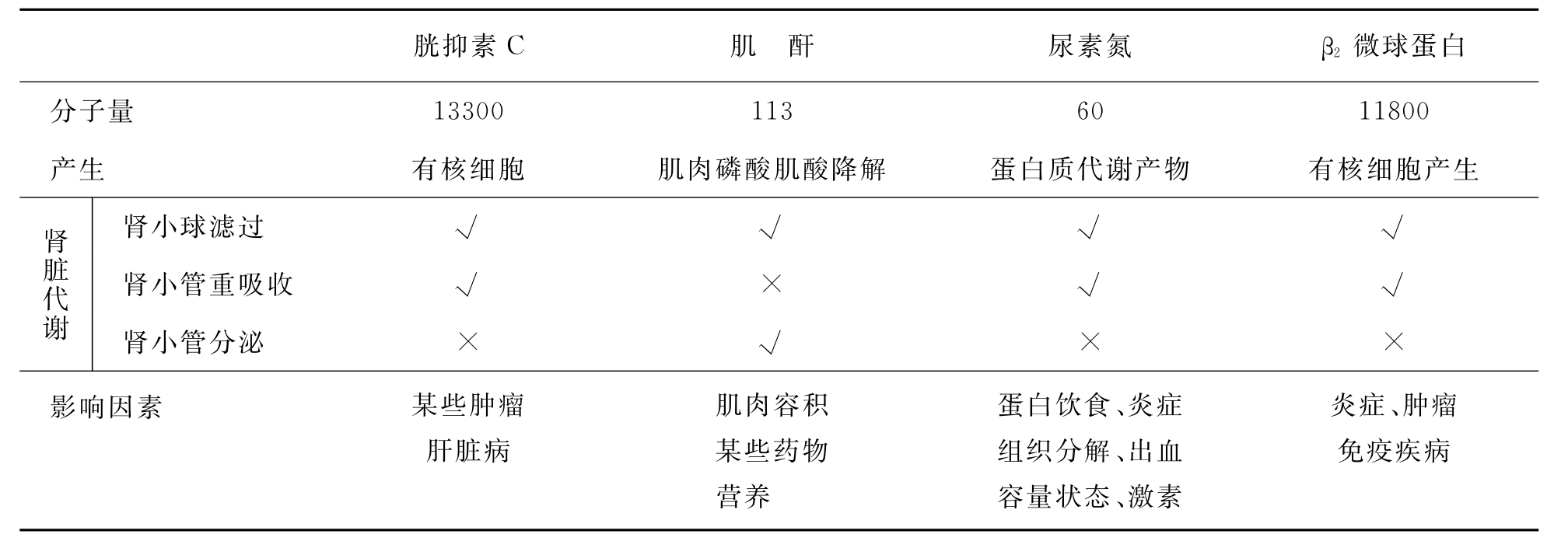
由于CysC的分子量比肌酐大且带正电荷,因此CysC比Scr更能反映肾小球功能的早期改变。由于肾脏有强大的储备能力和代偿能力,当GFR下降1/3时,Scr和BUN仍可正常,而CysC已经增高,可以弥补Scr和BUN的“盲区”。最大的缺点也是特异性差。在IgA肾病、狼疮性肾炎,即使肾功能正常,CysC也会增高。此外,恶性肿瘤、肝硬化、类风湿性关节炎等也可以升高,美国K/DOQI暂不推荐做为评价肾功能的方法(见表2-31)。
表2-31 几种常用肾功能检测的评价
二、肾小管功能检查
1992年Nath在美国肾脏病杂志中指出肾小管间质的损伤对肾实质病变过程及预后起决定性的作用,其重要性超过肾小球损伤。肾小管损伤的标记物(marker of renal tubular injury)分为两大类。一类为尿中低分子蛋白,一类为尿酶。这些标志物的测定不仅可以对病变的部位进行定位,意义更为重要的是测定这些物质的微量改变,对一些疾病(主要是糖尿病和高血压)的早期肾损害做出诊断,同时对一些药物、重金属等能够损伤肾小管的物质进行监测和早期诊断(见图2-19)。
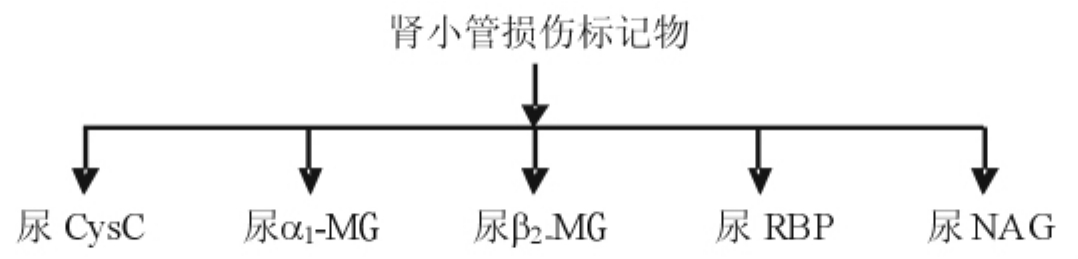
图2-19 目前几种公认的肾小管损伤标志物
(一)尿CysC
详见血CysC。
(二)尿α1-M
详见尿蛋白分析。
(三)尿β2微球蛋白
详见尿蛋白分析。
(四)尿RBP
详见尿蛋白分析。
(五)N-乙酰-β-D氨基葡萄糖苷酶(N-acetyl-β-D-glucosaminidase,NAG)
NAG是人类泌尿系统所特有的酶,发现于近曲小管,主要位于溶酶体,其次是刷状缘和细胞质中,相对分子量14万,不能经肾小球滤过,在尿中相对稳定。用组织化学的方法证实,在近端肾小管上皮细胞的溶酶体中该酶含量相当丰富,尽管血液中也存在NAG,但因其分子量大,不能通过肾小球滤过膜,因此,尿中的NAG并不是来源于血液而是主要来自于近端肾小管,所以当尿中NAG升高时,代表了近端肾小管的损伤。NAG有多种同功酶,大多组织含有A、B型同功酶,少数组织含有I、S、P型同功酶,肾组织含有三种同功酶,分别是A、B、I。NAG-A可能与肾小球损害有关,NAG-B则与肾小管损害有关。正常情况下尿液中可测得少量NAG,这种酶对细胞外各种因素(如化学物质、免疫活性物质、缺血、缺氧、毒素等)有着灵敏的反应,当肾小管上皮细胞变性坏死时NAG酶活性显著增高,且远早于尿蛋白及肾功能异常的变化,可作为反映肾小管损害的敏感和特异的指标。
1.临床意义
(1)各种原因引起的急性小管-间质病变。如肾小管坏死,急性间质性炎症。
(2)肾移植排斥反应的早期预报。70%的病人在排斥反应症状出现前1~3天,NAG即升高。
(3)某些肾小球病变。如急慢性肾炎、肾病综合征、肾盂肾炎、肾脏肿瘤、肾动脉狭窄。NAG升高,提示病变在活动,疾病缓解时,NAG也会下降。
(4)某些药物反应。这是值得重视的问题,一些药(如甘露醇、氨基甙类抗生素)可能会损伤肾小管,在使用中,会造成NAG的轻度升高,多数人认为是药物反应,如果再继续使用该药物,可能会导致急性肾小管坏死。
2.评价
自1959年Rosolki发现肾脏疾病尿酶会引起增高后,至今已经发现40多种酶。但因为尿酶存在特异性差的原因,仅有10余种用于临床。此外包括NAG在内的许多尿酶,其在24小时中不是等量排泄,波动很大,所以,在尿酶的检测方法中多用酶的活性来表示(单位为ū/g.cr)。当肾小管特别是近曲小管受损时,尿中NAG活性显著升高,相对而言,比其他尿酶出现的更早,因此,对肾小管损害的早期诊断(如药物毒性、糖尿病肾病、高血压肾病的早期诊断)有很大的意义。可以做为肾脏损害(尤其是肾小管)的早期、敏感、可靠的指标。
(三)小管浓缩功能检查
尿液的浓缩是远端肾小管的重要功能之一,在没有肾上腺和垂体后叶功能异常的情况下,尿液浓缩功能的好坏直接反映肾小管的功能状态,以及体内水盐代谢的状况。目前临床上用于反映浓缩功能实验的方法较多,但各种方法所得结果之间的差异也较大,难于形成统一的判断标准。
1.测定方法
(1)电导率测定(Condductivity)。电导率代表溶液中溶质的质点电荷,与质点的种类和大小无关。现做为尿流式细胞学的一个内容。它是利用阻抗系统的功能,用电极法测量尿液的导电率。在样本进入流动池之前,在样本两侧各有一个传导性感受器,接收尿液样品中的导电率信号。
(2)尿比重(Specific gravity,SG)。反映在恒温下,尿液与水的重量比。虽然测定方法较多,但会受到尿PH、糖、蛋白含量的影响,现推荐的方法为折射法。折射法是利用光线在空气中的速度与在溶液中的速度之比,通过临界角这一参数来计算的。其它详见干化学法部分。
(3)尿渗透压(Urine osmolality,Osm)。也叫尿渗量,是反映尿内具有渗透活性的粒子数量。是指经肾脏排泄后尿液中全部溶质的总数量。正常人的各种体液均有一定渗透压,它是维持机体内环境相对稳定的最重要条件之一。肾脏是通过对尿液浓缩或稀释作用,来达到调节体液渗透量平衡的(见表2-32)。
表2-32 正常人24小时尿液渗透压组成

摘自:王生余肾脏病与透析移植杂志2001,10(6):565
尿渗透压即反映肾脏对溶质和水的相对排泄速度,肾脏在抗利尿激素的调节下通过“逆流倍增”机制使尿液得以浓缩或稀释,表现为尿渗透压从与血浆等渗(300mOsm)增加到1200mOsm或可降低至50mOsm的过程。表示的方法有两种,一是质量渗透量,指在1kg溶剂中含有完全离解各种溶质的粒子总摩尔数,用Osm/kgH2O表示;另一种为体积渗量,指在1L溶剂中含有不能离解各种溶质的粒子总摩尔数,用Osm/L表示。正常情况下,尿渗透压范围是600~1000mOsm/kgH2O。现在常以禁水(8~12小时)渗透压来观察尿的浓缩功能。普通饮水时:300~900mOsm/kgH2O;限制饮水12h后≥850mOsm/kgH2O;而血浆(血清)为:300mOsm/kgH2O。
2.临床意义
(1)低渗尿主要见于肾浓缩功能严重受损的疾病,包括慢性肾盂肾炎、慢性肾衰、多囊肾、尿路阻塞性肾病、原发性肾小球疾病、肾原性尿崩症、尿崩症、原发性烦渴、尿酸性肾病、急性肾小管功能障碍等;
(2)高渗尿主要见于高热、脱水、肾淤血、心功能不全、周围循环不良、糖尿病、呕吐、腹泻、急性肾炎等。
3.评价
反映肾小管的浓缩稀释功能的实验很多,主要包括尿比重、尿渗透压和尿的电导率(见表2-33)。
表2-33 尿比重、尿电导率、尿渗透压的影响因素和评价

免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。
















