第二节 狼疮性肾炎
狼疮性肾炎(lupus nephritis,LN)是系统性红斑狼疮(systemic lupus erythematosus,SLE)的一个重要组成部分,也是SLE患者常见的死亡原因之一。SLE是一个十分古老的疾病。1230年Rogerius和1500年Paracelsus分别对其作过详细描述,称患者面颊部皮肤所出现的红色溃疡病变,为“lupus”(即“狼脸”的意思)。1838年,Cazenave和Schedel首先命名其为盘状红斑狼疮(discoid lupus erythematosus)。直至19世纪末和20世纪初,人们开始认识该病还可同时累及内脏器官。1895~1903年间,Osler曾较详细地描述其各种内脏病变。1935年,由Baehr首先报道其肾损害可表现为肾小球细胞增生、血管襻呈白金耳样改变和肾球囊内纤维蛋白聚集等病变。1951年,Coons等应用免疫荧光技术,检测其病变肾小球内存在自身抗体。1958年,Friou等分别从患者血清和组织中检测到抗核抗体,并逐渐明确其发病与自身抗核抗体有关,并确认其是一种较为常见的自身免疫性疾病。
SLE在某些人群(黑种人、华人等)中有较高的发病率,其人口之比为1∶2500,尤好发于年轻女性,在育龄期妇女之比可高达1∶700 ,男女之比约为1∶9。SLE可累及人体的多个系统,并伴有多种自身抗体形成,其中以核抗原抗体为主,包括抗DNA抗体(如抗dsDNA、ssDNA抗体)、抗组蛋白抗体、抗非组蛋白抗体(如抗Sm抗体)和抗核仁抗原抗体等(表3-3),还可出现针对胞质成分、血细胞表面抗原的抗体等。近年研究表明,抗dsDNA抗体、抗Sm抗体在SLE病例中有较高的发生率(分别为60%和30%左右),故对其诊断有一定的特异性。急性发作期,还常伴有血循环免疫复合物和补体(如CH50及其他补体成分)水平的下降。SLE可呈急性或隐匿起病,病程迁延、反复发作,多呈慢性经过。其临床表现十分多样,包括:①面部蝶形红斑;②皮肤盘状红斑;③光敏感增加;④口腔溃疡;⑤多发性关节痛;⑥浆膜炎(如胸膜炎、心包炎);⑦肾脏损害;⑧神经系统症状;⑨全血细胞减少;⑩免疫性疾病相关指标(如抗DNA抗体、抗Sm抗体、抗磷脂抗体)的升高;〇11间接免疫荧光法等可测得抗核抗体等。根据美国风湿病学学院(American College of Rheumatology)(1997年)对SLE分类所作的修订诊断标准,认为只要患者符合上述11项指标中的4项,就可确定患者患有SLE病。
表3-3 各种抗核抗体在SLE患者中的检出率

注:ANA,抗核抗体; IF,免疫荧光; Sm,Smith抗原; RNP,核糖核蛋白。
(本表摘自Abbas AK撰写的《免疫性疾病》。见:Kumar V,等主编的《Robbins and Cotran's疾病病理学基础》第7版,第229页)
LN是指SLE累及肾脏者,其发生率较高,可高达60%,有学者对其肾活检组织作免疫病理和电镜检查,则发现几乎所有SLE病例,均可出现肾组织的病变。LN患者多以蛋白尿为临床症状,约半数病例可表现为肾病综合征,多数病例可伴有血尿(镜下为主),尿液常规检查常可发现透明管型、颗粒管型和红细胞管型,约1/4患者可伴有轻度高血压,偶可表现为急性肾炎综合征或急性肾衰竭。
【病因和发病机制】
本病的病因和发病机制尚未阐明,但其发病的根本原因在于患者不能维持自身的免疫耐受功能,从而在机体内产生一系列可直接损害,或以免疫复合物沉积的形式损害组织的自身抗体。目前认为,与其发病相关的主要因素如下。
(1)遗传因素据资料统计,单卵孪生者的发病一致性可高达25%,而在双卵孪生者中,仅为1%~3%;又据对其高发性家族成员的统计,自身抗体在无临床表现的直系亲属中可高达20%;部分患者还存在遗传性补体成分(C2、C4或C1q)缺陷,可能会损害对循环免疫复合物的清除功能,从而促进其在组织内的沉积而引起组织损伤;另有研究表明,MHC基因可调控某些特异性自身抗体的产生; HLA-DQ位点特异多态性与抗dsDNA、抗Sm抗体的产生有关;多种非MHC基因也参与SLE的发病; HLA-DR2、HLADR3、HLA-A10、HLA-B18、HLA-BWl5抗原者与SLE发病有密切相关性。这种种迹象表明,遗传因素在本病的发生中占有重要地位。
(2)非遗传因素包括:①药物,如肼屈嗪(肼苯达嗪)、普鲁卡因胺等多种药物可引起SLE样反应,血中出现抗核抗体,但停药后常可自愈;②紫外线照射,这一重要的环境因素,常可使某些患者的病情加剧或恶化,但其机制不明,可能与射线照射激起免疫系统异常有关;③性激素,本病在育龄段人群中,女性发病较男性高10倍之多,其病情在妊娠期常加重,且与月经周期有关,可见雌激素对本病发生和进展有促进作用。
(3)免疫因素患者免疫功能的根本性紊乱是SLE发病机制中的一个重要环节。尽管患者T、B细胞均有功能异常,但至今仍未从中确定其哪一种改变是SLE的真正病因。多年来,一直将固有B细胞的功能亢进视为在SLE发病中的重要角色,然而近年来,通过对抗dsDNA抗体的分子分析,强烈表明其并不是由多克隆活化的B细胞生成,而是来源于一个更具选择性的Th细胞依赖的寡克隆B细胞,因为只有这种细胞所产生的抗DNA抗体为阳离子性的,易在带负电荷的GBM沉积而引起肾炎,而多克隆活化B细胞所产生的抗DNA抗体,却是阴离子性的,并不对肾小球造成损伤。
【病理改变】
LN肾小球的组织病理学改变十分复杂多样,且轻重不一。凡在各种类型原发性肾炎中所见到的病变,从正常肾小球或轻微病变,至其最严重的毛细血管襻坏死,伴透明血栓形成(图3-19,3-20)、毛细血管内增生(图3-21)、毛细血管外增生(新月体形成)(图3-22)、血管襻系膜区扩大伴插入所致的分叶(图3-23)、炎症细胞浸润及核碎片(nuclear fragments)形成(图3-24)、GBM增厚和血管壁白金耳样改变(图3-25)及血管襻节段性硬化或球性硬化等,均可见于不同类型的LN。

▲图3-19 狼疮性肾炎(Ⅳ型)(HE×400)
肾小球血管襻纤维蛋白样坏死,伴管腔内微血栓形成
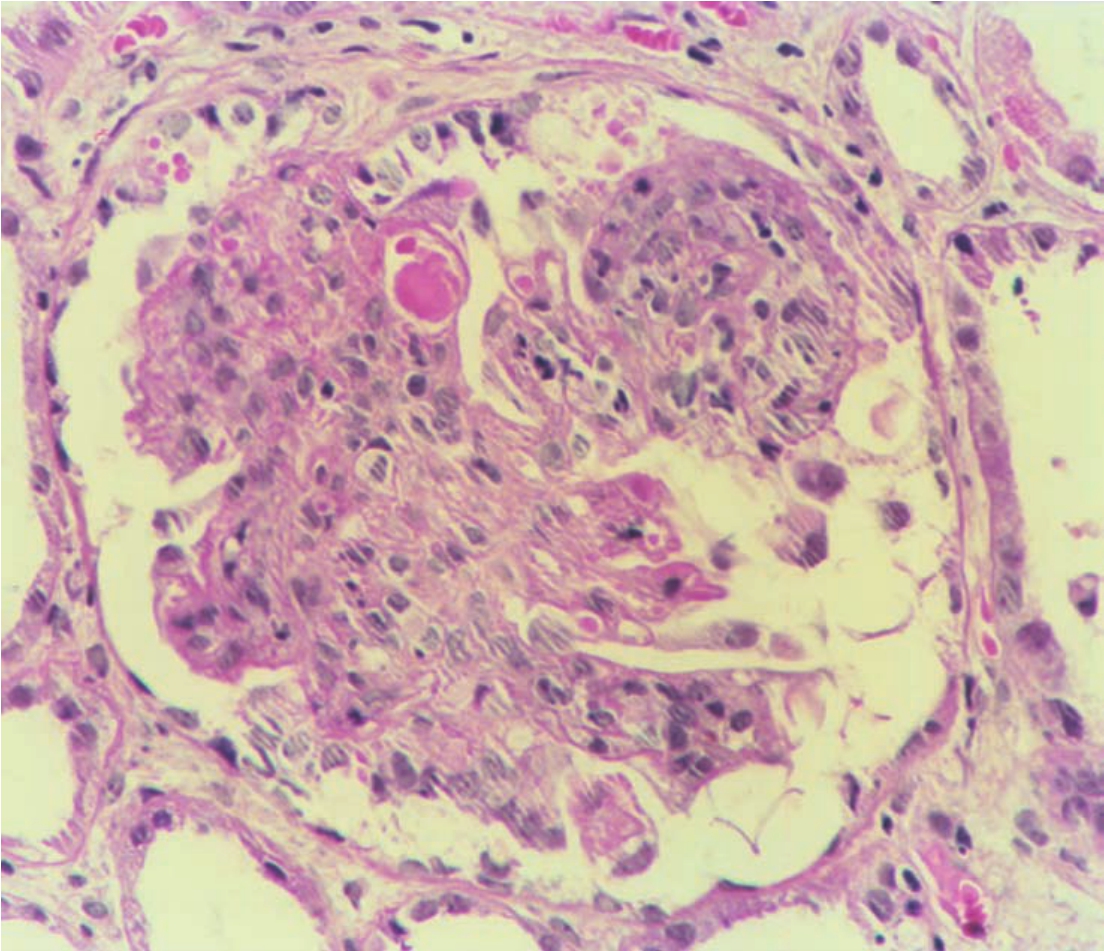
▲图3-20 狼疮性肾炎(Ⅳ型)(HE×400)
肾小球血管腔内透明血栓形成,伴系膜细胞增生及炎症细胞浸润和核碎片形成

▲图3-21 狼疮性肾炎(Ⅳ型)(HE×200)
肾小球毛细血管内增生、毛细血管壁增厚伴灶性上皮细胞增生

▲图3-22 狼疮性肾炎(Ⅳ型)(HE×400)
肾小球新月体(细胞纤维性)形成伴血管腔内多个透明血栓形成

▲图3-23 狼疮性肾炎(Ⅳ型)(HE×400)
肾小球血管襻呈分叶状,血管壁明显增厚,呈强嗜伊红性(即白金耳样变)

▲图3-24 狼疮性肾炎(Ⅳ型)(HE×400)
肾小球部分血管襻内形成大量核碎片伴白金耳样变

▲图3-25 狼疮性肾炎(Ⅳ型)(HE×600)
肾小球部分血管壁明显增厚,嗜伊红着色增强(即白金耳样变)
目前,对LN的组织病理学分类,最为常用的是WHO分类法,即1975的5型分类和1982年及1995年修订的6型分类。现将各型LN的组织病理学特征简要叙述如下。
(1)轻微病变型(minimal LN)又称Ⅰ型(classⅠ)LN。光镜检查示肾小球形态结构正常,而免疫荧光和(或)电镜检查可无或有少量免疫反应产物沉积。
(2)系膜增生型(mesangial proliferative LN)又称Ⅱ型(classⅡ)LN。光镜检查示肾小球轻-中度系膜增生伴基质增多(图3-26),其免疫荧光和(或)电镜检查可显示以系膜区沉积为主的免疫复合物(图3-27)。

▲图3-26 狼疮性肾炎(Ⅱ型)(HE×400)
肾小球血管襻系膜细胞轻-中度增生

▲图3-27 狼疮性肾炎(Ⅱ型)(EM×6 000)
肾小球系膜区多量电子致密物(D)沉积,伴少量内皮下沉积
(3)局灶节段型(focal segmental LN)又称Ⅲ型(classⅢ)LN。光镜检查示部分(<80%)肾小球呈现节段性病变,如节段性毛细血管襻坏死、系膜细胞增生伴毛细血管腔内透明血栓形成和节段性硬化病灶,也可伴有中性粒细胞浸润、核碎片和苏木精小体(haemotoxylin bodies)形成(图3-28,3-29),后者常呈细小碎片或不规则圆形团块,偶然也可见于巨噬细胞胞质内等。免疫荧光和电镜检查可显示以系膜区、内皮下沉积为主的免疫复合物。

▲图3-28 狼疮性肾炎(Ⅲ型)(HE×400)
肾小球血管襻节段性系膜细胞增生及灶性球囊壁层上皮细胞增生

▲图3-29 狼疮性肾炎(EM ×5 250)
肾小球系膜区凋亡细胞,即光镜中所见的苏木精小体
(4)弥漫增生型(diffuse proliferative LN)又称Ⅳ型(classⅣ)LN。光镜检查示80%以上的肾小球呈现细胞增生、血管襻坏死和增生性肾炎的各种改变,还伴有血管壁呈高度嗜伊红性增厚,即白金耳样改变、炎症细胞浸润、核碎片及其苏木精小体等。有时本型肾小球病变也常可分别似毛细血管内增生、膜性增生性(图3-30)和新月体性肾炎(图3-31)的组织病理学改变,从而将其分为毛细血管内增生、膜性增生和新月体性的亚型。本型肾组织切片,经Masson染色可显示系膜区、内皮下免疫复合物沉积和血管腔内有透明血栓形成(图3-32,3-33)。免疫荧光和电镜检查均可显示以肾小球系膜区、内皮下沉积为主或伴有上皮下少量免疫复合物沉积。

▲图3-30 狼疮性肾炎(Ⅳ型)(HE×400)
肾小球血管襻呈分叶状,系膜细胞明显增生伴系膜基质增多及毛细血管壁增厚

▲图3-31 狼疮性肾炎(Ⅳ型)(HE×400)
肾小球新月体形成,以细胞为主,伴多量中性粒细胞浸润

▲图3-32 狼疮性肾炎(Ⅳ型)(Masson ×400)
肾小球血管襻系膜区、内皮下呈现红色免疫复合物沉积

▲图3-33 狼疮性肾炎(Ⅳ型)(Masson ×400)
肾小球系膜区、内皮下呈现红色免疫复合物沉积,伴血管腔内呈红色透明血栓形成
(5)膜型(membranous LN)又称Ⅴ型(classⅤ)LN。光镜检查显示80%以上的肾小球毛细血管壁呈均匀一致增厚(图3-34),可为单纯性,与原发性MGN无区别,或为非典型性,常可伴有系膜细胞增生、节段性血管襻坏死、管腔内透明血栓形成、节段性硬化等病变。免疫荧光和电镜检查显示,免疫复合物沉积以上皮下为主,也常伴有系膜区、内皮下的少量沉积。

▲图3-34 狼疮性肾炎(V型)(HE×400)
肾小球毛细血管壁嗜伊红性增强,增厚明显,致管腔狭窄
(6)硬化型(sclerosing LN)又称Ⅵ型(classⅥ)LN。病变肾小球多已发生节段性或球性硬化,系膜细胞已减少,炎症细胞消失,与原发性硬化性肾炎无明显区别。
我组根据WHO分类法,对光镜、免疫荧光和电镜检查三者资料完整的523例(不完整资料者3例)LN病例,进行了组织病理学分类(表3-4)。从表中清楚地显示,我国的LN以弥漫增生型(Ⅵ型)为最常见,占61.2%,其次是系膜增生型(Ⅱ型)、局灶节段型(Ⅲ型)和膜型(Ⅴ型),分别占13.0%、10.1%和9.6%,而轻微病变型(Ⅰ型)和硬化型(Ⅵ型)均较少见,仅分别占4.8%和1.3%。
LN的肾小管-间质病变,包括肾小管萎缩、肾小管蛋白管型或肾小管上皮细胞再生、间质炎细胞浸润伴纤维化等病变,在局灶节段型、弥漫增生型和膜型中均很常见,尤以弥漫增生型更为严重。肾细小动脉在病变活动期可发生纤维蛋白样坏死,有时伴有管腔内血栓形成,而在病变静止期或经治疗后,其病变血管可为瘢痕替代或发生内膜纤维化。
表3-4 我组523例LN的组织病理学分类及其发生率

免疫荧光检查不仅在绝大多数病例中,可显示呈颗粒状分布的各种免疫球蛋白(IgG、IgA、IgM)和补体成分(C3、C1q、C2、C4等)的沉积,而且其分布范围十分广泛,除沉积于肾小球各部位外,还可沉积于肾小管基膜、肾血管(细、小动脉和小管周围的毛细血管)和肾球囊壁,乃至肾间质,这一特点在其他类型的肾炎病例中是不多见的。沉积的免疫球蛋白成分以IgG为主(图3-35),但常可伴有IgA(图3-36)和IgM(图3-37)的沉积,然而也有少数病例则分别以IgA和IgM沉积为主;沉积的补体成分也常有多种,尤其是C1q的多量沉积常可提示LN的存在(图3-38)。免疫球蛋白和补体的沉积方式或范围,与LN的病理类型存在一定关系,如Ⅰ、Ⅱ型LN者以肾小球系膜区沉积为主;Ⅲ、Ⅳ型者除系膜区发生沉积外,还分别伴有呈节段性分布和球性分布的毛细血管襻的沉积,尤其Ⅳ型者还可伴有肾小球外的沉积;Ⅴ型者多以血管襻伴有系膜区分布为主的沉积(图3-39)。

▲图3-35 狼疮性肾炎(Ⅳ型)(IF ×400)
颗粒状IgG在肾小球血管襻-系膜区沉积

▲图3-36 狼疮性肾炎(Ⅳ型)(IF ×400)
颗粒状IgA在肾小球血管襻-系膜区沉积

▲图3-37 狼疮性肾炎(Ⅳ型)(IF ×400)
颗粒状IgM在肾小球血管襻-系膜区沉积

▲图3-38 狼疮性肾炎(Ⅳ型)(IF ×400)
颗粒状C1q在肾小球血管襻-系膜区沉积

▲图3-39 狼疮性肾炎(Ⅳ型)(IF ×200)
颗粒状C3在肾小球血管襻-系膜区沉积
电镜检查显示,肾小球内电子致密物沉积可出现于几乎所有的LN病例,其中Ⅰ、Ⅱ型LN者以系膜区沉积为主(图3-27);Ⅲ型者以系膜区沉积为主,可伴有内皮下、上皮下少量沉积;Ⅳ者以系膜区、内皮下沉积为主(图3-40,3-41),可伴有上皮下沉积(图3-42)。在光镜下呈现血管襻白金耳样改变者,则显示其为内皮下大量沉积的电子致密物,有时显示其横断面充填于整个毛细血管腔(图3-43),可相当于光镜下所观察到的透明血栓;Ⅴ型者则以上皮下沉积为主(图3-44),可伴有系膜区沉积和内皮下少量沉积。电子致密物可沉积于肾小球外的其他部位,如肾小管基膜、肾血管和肾间质等。各种电子致密物的机化性结构(oganized structure)或称机化性沉积物(oganized deposit),如呈漩涡状排列的指纹状结构(finger print structure)(图3-45)、直行排列的微管状结构(microtubular structure)(图3-46)和纤维状结构(图3-47),也均可见于LN病例。尽管这些结构对LN不具有诊断意义,但仍有一定的特征性。对LN具有诊断价值的超微结构改变多见于血管内皮细胞胞质内、呈现交叉排列的管状和小泡状结构,称为管网状小体(tubuloreticular bodies)或管网状结构(tubuloreticular structure)(图3-48),对其性质仍不明,但有学者认为其是胞质内扭曲内质网的剖面结构。其他超微结构改变,如肾小球内中性粒细胞浸润(图3-49)、血管腔内纤维蛋白类晶团聚体(fibrin tactoid)形成(图3-50)、系膜细胞增生伴基质增多,并向周边部毛细血管襻内皮下插入、基膜增厚伴钉突形成和足细胞的各种改变等也很常见。

▲图3-40 狼疮性肾炎(Ⅳ型)(EM×2 250)
肾小球系膜区、内皮下大量电子致密物沉积

▲图3-41 狼疮性肾炎(Ⅳ型)(EM×6 000)
肾小球内皮下及系膜区大量电子致密物沉积
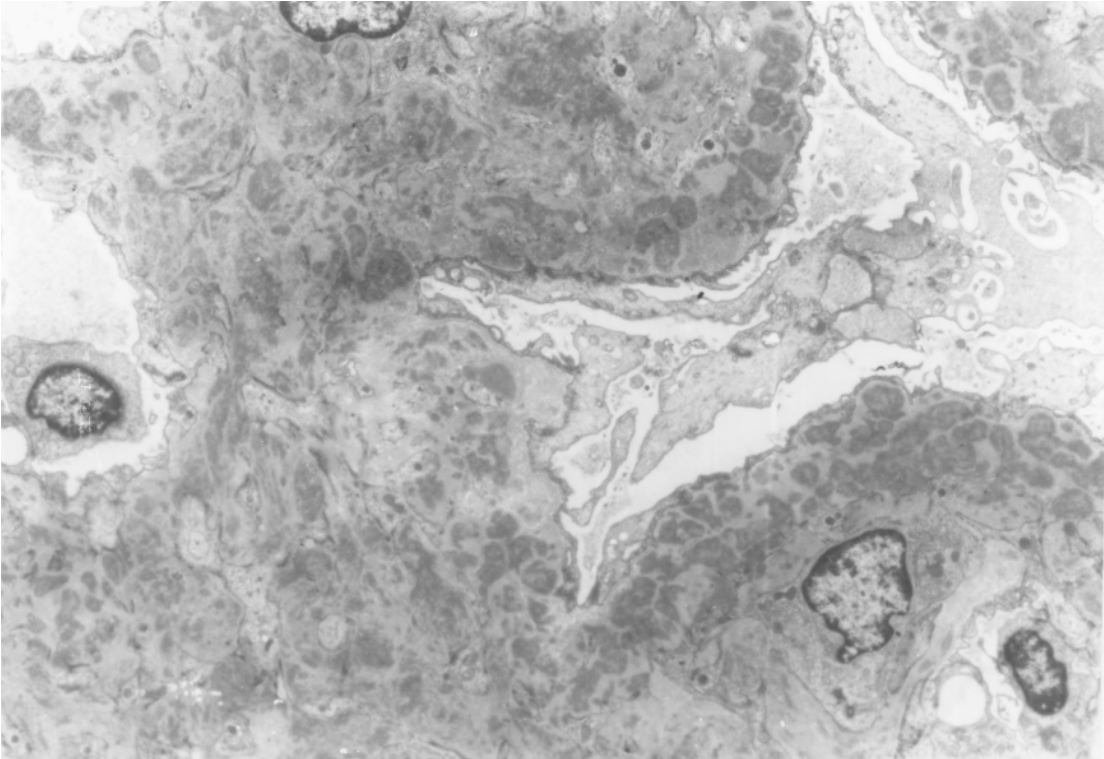
▲图3-42 狼疮性肾炎(Ⅳ型)(EM×6 000)
肾小球系膜区、上皮下大量电子致密物沉积

▲图3-43 狼疮性肾炎(Ⅳ型)(EM×7 500)
肾小球内皮下电子致密物(D)沉积,致管腔闭塞,伴上皮下少量沉积(↑)

▲图3-44 狼疮性肾炎(V型)(EM×7 500)
肾小球上皮下大量电子致密物沉积伴血管基膜增厚

▲图3-45 狼疮性肾炎(EM ×60 000)
肾小球系膜区电子致密物中形成指纹状结构(▼)
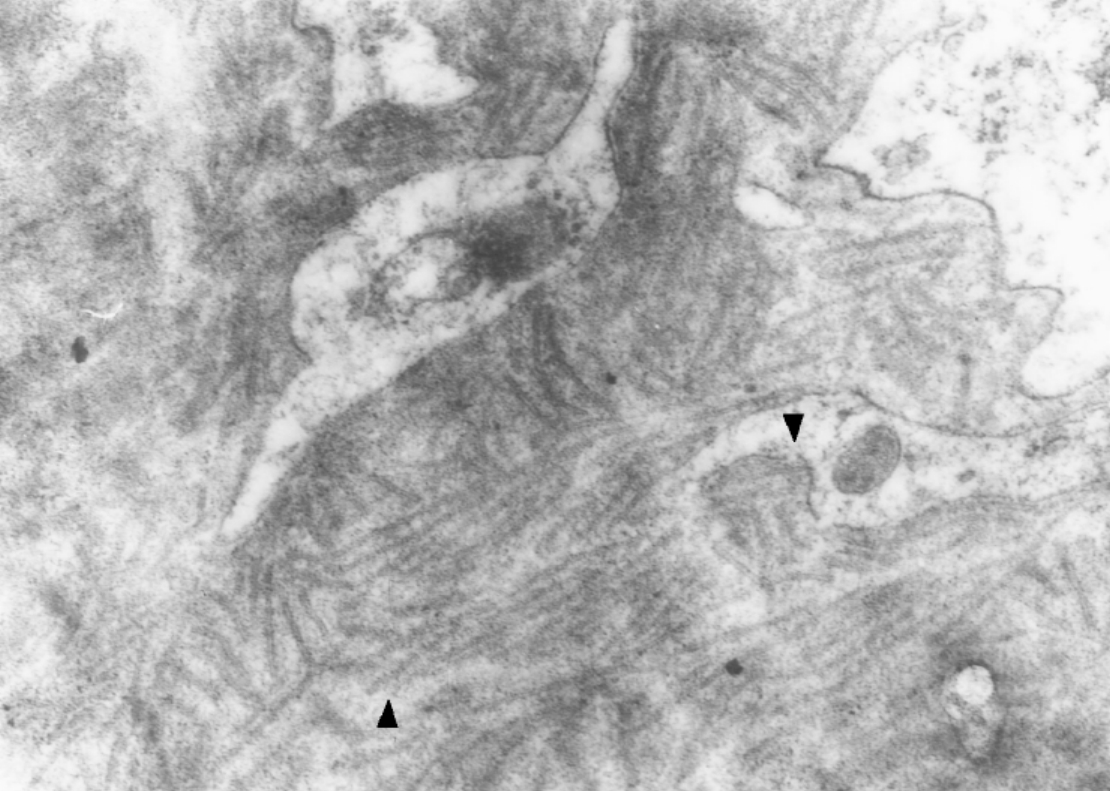
▲图3-46 狼疮性肾炎(EM ×51 000)
肾小球系膜区电子致密物中形成微管结构(▼)
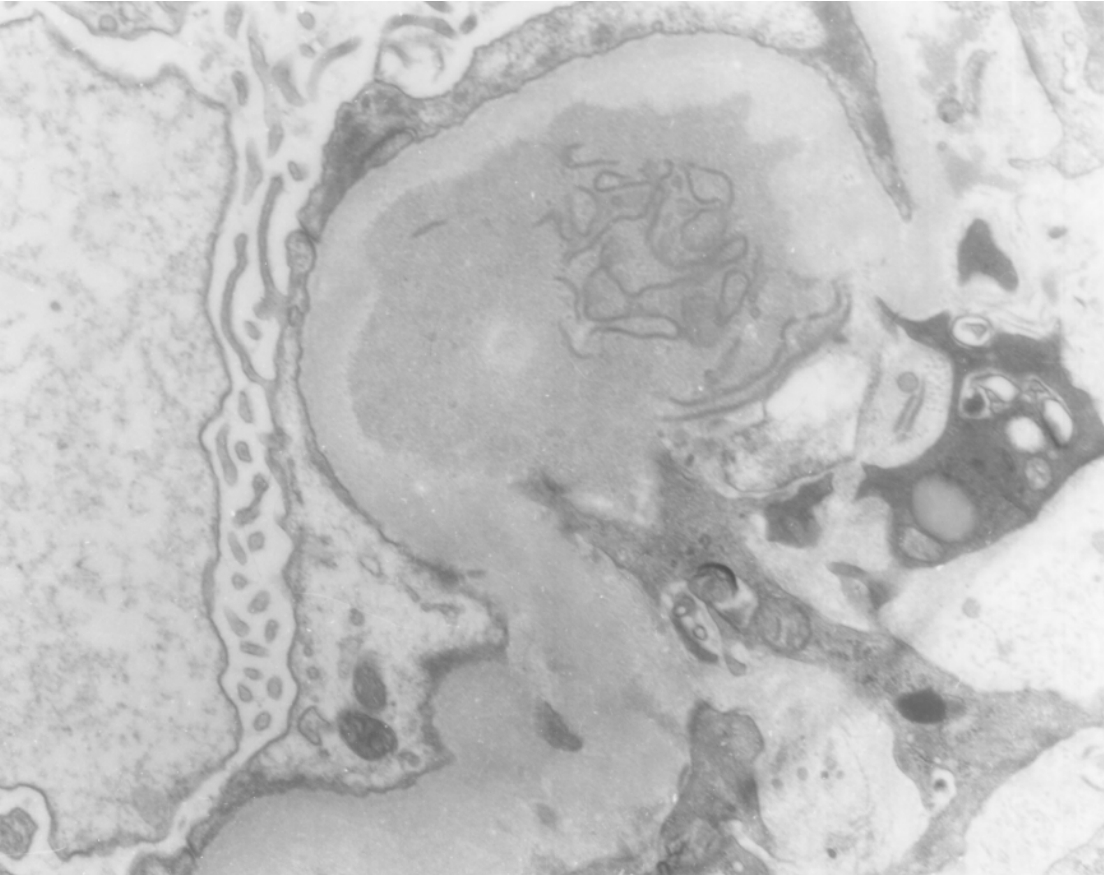
▲图3-47 狼疮性肾炎(EM ×21 000)
肾小球系膜区电子致密物中形成的纤维状物

▲图3-48 狼疮性肾炎(EM ×45 000)
肾小球血管襻内皮细胞胞质内的管网状结构(▼)

▲图3-49 狼疮性肾炎(EM ×3 750)
肾小球血管腔内聚集的中性粒细胞

▲图3-50 狼疮性肾炎(EM ×3 000)
肾小球毛细血管腔内纤维蛋白类晶团聚体(▼)形成
【鉴别诊断】
对LN病例的诊断,必须密切结合患者的各种临床表现,如症状、体征和实验室检查结果。要对LN各种类型的确定,必须首先除外各种类型的原发性肾炎,尤其应注意Ⅰ型与MCD、Ⅱ型与MsPGN、Ⅲ型与FGN、Ⅳ型与MPGN、Ⅴ型与MGN的区别。很显然,还必须除外继发性肾炎的一些常见肾病,如IgAN(包括HSN)、系统性血管炎、HBV相关性肾炎等。在作肾活检病理诊断时,如一时还不知晓临床必须提供的相关检查结果时,病理学工作者可先对其作一个组织病理学分类的诊断报告。如其病变十分典型,也只能对其作可能为LN的诊断,并建议临床作确诊SLE病的相关检查。一般说来,通过对这些疾病的临床表现及肾组织光镜、免疫荧光和电镜检查结果的综合判断,对其绝大多数病例还是不难作出诊断的。
【预后】
正如前述,LN是引起SLE患者死亡的最常见原因。据报道,约有20%的SLE患者,最终可因肾衰竭而死亡。大量研究表明,影响LN预后的相关病理因素主要有两方面:一是其组织病理学类型,据临床随访资料表明,患者的5年存活率在Ⅰ、Ⅱ型者可达100%,Ⅲ型者为73%,Ⅳ型者为60%,Ⅴ型者为90%;二是肾组织病变的活动性指标(包括血管襻坏死、核碎片、细胞性新月体、白金耳样改变伴透明血栓形成、粒细胞或单个核细胞浸润、肾间质单个核细胞浸润等和慢性化指标),如硬化肾小球、纤维性新月体、肾小管萎缩、间质纤维化等。当其指标的积分越高,即病变程度越严重,其预后就越差。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。

















