随着药物分析技术的不断发展,生物样品的预处理技术迅速提高,许多集萃取、纯化、浓缩、进样分析于一身的分离分析的方法和技术出现于生物样品分析中,如在线固相萃取、固相微萃取、微透析技术等。
2.2.4.1 在线固相萃取
1.柱切换技术
柱切换技术是实现在线固相萃取的关键技术,通过在高效液相色谱仪上采用切换阀连接两根或两根以上相同或不同分离机理的色谱柱,通过改变流动相走向,分别进行纯化、富集和测定,达到在线分析的目的。
在传统高效液相色谱法仪上增加一个或多个切换阀(六通阀或十通阀)即可实现柱切换技术,切换阀的切换时间通常由色谱系统中的程序控制。图2-10所示为一个典型的HPLC柱切换示意图,主要用于在线净化样品。其中图2-10(a)所示为预处理状态,在此状态下,生物样品中待测组分被保留在预处理柱的柱头上,而大部分内源性杂质被预处理流动相带至废液瓶,达到纯化和富集的目的。预处理结束后,六通阀被切换至分析状态[见图2-10(b)],保留在预处理柱头的待测组分随分析流动相进入分析柱进行分离与测定。经过一段时间(切换时间)后,切换阀又切换成预处理状态,对预处理柱进行再生处理,准备下一次进样。
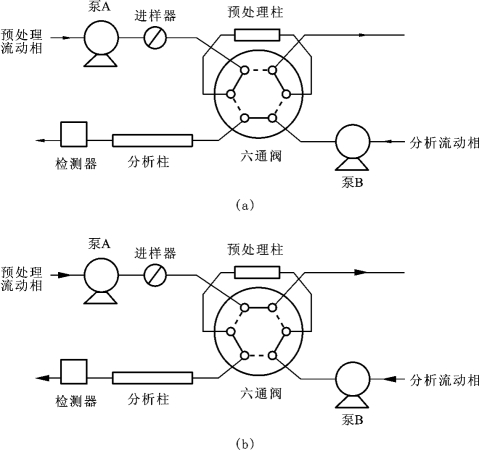
图2-10 HPLC柱切换系统示意图
(a)预处理状态;(b)分析状态
为了防止切换时系统压力过大,预处理柱不宜太长,通常为3~5 cm,填料颗粒粒径为5~40μm。但如果直接取生物样品进样时,填料颗粒粒径需增加,如血浆直接进样时常用填料颗粒粒径为25~40μm,全血直接进样时填料颗粒粒径为40~80μm;同时选用较大孔径的预处理柱筛板,如40μm。选择粗粒径填料和大孔筛板的目的是防止大分子杂质堵塞,延长预处理柱的寿命。另外每次进样前后,常需采用合适的清洗液清洗进样系统与预处理柱,以排除残留物对下次测定的干扰,同时延长预处理柱的寿命。
柱切换的方式按分析流动相与预处理流动相的流动方向相同与否可分为两种:正冲和反冲。反冲模式下,切换后分析流动相进入预处理柱的方向与预处理流动相的方向相反。反之即为正冲。切换方式、预处理时间与切换时间的长短,视被测组分在预处理柱上保留情况而定,其原则是力求分析时间短、分离度好、回收率高。
HPLC柱切换技术具有以下优点:①在线纯化,前处理简单,可实现自动化操作。样品只需简单处理即可直接进样测定。②富集待测组分,提高分析灵敏度,尤其适用于不易纯化、富集的极性较大的组分。③不需要内标物。由于进样体积较大,处理样品的全过程由仪器程序控制,可获得很高的精密度与重现性。
但此技术易引起峰展宽,减少峰展宽的办法有:①尽量用低溶剂强度的预处理流动相,高溶剂强度的分析流动相。②选用强保留能力的预处理填料。③必要时在预处理流动相中加入离子对试剂,以增加组分在预柱上的保留能力。
2.限进固定相萃取技术及与高效液相色谱的联用
限进填料(restricted-accessmaterial,RAM)也称为限制进入固定相,是一种新型在线样品预处理填料,它是在色谱填料的外表面覆盖一层限制蛋白质吸附的亲水层。该类填料有多种类型,但分离机制基本一致,均是在色谱填料的外表面进行亲水性修饰(biocompatible surfacemodification),阻止生物样品中大分子物质与固定相接触发生不可逆的变性和吸附,直接随流动相洗脱除去;小分子待测组分可穿过亲水层进入填料内孔,与微孔中的疏水性基团或离子交换基团作用而被保留在填料上,从而达到萃取、富集的目的。用水或缓冲液净化处理后,富集在限进填料柱上的待测成分被有机流动相洗脱至分析柱进行分离分析。限进填料颗粒示意图及分离纯化原理见图2-11。
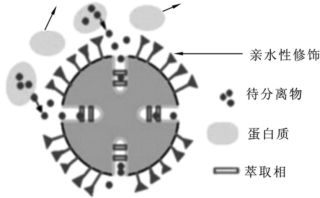
图2-11 限进填料颗粒示意图及分离纯化原理
限进填料柱既可以净化样品,又可以富集待测成分,操作简单,易于自动化。一经研制,很快就被用于体内药物分析的样品制备。RAM填料的种类很多,包括内表面反相填料(ISRP)、烷基二醇基硅胶填料(ADS)、键合相多孔硅胶填料(chrospher biomatrix)、半渗透表面填料(SPS)、蛋白质涂渍硅胶填料、混合功能填料(MFP)、屏蔽疏水相填料(SHP)等类型,其中烷基二醇基硅胶填料(ADS)是应用最多的一类限进填料。
限进填料可作为分析柱或预处理柱实现生物样品的自动化分析。其分离模式包括单柱模式和柱切换模式。在单柱模式中,限进填料柱既是萃取柱,又是分析柱,直接与检测器相连。先用极性较大的水性流动相将样品带到限进填料柱进行富集并除去蛋白质等大分子杂质,然后再用极性较小的流动相洗脱和分离待测组分。在柱切换模式中,限进填料柱只是作为预处理柱,分析柱可根据实验具体情况另外选择。在此模式下,预处理与分析的流路是不相同的,因此需要借助柱切换技术进行衔接,具体分析过程见图2-12。
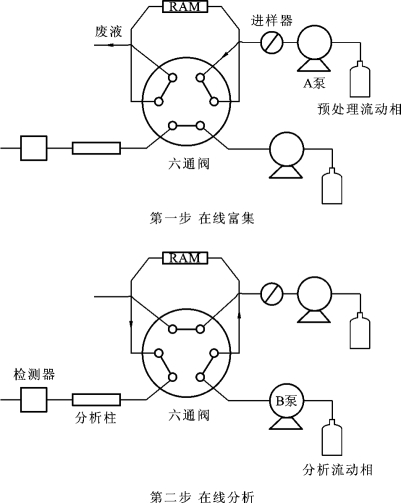
图2-12 RAM-HPLC在线分析示意图
如图2-12所示,在线富集状态下,大体积进样样品中的蛋白质等大分子杂质随预处理流动相除去,而小分子待测组分被富集在限进柱上;蛋白质完全除去后,将切换阀切换至在线分析状态,使限进柱与分析柱呈串联状态,被富集在限进柱上的待测成分随分析流动相洗脱至分析柱进行分离分析。分析完毕,将阀切换到初始状态,用预处理流动相冲洗限进柱一段时间,以便下次进样。在柱切换模式中,分析柱及分析流动相的组成的选择范围较单柱模式大了许多,因此该模式较单柱模式有较高的选择性和灵敏度。
限进固定相萃取技术有效地解决了生物样品中蛋白质等大分子物质对小分子待测组分测定的干扰,并可实现小分子分析物的在线富集,能与液相色谱在线联用,符合体内药物分析方法向高灵敏度、高选择性、高通量分析的发展需求,在生物样品中药物及其代谢物的分析中得到了越来越广泛的应用。
2.2.4.2 固相微萃取技术
固相微萃取技术(solid phasemicro extraction,SPME)是20世纪90年代发展起来的新型固相萃取技术,在一根熔融的石英纤维表面涂渍各种不同的色谱固定相或高分子吸附材料构成萃取头,待测组分利用吸附作用选择性地富集在萃取头上,然后转移至色谱进样系统,通过解吸附直接进行分析。该法无需有机溶剂,对检材的需要量少,操作简单、快速,并且集采样、萃取、浓缩、进样为一体,能与气相或液相色谱仪联用实现自动化。
1.固相微萃取装置
固相微萃取装置外形如一只微量进样器,由手柄[图2-13(a)]和萃取头或纤维头[图2-13(b)]两部分构成。萃取头是一根1 cm长,涂有不同吸附剂的熔融石英纤维,接在不锈钢丝上,外套不锈钢管(保护石英纤维不被折断)。萃取头可在钢管内伸缩,不锈钢管能穿透橡胶或塑料垫片进行取样或进样,手柄用于安装或固定萃取头。萃取头是固相微萃取的核心部分,有很多类型和规格,在实际应用中,主要根据待测组分的分子量大小、挥发性与极性来选择。一般小分子或挥发性强的组分常选厚膜(如100μm)萃取头,较大分子或半挥发性组分则选用薄膜(如7μm)萃取头;非极性组分选择非极性涂膜材料,极性组分选择涂有极性吸附剂的萃取头。除萃取头外,萃取时间、温度、萃取头插入的位置及样品瓶的大小等条件对分析结果的影响都很大,需严格控制。
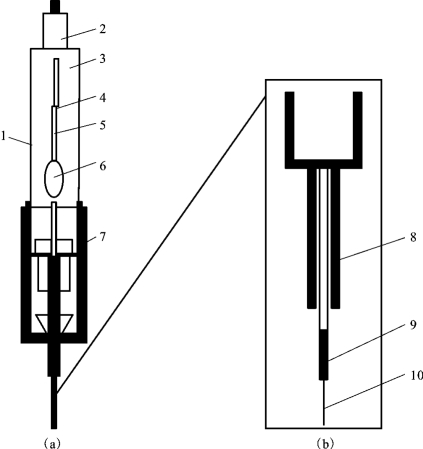
图2-13 固相微萃取装置示意图
1—手柄;2—压杆活塞;3—外套;4—压杆卡持螺钉;5—Z型槽;6—筒体视窗;
7—调节针头长度的定位器;8—穿刺隔垫针头;9—不锈钢针管;10—SPME萃取头
2.固相微萃取技术的操作过程
按照萃取方式的不同,固相微萃取可分为直接固相微萃取(direct-SPME)和顶空固相微萃取(headspace-SPME)。Headspace-SPME是将萃取头留在样品上部空间进行萃取,要求被萃取的物质有一定的挥发性;而direct-SPME是将萃取头直接插入样品溶液中进行萃取,主要用于难挥发物质的萃取,但不适合在强酸和强碱条件下操作,因为过于强烈的条件会使得萃取膜脱落。
SPME的操作过程分为萃取和解吸两个步骤(示意图见图2-14):
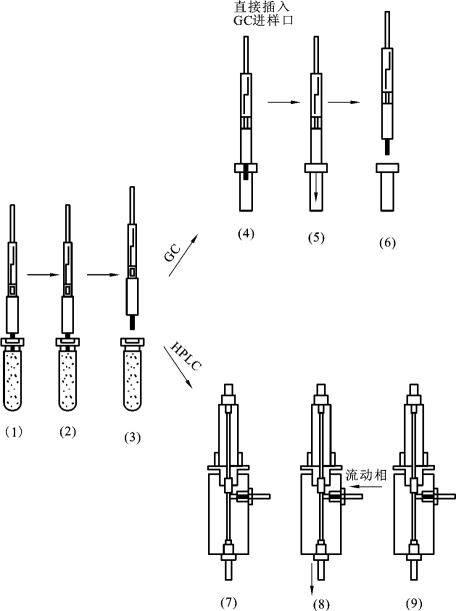
图2-14 固相微萃取的操作过程
(1)将固相微萃取不锈钢针管插入样品瓶。
(2)推出萃取头,浸入样品溶液或置于样品上部空间持续一段时间,让萃取头吸附待测成分,可适当加热或搅拌处理。萃取时间大约需2~30 min,以达到目标化合物吸附平衡为准。
(3)抽回萃取头,将针管拔出。
(4)供气相色谱分析时,是将SPME针管直接插入GC进样口。
(5)推手柄杆,伸出纤维头,待测组分通过进样口的高温热解吸脱离萃取头,被载气带入色谱柱。
(6)解吸完毕,抽回萃取头,从进样口移走针管。
(7)进行液相色谱分析时,将SPME针管插入SPME-HPLC接口的解吸池中。
(8)推动手柄伸出萃取头,切换六通阀,使流动相经过解吸池,将萃取头上的待测成分洗脱下来并带入色谱柱。
(9)撤走针管。
其中(1)~(3)为萃取过程;(4)~(6)为在气相色谱仪上的解吸过程;(7)~(9)为在液相色谱仪上的解吸过程。
2.2.4.3 微透析技术
微透析技术(microdialysis,MD)是以透析原理为基础的在体取样技术,它结合灌流取样和透析技术,能对存在于活体组织液中的内源性或外源性物质进行连续取样,并能与各种分析技术联用进行在线分析。微透析取样技术是利用小分子物质在半透膜上可随浓度梯度扩散,而大分子物质不能透过半透膜的原理设计的。其原理是将由半透膜制成的微透析探针植于需要取样的部位,用与取样部位细胞间液相似的生理溶液以1~5μL·min-1的速度进行持续灌注,膜内外的浓度差使体内小分子物质被灌注液带到体外进行分析。由于灌注液在透析管内不断地流动更新,因此跨膜浓度梯度始终存在,通过连续收集一定量的灌流液可测定取样部位待测组分的含量,从而实现对该组分在该部位的动态监测。大多数游离型药物为小分子物质,可被灌注液带出体外,而蛋白及与蛋白结合的药物为大分子化合物,不能透过半透膜,仍留在细胞外液中。因此,微透析技术与分析技术联用可直接检测各种组织细胞外液中具有药理活性的游离药物浓度,在神经科学、药代动力学、药物代谢、毒理和内分泌学等领域的应用越来越广泛。
1.微透析系统装置
微透析的装置包括微量灌流泵、微透析探针、样品收集器、连接管及配套设备组成(见图2-15)。
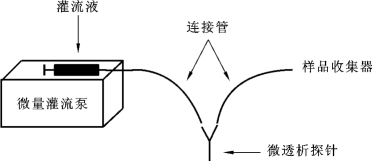
图2-15 微透析装置示意图
微透析探针是微透析装置中最关键的部件,通常是由一管式半透膜与不锈钢、石英或塑料毛细管构成双层管道,长度一般为1~10 cm。半透膜由再生纤维素、聚碳酸酯或聚丙烯腈制成,载留分子量5~10 KD不等。微透析探针的形状主要分为三种类型:线型、同轴型和并列分路型,其中同轴型使用最广泛。其结构及工作原理见图2-16。探针的选择应综合考虑待研究部位如脑或脊髓、待研究部位的空间大小、待测物质的分子量大小、待测物质在透析液内浓度的数量级等因素。在满足实验要求的情况下,尽量选用膜长较长(回收率高)、杆和膜径较细(组织损伤小)的探头。
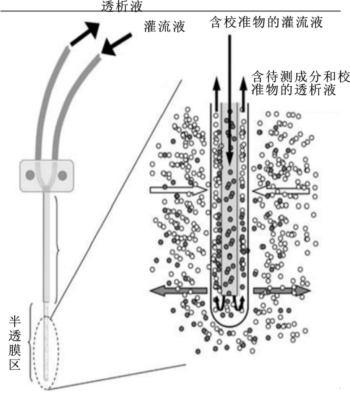
图2-16 同轴型微透析探针的结构及工作原理示意图
2.微透析技术的特点
微透析技术最大的优点是可以在不干扰体内正常生命过程的情况下进行在体(in vivo)、实时(real time)和在线(on line)取样,能真实地体现内源性物质或外源性物质在生物体内的动态变化,大大减少了实验动物的数量。采集的样品溶液中不含大分子化合物,前处理简单,可直接与分析检测方法在线联用。测得的游离型药物与药理作用直接相关。
微透析技术所得样品为动态透析液,组织细胞外液中的待测组分浓度需通过探针回收率进行校正。探针回收率可以采用体外校正和体内校正两种方法。在血液或胆汁微透析实验中,因为药物在其中扩散速度快,不影响探针的回收率,所以只进行体外校正即可;而在一些实体组织中,如脑、肝脏、肌肉等,通常由于取样部位的曲度增加导致扩散距离变长,扩散空间变小,使得药物在其中的扩散比通过半透膜慢,回收率下降,因此必须进行体内校正。一般体内校正的方法有内标法和反向透析法。微透析所取样品量少(μL级),且透析液通常会稀释待测成分,因此对联用分析技术的灵敏度、分析速度等要求较高。
3.应用实例
实例:应用微透析技术研究盐酸曲马多在小鼠额叶皮质细胞外液中的药动学
曲马多(tramadol)是一种人工合成的中枢镇痛药,通过激动μ-阿片受体和抑制中枢单胺能神经递质(如5-羟色胺、去甲肾上腺素等)的再摄取而发挥镇痛效应,常用于治疗中重度急慢性疼痛,是国家规定的二类精神药品。前期研究发现曲马多的镇痛效应与血浆药动学变化没有相关性,推测其原因可能是曲马多在血浆和作用靶点的浓度不同所造成的。采取微透析技术直接研究曲马多在小鼠额叶皮质细胞外液中的药动学过程,有助于解释这个现象。
(1)微透析采样与药动学实验:小鼠6只,25%氨基甲酸乙酯(1.8 g·kg-1,ip)麻醉后,将头部固定于脑立体定位仪上,用颅骨钻钻孔后将探针植入小鼠额叶皮质(frontal cortex,FrCx),以2μL·min-1的流速向探针内恒速灌注人工脑脊液。小鼠适应1h后,腹腔注射盐酸曲马多注射液(50 mg·kg-1),用微量自动收样器收集透析液(4℃,2μL·min-1),连续6 h。透析液离心(4℃,1500 r·min-1)5 min后进样,测定曲马多浓度。
(2)微透析探针回收率测定:采用反向透析法测定探针回收率。按上述微透析采样方法将探针埋入小鼠额叶皮质,取1.0mg·L-1、0.25mg·L-1和0.05mg·L-1 3个浓度的曲马多对照液以2μL·min-1速度向探针恒速灌注,预适应1h后,以12 min为收集样本时间段,连续收集5份透析样本(间隔时间为0.5 h),按下式计算探针回收率(R):
R(%)=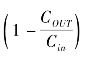 ×100%
×100%
式中:Cout为透析液中曲马多浓度,Cin为灌流液中曲马多浓度。
高、中、低3个浓度的探针回收率分别为18.20%、17.92%和18.48%。
(3)细胞外液中曲马多实际浓度的计算:小鼠额叶皮质细胞外液中曲马多时实际浓度(C实际)可按下式计算:
C实际=Cout/R。
(4)结果:小鼠额叶皮质细胞外液中曲马多的主要药动学参数t1/2β、t max、C max与其在血浆中的数据相比,变化较大。t1/2β明显延长,表明曲马多在脑内消除较血液中缓慢,若按血浆半衰期给药,则容易造成蓄积;t max显著延长(滞后),这可能是由于血脑屏障的影响所致;C max显著降低,这是因为微透析技术取样所得为细胞外液中曲马多的游离浓度,而血浆中为总浓度(游离型药物与结合型药物浓度之和),这也可以解释曲马多的镇痛效应与血浆药动学变化相关性不一致的现象。
【思考题】
1.血液样品包括哪些?其制备方法有何区别?请简述它们之间的关系。
2.去除蛋白质的常用方法有哪些?各有何特点?
3.简述液-液萃取的原理和特点。
4.如何根据待测物的理化性质、生物样品种类设计固相萃取方法?举例说明。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。















