1.热力学第二定律的经典表述
(ⅰ) Clausius表述(1850年):“不可能把热由低温物体传到高温物体,而不引起其他变化。”
(ⅱ) Kelvin表述(1851年):“不可能从单一热源吸热使之完全转变为功而不发生其他变化。”
(ⅲ) Ostwald表述:“第二类永动机是不可能造成的。”
所谓第二类永动机是指只从单一热源吸热就能完全转化为功的假想机器。它并不违反热力学第一定律,但却违背了热力学第二定律。否则的话,人类就可以单从大海或大气中吸热,不断地将其全部转变为功,之所以永远也做不到这一点,是由于没有一个比海水(或大气)的温度低而热容量又无限大的适当物体作为低温热源。
上述几种热力学第二定律的经典表述都是等价的、一致的。
2.熵及熵判据
(1)熵的定义

推广到多个热源的无限小循环过程,有

在极限情况下,应有

将式(2—68)积分有:

式(2—69)为计算熵变的基本公式和出发点。
(2)热力学第二定律的数学表达式——克劳修斯不等式
设有一不可逆循环可分两步组成,由A经不可逆过程I到状态B,然后再经过可逆过程R回到A态,整个循环仍为不可逆循环,如图2—9所示:


图2—9 由Ir及R组成的不可逆循环
即:
![]()
结合式(2—68) (2—69)和(2—70),合并得到:

对于无限小的过程, (2—71)式可写为:
![]()
式(2—71)和(2—72)即为Clausius不等式,即是热力学第二定律的数学表达式。
(3)熵增加原理(the Principle of Entropy Increasing)
由于隔离系统与环境不发生任何能量或物质的变换,
所以隔离系统中发生的过程必然是绝热过程,即δQ = δQa=0,于是式(2—71)和(2—72)对于隔离系统可写为:

又由于孤立系统不受环境的影响,所以在隔离系统中发生的不可逆过程必定是自发过程;而可逆过程进行得无限小、无限慢、无限接近平衡态,所以可逆过程就是平衡态。因而式(2—73)和式(2—74)可写为:

由此可以得出结论:“隔离系统内的自发过程总是朝着熵值增大的方向进行,直至平衡时熵达到该条件下的极大值。”这一事实称为熵增加原理。
应当注意,式(2—75)和式(2—76)即是平衡的熵判据(entropy criterion of equilibrium)。它表明:

在利用熵判据来判断过程的方向和限度时,必须是隔离系统。对于非隔离系统,通常可以将系统及受其影响的环境作为一个大隔离系统考虑,则有:

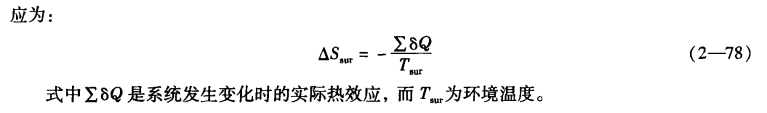
因而式(2—77)可以写成:
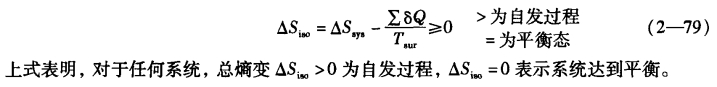
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。















