元素中的孪生兄弟
中子被发现后,很自然地就会出现这样一个问题:即有些原子的核中质子数相同而中子数不同。因质子数相同,这样的原子核电荷数相同;因中子数不同,这样的原子质量又不相同。这样的一组原子,由于核外电子的排布完全相同,因而其化学性质几乎一样,核电荷数相同,这些原子应占据元素周期表中的同一位置,故它们彼此间互称同位素,如 H
H H和
H和 H
H C、
C、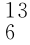 C和
C和 C
C O和
O和 O以及
O以及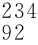 U
U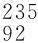 U和
U和 U等组原子,它们分属氢、碳、氧和铀元素,分别占据元素周期表中第1、6、8和92号的位置。从化学性质的角度看同位素原子之间,应当说比一母所生的孪生兄弟还要相像。同位素概念是1913年英国化学家索迪(1877—1956)首先提出的。19世纪末20世纪初,科学家们发现了铀、镭、钍等元素能够自发地放射出α、β和γ三种射线。后经研究证明,α粒子即氦原子核,β粒子即电子,而γ射线是高频率的电磁波。把这些具有放射性的元素称之为放射性元素,到1912年,发现的放射性元素已达近30种。这些放射性元素的发现,使元素周期表受到了挑战,因按照当时元素周期表的排法,质量不同的原子是应占据表中的不同位置的。索迪经过认真思索,放弃了按原子质量将元素在周期表中排位置的做法,创造性地提出将质量不同但核电荷数相同的原子排在元素周期表中同一位置,彼此互称同位素。鉴于索迪对于放射化学及同位素概念、性质的研究成果,他获得了1921年度的诺贝尔化学奖。此后英国化学家阿斯顿(1877—1945)利用自己发明的质谱议,又发现了许多非放射性的同位素,同位素现象已成为一种相当普遍的现象。1932年中子发现后,这才发现属于同位素的原子之间质量不同的原因,这时才将同位素定义为原子里具有相同质子数和不同中子数的同一类元素的原子之间的相互称谓。
U等组原子,它们分属氢、碳、氧和铀元素,分别占据元素周期表中第1、6、8和92号的位置。从化学性质的角度看同位素原子之间,应当说比一母所生的孪生兄弟还要相像。同位素概念是1913年英国化学家索迪(1877—1956)首先提出的。19世纪末20世纪初,科学家们发现了铀、镭、钍等元素能够自发地放射出α、β和γ三种射线。后经研究证明,α粒子即氦原子核,β粒子即电子,而γ射线是高频率的电磁波。把这些具有放射性的元素称之为放射性元素,到1912年,发现的放射性元素已达近30种。这些放射性元素的发现,使元素周期表受到了挑战,因按照当时元素周期表的排法,质量不同的原子是应占据表中的不同位置的。索迪经过认真思索,放弃了按原子质量将元素在周期表中排位置的做法,创造性地提出将质量不同但核电荷数相同的原子排在元素周期表中同一位置,彼此互称同位素。鉴于索迪对于放射化学及同位素概念、性质的研究成果,他获得了1921年度的诺贝尔化学奖。此后英国化学家阿斯顿(1877—1945)利用自己发明的质谱议,又发现了许多非放射性的同位素,同位素现象已成为一种相当普遍的现象。1932年中子发现后,这才发现属于同位素的原子之间质量不同的原因,这时才将同位素定义为原子里具有相同质子数和不同中子数的同一类元素的原子之间的相互称谓。
现已发现,除氟、钠、铝等21种元素外,自然界中其他的元素都有着两种或更多种的同位素。以原子百分数来表示地壳中各同位素的相对含量称之同位素的丰度,一种元素各同位素的丰度一般为固定值,如氧元素的3种同位素16O、17O和18O的丰度分别为99.76%、0.04%和0.20%,而氯元素的两种同位素的丰度分别为35Cl75.53%、37Cl24.47%。根据同位素的丰度,可计算该元素的平均原子量;反之,又可从平均原子量和各同位素的质量数,求各同位素的丰度。
同位素在理论研究和实用上都有着广泛应用,如可用来研究化学反应机理:以有机化学中的酯化反应为例,乙酸和乙醇通过分子间脱水可生成乙酸乙酯:

在这一反应中,究竟是哪种反应物脱去羟基(-OH),哪种反应物脱去氢(-H),从化学反应方程式是找不到答案的。为了回答这种问题,可采用同位素作示踪原子,如采用含氧-18的乙醇和普通的乙酸来发生酯化反应:
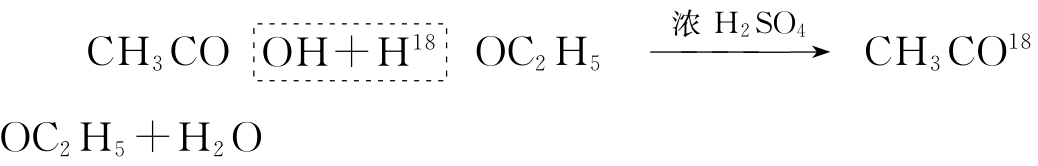
从所生成的酯分子中含有18O原子,而水是普通水可知,反应是“酸脱羟基醇脱氢”;碳-14是碳元素中一种具有放射性的同位素,由于其放射性,约每隔5568年,它的质量就会减少一半,这一时间叫14C的“半衰期”。地球上的生物,在其活着时候,总在不停地从外界吸入碳元素,其中14C也按比例地摄入体内。但当动植物死亡后,与外界停止了物质交换,而已进入体内的14C同位素,由于不断放出射线而衰变,含量将按死亡后的时间长短而有不同的减少。因此,只需测一下出土的古生物体内的14C含量,便可知它的生活年代,由于14C的这一功能,因此得名为大自然的“钟表”;钴元素有多种同位素,其中60Co有较强的放射性,17克60Co的放射能力与1千克的Ra(镭)相当。60Co是恶性肿瘤的“克星”,它放出的射线因能破坏癌细胞的快速繁殖,因而可抑制癌症的发展,医学上将采用60Co的射线来治疗癌症叫做“放疗”,放疗是治疗癌症的重要手段之一。此外,60Co的放射性还有其他多种应用,如在农业上常用60Co辐射来育种,刺激增产;在食品上可用其辐射来保鲜、防腐;在工业用于无损探伤、厚度和密度测定及生产流水线的自动控制。从以上所举的同位素应用的例子,即可看出同位素的广泛应用。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。















