1.元素是什么
元素是由同种原子构成的物质。例如,铋的金属块只含有铋原子。如果把那块金属块锯成两半,或者用铁锤将其打碎,或者用锉刀将其弄成粉末,但是无论如何,它还是铋。将金属块加热,它会成为液体。如果再提高温度,液体就会沸腾,成为气体而蒸发。但铋还是铋,不会成为其他元素。

铋的块块
大部分的原子会跟其他原子结合而成为分子。有些同种元素的原子会互相结合而成为分子,例如,两个氧原子结合成一个氧分子。还有些元素的原子会跟其他元素的一个或多个原子结合成一个分子。不过这种分子已经不是元素了,而被称为化合物。
化合物有一个特殊的性质,就是当不同种类的元素结合后,形成的化合物不具备原来元素的特征,也就是看不出化合物里含有哪些元素了。例如,氢是非常易燃的气体,与氧结合会成为水。大家都知道氢气与水的性质有多大差别吧?再如氯和钠,本来都是有毒的物质,但是两者结合以后竟然就是我们日常食用的盐!
糖分子的构造
和盐一样,糖也是我们所熟悉的化合物。但是糖分子比较容易被破坏。将糖放入蒸馏瓶,只要稍微一加热,糖分子便开始分解了。瓶底出现了黑黑的物质,这表明糖分子里含有碳元素。构成糖的其他元素会重新结合再蒸发,在瓶壁上凝结成无色液体流入另一个瓶子,这种无色液体就是水。再将这些水装入电气分解装置,通上电,水分子就会被分解成氧气和氢气飞散出去。

把糖加热的Seaborg(图)
由此可知,构成糖的是碳、氧和氢三种元素。一个糖分子里含有12个碳原子,22个氢原子和11个氧原子,因此糖的化学式是C12
H22O11。
在一个蒸馏瓶里,足有数百万兆个糖分子被加热。我们可以想象出这些分子到底发生了什么变化。不过在想象之前,最好还是做个模型。

糖分子的模型(图)
做模型的时候,碳原子、氢原子和氧原子分别用黑色珠、白色珠和灰色珠来表示。珠与珠之间的连接表示化学键,就是结合各原子的手臂。
当然,我们做这个模型只是为了表示原子在分子里的排列形式,它并不能代表糖分子的真正形态。事实上,糖分子也并不是这样的。
把糖加热,糖分子就会分解。12个碳原子沉入瓶底,11个水分子变成水蒸气飞走。这个现象可以用化学方程式表示: 11H2O。换句话说,就是一个糖分子被分解成了12个碳原子和11个水分子,再把水分子分解,就成了22个氢原子和11个氧原子。
11H2O。换句话说,就是一个糖分子被分解成了12个碳原子和11个水分子,再把水分子分解,就成了22个氢原子和11个氧原子。
所以每一个糖分子都可以分解成12个碳原子,11个氢分子(H2)和5.5氧分子(O2)。用化学方程式表示这个反应时,为了使所有的数字成为整数,就将原来的数字加倍,写成22H2O→22H2+11O2。
氧化汞的加热分解
下面我们再来做一个实验。这次加热的是一种叫做氧化汞的红色粉末。从氧化汞这个名字就可以知道它的构成元素是氧和汞(水银)。
将氧化汞放进蒸馏瓶内加热,氧化汞的颜色就会改变,然后在瓶内沸腾并开始蒸发。
蒸发的气体会从瓶颈飞出,随着温度的降低,气体就会凝结成汞,滴落到烧杯里面。
从蒸馏瓶口冒出的还有氧气,但是氧气是无色的气体,因此它从瓶口飞出的时候,我们是看不见的。但是我们可以通过一定的方法证明瓶口有氧气冒出:如果你把竹筷的尖端点燃,接着把火焰熄灭,并将它靠近瓶口,它会再度燃起来。这样就证明了。

氧化汞的加热分解
如此,我们知道,那些红色粉末是由发亮的液态金属汞和氧气构成的,氧气有一个性质,就是可以使快要熄灭的炭火再度燃起来。
氧化汞的分子只由两个原子构成,比糖分子简单得多。一个是汞(Hg)原子,另一个是氧原子,所以氧化汞的化学式是HgO。
将氧化汞HgO的分子画成图,就会像下页图那样:白圈和黑圈分别代表氧原子和汞原子。同样也可以用下图表示实验过程,在加热的过程中,随着温度不断升高,氧化汞的分子飞来飞去,在烧瓶壁上乱撞,终于被破坏分解成汞原子和氧分子,被分解出的汞原子从瓶口飞出去,遇到瓶外的冷空气就凝结成液滴落入烧杯,而氧原子则成对结合成氧分子飞出瓶外。
用化学方程式表示这一过程即HgO→Hg+O。
氧原子必然会成对结合成氧分子,所以应该用O2表示。因此需要把氧化汞写成两个分子2HgO 2Hg+O2。也就是说,两个氧化汞分子被分解成两个汞原子和一个氧分子(两个氧原子)。
2Hg+O2。也就是说,两个氧化汞分子被分解成两个汞原子和一个氧分子(两个氧原子)。
所以跟糖一样,氧化汞也是化合物。所谓化合物就是由不同元素组成的物质。
元素和化合物
现在让我们回头看看,开始谈到的那五支试管里装的都是什么。管内的五种无色液体也是简单的化合物。只有第五支是两种化合物混合起来的液体。五种液体都是由气体或液体和固体结合而成的。
它们的真实面目是:
①水(氢和氧)
②丙酮(氢、氧、碳)———能燃烧
③四氯化碳(氯、碳)———能使火种熄灭
④硝酸(氢、氧、氮)———与铜板起化学反应
⑤钴60的溶液(水,具有放射性钴的硝酸氯)———可以使盖氏计数器出声。
构成以上五种液体的元素有六种。其中氢和碳结合起来可以构成几万种不同的化合物,如烷烃、石油、塑料。我们将只含有氢和碳的化合物通称为碳氢化合物。而各碳氢化合物间的区别就是由分子中碳和氢的数量以及它们的连接状态决定的。
分子中碳和氢的数量在化合物的化学式上都得到了体现。例如:
CH4 甲烷(沼气)
C2H2 乙炔
C2H4 乙烯
C10H18 十氢化萘
原子的重量
任何化合物要能被肉眼看到或是称其重量,就必须有几千兆个分子集中在一起。这是因为碳原子极小,直径只有一亿分之几厘米。原子里面的原子核还要小得多,直径还不到原子的万分之一。
如果将一个碳原子比喻成足球场那么大,那么电子就是观众座位上飞来飞去的苍蝇,而原子核就相当于放在球场中央的足球。原子核的重量比那些苍蝇的总重量还要重几千倍。所以宇宙中所有物质99.9%的重量都集中在原子核,原子内部大部分空间都是空的。
用气体来讨论原子的重量似乎比较容易了解,因为体积相同的气体所包含的分子数量也是相同的。
在天平两边的盘上各放置一升容量的瓶子,由于两边的瓶子都装有一升的空气,所以天平会平衡。
如果从一个瓶子的下面慢慢放入氢气,使氢气将空气赶走,逐渐占满瓶子。这样,天平就会失去平衡,氢气这边会上浮,而空气那边会下沉。这表示一升的空气比一升的氢气重。
将这个事实换算成一个一个的分子,需要很长的运算。两边的瓶子里到底各有多少个分子呢?这是一个非常大的数字,原来一升气体中含有2.687×1022个分子。
如果要计算原子的数目,那么就必须将分子的数目加倍。因为自由气体的氮、氧(空气的主要成分)和氢的分子都是由两个原子结合而成的。
比较同体积的不同金属,它们的重量就可以反映出各自原子的重量。譬如说将镁、铁、铅、铀切成同样的体积,并吊在强度相当的弹簧上,从它们下垂的高度就可以看出各自的重量,即低的重,高的轻。由此知道它们的重量是不同的,换句话说它们原子的重量不相同。
由左至右,同体积的镁、铁、铅、铀,把它们用同样的弹簧吊起。
以上只不过暗示了原子大约的重量,并不能准确地表示出重量的比率。测量固体的原子重量比气体困难好多,和气体不同,同样体积的固体,它们含有的原子数量却并不相同。对于同样体积的固体,原子间靠得越近,原子数量就越多;原子排列得越松,原子数目就越少。因此,固体的种类不一样,同样体积里面的原子数量当然也不一样。
元素周期表上还记有各元素的原子量。所谓原子量,就是将碳12的原子重量定为12,并以此为基准来确定的各元素的原子重量。铀的原子量大约是238,铅207,铁56,镁24,氢只有1。等于说铀原子的重量约是氢的238倍。从元素周期表上可以得到很多信息,这就是其中之一。
元素和原子核
元素周期表还可以说明原子的构造。
从头一个元素氢开始,氢的原子核内只有一个质子。质子也是所有原子核的基本粒子。
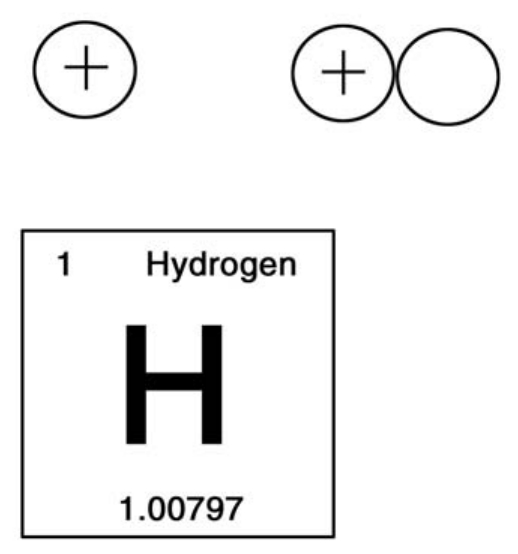
宇宙中的物体都是由一百多种元素中的一种或者数种构成的。如果把物质比喻成建筑,那么元素就是砖块。元素都是由质子、中子和电子这三种基本粒子构成的。
不同的元素有不同的性质,这是因为不同的元素所包含的质子、中子和电子的数量不同。
氢原子的原子核内只含有一个质子,质子带有一个单位的正电荷,它拥有氢原子99.9%的重量。
因为氢的原子核(质子)拥有一个单位的电荷,所以在元素周期表上,氢原子的原子序数是1。在图上我们用“8”来代表它。
如果给原子核加上一个粒子会怎么样呢?假定这个粒子跟质子重量相同,但是并不带有电荷。那么原子核的重量就会变成2,但是电荷没有变,还是只带有一个电荷。
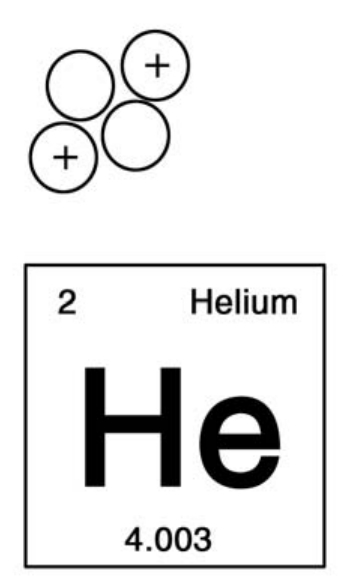
跟质子重量相同,但是并不带有电荷的粒子叫做中子。除了氢原子,所有元素的原子核里都含有中子。
如果再加上一个质子和中子,那么原来的粒子就变成了一个复合粒子,这个复合粒子的重量为4,电荷为2。
如果你看一下元素周期表,你就会发现,我们刚刚提到的复合粒子实际上就是氦的原子核,氦的原子序数为2,质量数为4。“质量数”是原子核中的质子和中子的合计重量,是表示元素原子量的一个整数。
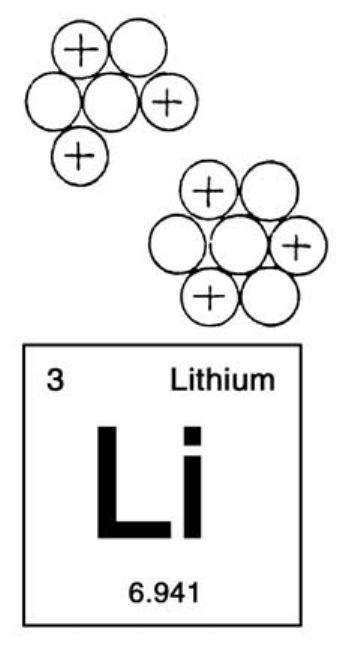
如果给氦的原子核再加上一个质子和一个中子,那就变成了锂6元素的原子核,它的电荷数为3,质量数为6。
锂是银白色的轻金属。它的原子核有两种,锂6和锂7,锂7比锂6多一个中子。
天然的锂中绝大多数都是锂7,约占92%。锂7的重量是7.02,质量数是7。
剩下的8%是锂6。6.941表示的是锂的自然存量的平均原子量。
如此这般再增加质子和中子的话,原子核的重量也就发生了改变,也就随之造出了许多新的元素。
原子的构造
只有原子核还不能构成原子。要成为原子必须在原子核周围加上电子,电子的数量要与质子数相同。
电子的重量比质子小得多,它带一个单位的负电荷,与质子的电荷量相同。所以如果质子的数量跟电子的数量相同,那么正和负的电荷就会达到平衡,从而显示电中性。
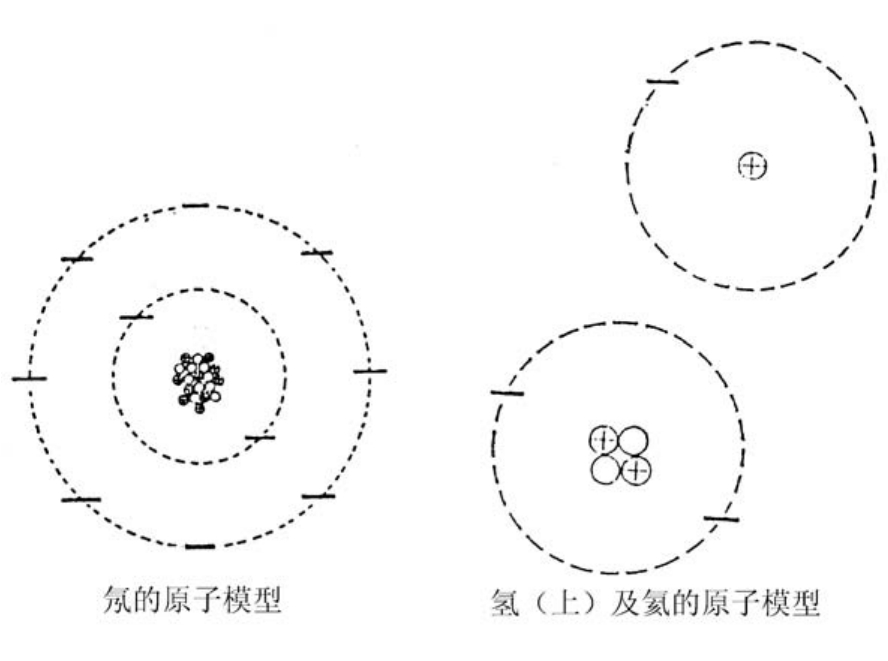
就是这样,氢原子是由一个质子和一个电子构成的,电子是在质子周围旋转的粒子。
在下图中我们用负号代表电子。这样表示只是为了方便,但是并不怎么正确。假如质子的大小就如图中所示的那样,那么电子就在以质子为中心,半径为一公里的圆上旋转。
氦原子有两个质子,所以需要两个电子来平衡电荷。
原子有一种非常特殊的性质,那就是,一个轨道上(层)只允许一定数量的电子存在。
与原子核最近的层至多可容纳两个电子,第三个电子就只好进入第二层。第二层至多容纳八个电子。
因此,跟氦原子一样,锂原子的第一层上只有两个电子,而最后一个电子孤零零地在第二层上。
电子旋转的轨道实际上是一个三度空间,不同于地球围绕太阳运动的平面轨道,而是在一个球面层上旋转。电子旋转的轨道也不似图中所画的那样清晰,而是模糊并有幅度的。
我们再来看排在锂之后的元素吧。如果不断地增加第二个电子轨道(层)上的电子,那么就会得到排在第十的氖,氖的原子核内有10个质子,周围有10个电子。
氖原子的第二个轨道上有8个电子,第一个轨道上有2个电子。由此可见,氖原子的轨道已经被电子占满了,这一点和氦是一样的,它们的电子轨道中都无空位,也没有多余的电子。这种原子,如氦、氖可以称为饱和的原子。
氖的后面是钠,有11个质子和11个电子,它的第三轨道上只有一个电子。
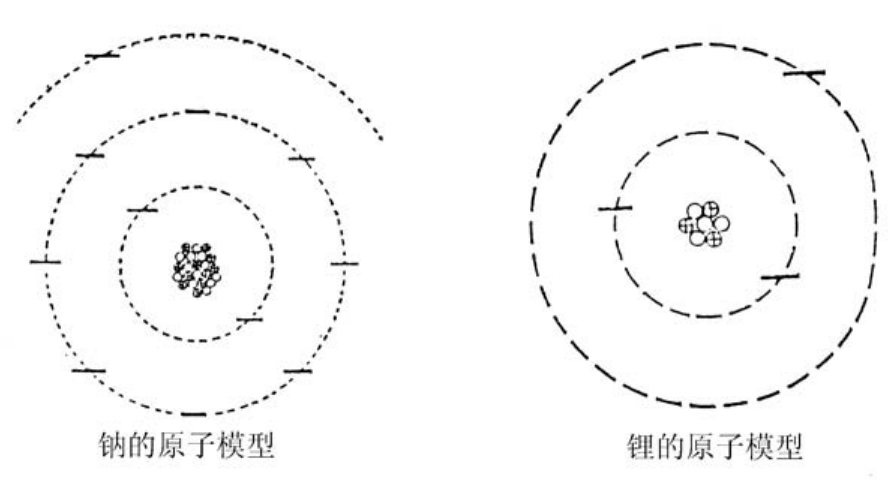
在元素周期表上,钠和锂排在同一列,位于锂的下方,这是因为它们之间有一个共同点,就是最外层轨道上都只有一个电子。
现在,对于为什么要制作元素周期表,相信大家已经有了一定的了解了。如果将元素按原子序数来排列,那么某些具有特殊性质的元素就会周期性地反复出现。元素的这种性质叫做“周期律”。
有一点非常重要,那就是原子核中每多一个质子,核外也需要多一个电子,这样才能保持原子本身的电荷呈中性。因此原子核中的质子数决定核外的电子数。原子的电荷呈现中性,它们的质子与电子的数目就一定要相等。
元素的化学性质和同位素
原子的化学性质由两个因素决定,一是原子核周围的电子数量,二是这些电子在轨道中的排列。
所谓“化学性质”,就是元素与哪些元素可以结合,与哪些元素不能结合,以及元素跟其他元素如何结合,为何不能结合。
详细一点说,某种元素会跟哪几种元素结合?结合的难易程度如何?结合后再把它分离有多困难(稳定性)?元素的这种性质与质子和中子是没有直接关系的,真正决定元素化学性质的是原子中的电子数以及电子的排列。
虽然元素的化学性质与中子数无关,但是如果原子核中的中子数发生改变,就会生成元素的各种同位素。
同位素(Isotope),源自希腊语的“同”和“场所”。前面我们已经提到了天然锂有两种同位素,锂6和锂7。一种元素的同位素含有的质子和电子数都是相同的,因此在元素周期表上与该元素占据同样的位置。
当然,同位素之间也是存在差异的,那就是原子量(重量)不同和是否有放射能。
要想得到元素的同位素,只需要改变原子核中的中子数就可以了,因为中子不带电荷,因此整个原子核的电荷数并不会改变,电子的数量也就没有必要改变了,这样,原子本身的化学性质也不会变。改变的只有原子的重量。氢有三种同位素:普通氢、重氢和超重氢。普通氢的原子核内只有一个质子;重氢多一个中子,所以它的重量大约是2;超重氢具有放射性,原子核里有一个质子和两个中子,重量约为3。
以铀元素为例,大部分的天然铀都是铀238,原子核中有92个质子和146个中子。另外,铀235也是大家所熟悉的同位素,它的原子核分裂会释放出大量的能量。铀235的质子数也是92,但中子数只有143,比铀238少3个。因此铀235比铀238轻3个单位。
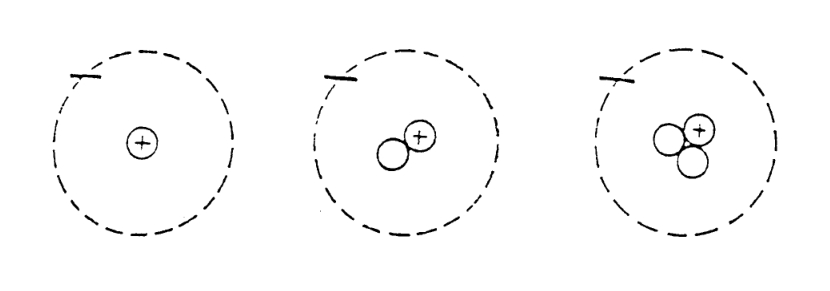
氢同位素的原子模型(依次为普通氢、重氢、超重氢)
确定了同位素的存在之后,前面给元素下的定义,即元素是由同一种类的原子所构成的物质,就显得不是很准确了。应该说,元素是由同原子序数———原子核中质子数相同———的原子所构成的物质才对。
原子核的构造并非如纸上所写的二度空间(平面),而是三度空间(立体)。有些原子核的形状类似篮球,但是比较重的原子核,其形状就会类似橄榄球,比类似篮球的球形要长一些,比如铀的原子核。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。
















