碳氧化合物
我们平时所指的碳氧化合物,无非就是一氧化碳和二氧化碳。其中一氧化碳主要在内然发动机中产生,是由于空气不足或其他原因造成不完全燃烧时,所产生的一种无色、无味的气体。CO吸入人体后,非常容易和血液中的血红蛋白结合,它的亲和力是氧的300倍。因此,肺里的血红蛋白不与氧结合而与CO结合,致使人体缺氧,引起头痛、头晕、呕吐等中毒症状,严重是造成死亡。
世界工业化进程引起的能源大量消耗,导致大气CO2的剧增。其中30%约来自汽车排气。CO2为无色无毒气体,对人体无直接危害,但大气中的CO2大幅度增加,因其对红外热辐射的吸收而形成的温室效应,会使全球气温上升、南北极冰层溶化,海平面上升,大陆腹地沙漠趋势加剧,是人类和动植物赖以生存的生态环境遭到破坏。
一、CO的性质
一氧化碳是一种无色无味,密度比空气小的气体。它可以燃烧,发出淡蓝色的火焰,所以一氧化碳可以用作燃料。此外一氧化碳可以用作还原剂来冶炼金属。
1.CO的化学性质。一氧化碳分子中碳元素的化合价是十2,能进一步被氧比成+4价,从而使一氧化碳具有可燃性和还原性,一氧化碳能够在空气中或氧气中燃烧,生成二氧化碳:
C+CO——CO2
高温时能将许多金属氧化物还原成金属单质,因此常用于金属的冶炼。如:将黑色的氧化铜还原成红色的金属铜,将氧化锌还原成金属锌:
CO+CuO——Cu+CO2
CO+ZnO——Zn+CO2
一氧化碳还有一个重要性质:在加热和加压的条件下,它能和一些金属单质发生反应,主成分子化合物。如Ni(CO)4(四羰基镍)、Fe(CO)5(五羰基铁)等,这些物质都不稳定,加热时立即分解成相应的金属和一氧化碳,这是提纯金属和制得纯一氧化碳的方法之一。
2.CO的毒性。一氧化碳是大气中常见的污染物之一,俗称煤气,无色、无臭、无味、无刺激性气体,有剧毒,气体密度为0.967千克/立方米,溶点-199℃,沸点-191℃,微溶于水,不易被液化和固化。
一氧化碳主要来源是含碳物不完全燃烧的产物。据估计,全世界每年排入空气中一氧化碳量达3.6亿吨以上,占总量气量1/3以上。工业炉窑和民用锅炉、炉灶以及内燃机、汽车废气是一氧化碳的主要污染源。其中汽车排出的一氧化碳占55%。
一氧化碳是通过呼吸道进入人体而引起中毒。一氧化碳在12.5毫克/立方米时对人可引起慢性中毒;在37.5毫克/立方米时人在4~6小时内中毒;当达到125毫克/立方米时人立即头痛、恶心;在150毫克/立方米时人在1小时内中毒;12500毫克/立方米时人立即死亡。浓度低于125毫克/立方米时对农作物影响不大。
一氧化碳轻度中毒,有头痛、眩晕、心悸、恶心、呕吐、四肢无力等症状,甚至会出现短暂的昏厥。中度中毒除轻度中毒症状加重外,并有昏迷或虚脱的现象发生,皮肤和粘膜呈樱桃红色。严重中毒可发生突然昏倒,昏迷可持续数小时,甚至几昼夜。常并发脑水肿、肺水肿、心肌损害、心律紊乱或传导阻滞、高热或惊厥,以至死亡。急性中毒幸免于死亡者,尚有患者留有各种神经系统后遗症状。
一氧化碳中毒主要原因是当一氧化碳被吸进肺里,跟血液里的血红蛋白结合成稳定的碳氧血红蛋白,随血流遍布于全身。一氧化碳与血红蛋白的结合力要比氧与血红蛋白的结合力大200~300倍,而碳氧血红蛋白的解离却比氧合血红蛋白缓慢3600倍。因此,一氧化碳一经吸入,即与氧争夺血红蛋白,同时,由于碳氧血红蛋白的存在,妨碍氧合血红蛋白的合成和正常解离,使血液的带氧功能发生障碍,造成机体急性缺氧,严重失导致窒息死亡。
二、CO2的性质
二氧化碳是一种无色、密度比空气大且易溶于水的气体,在日常生活中它的用途很大,比如说我们灭火实用的泡沫灭火器就是利用二氧化碳不支持燃烧而且密度比空气大的性质。一般条件下,二氧化碳不支持燃烧且比空气重,将二氧化碳覆盖在燃着的物体表面,可使物体跟空气隔绝而停止燃烧,因此二氧化碳可用来灭火,是常用的灭火剂)。
在化学工业上,二氧化碳是一种重要的原料,大量用于工业生产,例如纯碱(Na2CO3)、小苏打(NaHCO3)、尿素[CO(NH2)2]、碳酸氢铵(NH4HCO3)、颜料铅白[Pb(OH)2·2PbCO3]等。在轻工业上,生产碳酸饮料、啤酒、汽水等都需要二氧化碳。在现代化仓库里常充入二氧化碳,防止粮食虫蛀和蔬菜腐烂,延长保存期。固态的二氧化碳即“干冰”,主要用作致冷剂,用飞机在高空喷撒“干冰”,可以使空气中水蒸气冷凝,形成人工降雨;在实验室里,“干冰”与乙醚等易挥发液体混合,可以提供-77℃左右的低温浴。“干冰”还可以做食品速冻保鲜剂。在农业上,温室里直接施用二氧化碳作肥料,利用植物根部吸收二氧化碳,可以增进植物的光合作用,促进农作物生长,增加产量。在自然界,二氧化碳保证了绿色植物进行光合作用和海洋中浮游植物呼吸的需要。
1.二氧化碳的化学性质。二氧化碳不能供给呼吸。当空气里二氧化碳的体积分数达到1%时,对人就有害处;当达到4%~5%时,会使人感到气喘、头痛、眩晕;达到10时,能使人不省人事,呼吸逐渐停止,以致死亡。所以一些久未开启的菜窖、干涸的深井和深洞底部,二氧化碳的量比较大,在进入这些地方前,必须先做做一个灯火试验,如灯火熄灭或燃烧得不旺,说明二氧化碳较多,人就不要进去,只有这样才能保证人身安全。
还有就是二氧化碳可以使澄清的石灰水变混浊,这不仅可以检验二氧化碳的存在;而且还可以揭开我们心中的许多谜团,比如说原来我们见到的为什么很清澈的一杯水,一会儿就变成牛奶状的了,这就是因为有二氧化碳在作怪。
二氧化碳表现的化学性质其实非常常见。CO2能溶于水并与水反应生成碳酸,使紫色石蕊试液变成红色:
CO2十H2O=H2CO3
H2CO3又是二种不稳定的酸,易分解重新释放出CO2:
H2CO3=CO2↑+H2O
CO2为酸性氧化物,易与碱性氧化物反应生成相应的碳酸盐:
CO2+Na2O=Na2CO3
CO2与碱反应生成相应的碳酸盐和水:
CO2+Ba(OH)2=BaCO3↓+H2O
CO2与碱作用还可能生成酸式碳酸盐:
2CO2+Ca(OH)2=Ca(HCO3)2
CO2+NH3+HO=NH4HCO3
CO2中碳为+4价,可被某些强还原剂还原,如与赤热的碳作用还原成CO,CO2与活泼金属作用被还原成碳:
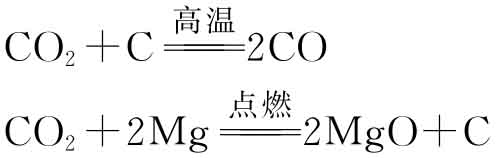
绿色植物的光合作用,把CO2和H2O合成碳水化合物:

2.二氧化碳的温室作用。一是温室有两个特点:温度较室外高,二是不散热。生活中我们可以见到的玻璃育花房和蔬菜大棚就是典型的温室。使用玻璃或透明塑料薄膜来做温室,是让太阳光能够直接照射进温室,加热室内空气,而玻璃或透明塑料薄膜又可以不让室内的热空气向外散发,使室内的温度保持高于外界的状态,以提供有利于植物快速生长的条件。
由环境污染引起的温室效应是指地球表面变热的现象。受到温室效应和周期性涨潮的双重影响,西太平洋图瓦卢的大部分地方,即将被海水淹没,包括首都机场及部分住宅和办公室。
由于温室效应会导致南北冰雪融化,水平线上升,直接威胁图瓦卢,所以该国在国际环保会议上一向敢言。前总统佩鲁曾声称图瓦卢是“地球暖化的得一个受害者”。温室效应可使史前致命病毒威胁人类。
纽约锡近拉丘兹大学的科学家在最新的一期《科学家杂志》中指出,早前他们发现一种植物病毒TOMV,由于该病毒在大气中广泛传播,推断在北极冰层也有其踪迹。于是研究员抽取4块年龄由500~14万年的冰块,结果在冰层中发现TOMV病毒。研究员指该病毒表层被坚固的蛋白质包围,因此可在逆境生存。
这项新发现令研究员相信,一系列的流行感冒,小儿麻痹症和天花等疫症病毒可能藏在冰块深处,目前人类对原始病毒没有抵抗能力,当全球气温上升令冰层融化时,这些埋藏在冰层千年或更长的病毒可能复活,形成疫症。科学家表示,虽然他们不知道这些病毒的生存希望,或者再次适应地球环境的机会,但不能抹灭病毒卷土重来的可能性。
科学家预测:如果地球表面温度的升高按现在的速度继续发展,到2050年全球温度将上升2℃~4℃,南北极地冰山将大幅度融化,导致海平面大大上升,一些岛屿国家和沿海城市将淹于水中,其中包括几个著名的国际大城市:纽约,上海,东京和悉尼。
温室效应是怎么来的?我们能做什么?
温室效应主要是由于现代化工业社会过多燃烧煤炭、石油和天然气,这些燃料燃烧后放出大量的二氧化碳气体进入大气造成的。
二氧化碳气体具有吸热和隔热的功能。它在大气中增多的结果是形成一种无形的玻璃罩,使太阳辐射到地球上的热量无法向外层空间发散,其结果是地球表面变热起来。因此,二氧化碳也被称为温室气体。
人类活动和大自然还排放其他温室气体,它们是:氯氟烃(CFCl3)、甲烷、低空臭氧、和氮氧化物气体、地球上可以吸收大量二氧化碳的是海洋中的浮游生物和陆地上的森林,尤其是热带雨林。
为减少大气中过多的二氧化碳,一方面需要人们尽量节约用电(因为发电烧煤),少开汽车。另一方面保护好森林和海洋,比如不乱砍滥伐森林,不让海洋受到污染以保护浮游生物的生存。我们还可以通过植树造林,减少使用一次性方便木筷,节约纸张(造纸用木材),不践踏草坪等等行动来保护绿色植物,使它们多吸收二氧化碳来帮助减缓温室效应。有的科学家建议把二氧化碳注入地下来防止地球继续变暖,这种想法能否实现与实施还有待与我们的进一步努力。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。













