原子学说的胜利
出现在地球上的大多数物质都不是元素,但可以分解成组成它们的各种元素。由几种元素结合在一起构成的物质被称为化合物(compounds,源自意为“放在一起”的拉丁语单词)。
化学家与日俱增的兴趣,是试图确定每一种特定化合物中可能存在的每种元素的数量究竟有多少。从1794年开始,法国化学家普鲁斯特(Joseph Louis Proust,1754—1826)进行该项研究工作,并获得了关键性发现。普鲁斯特一开始将一种目前被称为碳酸铜的化合物的纯样品分解成3种元素,即它的3个组分:铜、碳和氧。1799年,他发现:每次操作时,无论他准备多少样品,每生成5份铜(以重量计算)总是会生成4份氧和1份碳。如果他在合成碳酸铜时多混入一些铜,那么,多加的铜仍会剩下。如果他少加一些铜,则只有与之成比例的那部分碳和氧与它化合生成碳酸铜,多余的碳和氧都会剩下。
普鲁斯特指出,这种现象在他对其他许多化合物进行研究时也被证实,即组成化合物的各种元素总是成一定比例的。这种规律被称为定比定律。
定比定律为原子学说提供了有力的支持。例如:假定碳酸铜由一些小的原子团组成(这些小的原子团被称为分子,源自拉丁语,意为“一小团”),每个小团由1个铜原子、1个碳原子和3个氧原子组成。再假定3个氧原子加在一起的重量等于碳原子重量的4倍,而铜原子的重量又等于碳原子重量的5倍。如果这种化合物的每个分子都按这种方式组合而成,那么,碳酸铜将总是由5份铜、4份氧和1份碳组成。
那么在分子中是否可能包含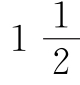 个铜原子,或
个铜原子,或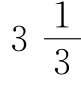 个氧原子,或只含5/6个碳原子,即不同碳酸铜样品的三种物质含量比例是否可以变化呢?事实上这个比例是不变的。这不仅支持了原子的观点,而且符合德谟克利特提出的原子不可分割的说法。原先的说法像是原封未动,或者说就像什么也没有发现。
个氧原子,或只含5/6个碳原子,即不同碳酸铜样品的三种物质含量比例是否可以变化呢?事实上这个比例是不变的。这不仅支持了原子的观点,而且符合德谟克利特提出的原子不可分割的说法。原先的说法像是原封未动,或者说就像什么也没有发现。
然而,事实并非如此,德谟克利特与普鲁斯特所做工作的不同之处在于:德谟克利特仅仅是提出了一种想法;而普鲁斯特则是得到了证据。(这样说并不意味着普鲁斯特就一定比德谟克利特更伟大或更聪明,因为他得益于后来21个世纪中人们的思维和工作成就,并从中得到了许多借鉴。你很可能会想到,在这个游戏中,德谟克利特在这么多年以前一下子就能猜中事实真相,这实在是太令人惊讶了。)
即便有了这样的证据,就连普鲁斯特也未能始终坚持自己的思路。毕竟,普鲁斯特的分析也有可能是错的,或者说由于他极力想要证明自己的想法,以至于不知不觉地歪曲了自己的观点。(因为科学家也只是普通的人,这样的事情总会发生的。)
另一位法国化学家贝多莱(Claude Louis Berthollet,1748—1822)
全面反对普鲁斯特的思路。他坚持认为他的分析表明:化合物可以由不同比例的元素组成。然而,就在1804年,瑞典化学家柏齐力乌斯(Jöns Jakob Berzelius,1779—1848)着手进行了仔细的分析,从而又回到普鲁斯特的观点,向化学界证明,定比定律是正确的。
与此同时,英国化学家道尔顿(John Dalton,1766—1844)也进行了这方面的研究工作。他发现化合物有可能由比例相差悬殊的元素组成。因此,在一种由碳和氧组成的气体分子中,碳和氧的比例可以是3比4;而在另一种由碳和氧组成的气体分子中,碳和氧的比例则又可以是3比8。然而,这是两种不同的气体,它们具有两种不同的配置比例,而其中无论哪一种又都符合定比定律。
道尔顿假设,在一种气体中,其分子由1个碳原子和1个氧原子组成;而在另一种气体中,分子则由1个碳原子和2个氧原子组成。最终,他的观点被证明是正确的,这两种气体后来分别被称为一氧化碳(carbon monoxide)和二氧化碳(carbon dioxide)。(前缀mon源自希腊语,意为“一”;di亦源自希腊语,意为“二”。)
道尔顿在其他一些情况下也发现了这类事情,1803年他宣布了这条多比定律。他指出,这与以前的原子观念完全相符;也就是他,把它们称为原子,慎重地回复到使用这一古老的术语,作为对德谟克利特的歌颂。
道尔顿指出,要想解释包含在化合物中的各种元素所占的比例这件事,人们首先必须确认,每一种元素都由大量原子组成,而所有这些原子都具有相同的固定质量;不同元素具有不同质量的原子;分子则由小的、数目固定的不同原子组成。
1808年,道尔顿出版了一本书,书名为《化学哲学新体系》,他收集了所有能找到的支持原子学说的证据,并表明所有这些论据是如何相辅相成的。道尔顿通过这本书建立起了近代原子理论——这里说近代是相对于古希腊而言。
偏巧,理论这个词不能被一般公众确切地理解,人们往往认为理论就是一种“猜想”。即便是词典,也不能对科学家确切地说明这个词的含义。
确切地说,理论是一组基本定则;它得到被许多科学家确认的大量观测结果的支持;它能够解释许许多多事实,使之显得很切合实际;但倘若没有这一理论,这些事实似乎又显得相互之间没有联系。这些事实和观测结果就好像杂乱无章地分布在一张纸上的若干个代表城市的点和代表国界及州界的线,并无实际意义。而理论则是一张地图,它使每个点和每条线都处在正确的位置上,成为能将所有点和线联系起来的有实际价值的图。
起初,理论的每一个细节不一定都是正确的,而且也许永远不可能保证每个细节都完全正确,但理论的总体是足够正确的(如果它们是好的理论),足以引导科学家去理解该理论论及的学科,探索进一步的观测结果,并最终改进这一理论。
道尔顿在建立他的原子理论时所用到的每个基本定则都并非完全正确。最终,实际情况表明,一种元素可以具有不同质量的原子;两种元素可以具有一些质量相同的原子;并非所有的分子都由少量的原子组成。然而,道尔顿的定则足够接近于正确,而且非常有用,随着化学家们对原子认识的日益深入,他们就能修正这些定则,这一点我们会在后面看到。
世界上没有一种科学理论是立即就被科学家接受的。总会有那么一些科学家对任何新东西都表示怀疑,不过这也许是件好事。一些理论不应该轻易就被不知不觉地接受;而应该使劲地对其提出问题并进行检验。只有这样,理论中的一些弱点才不至于被掩盖,也许还能得以加强。
偏巧,道尔顿时代的一些最著名的化学家对这一新理论表示怀疑,但实际情况表明,该理论对于帮助理解一些化学方面的观测结果是如此有用,以至于化学家们一个接一个地加入了这一行列,最终使整个科学界都成了原子论者。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。















