实验二十四 工业链霉菌基因组重排育种试验
一、实验目的
通过基因组重排技术与核糖体工程相结合,选育阿维拉霉素生产菌株。
二、实验原理
阿维拉霉素(Avilamycin)又称卑霉素、阿美拉霉素、肥拉霉素,是由绿色产色链霉菌(Streptomyces viridoehrongenes)菌株发酵而成的二氯异扁枝衣酸酯,属于正糖霉素族的寡糖类抗生素,主要抑制革兰氏阳性菌,对革兰氏阴性菌效果较差,是一种新型消化促进剂和代谢调节剂。
基因组重排技术是通过原生质体融合达到全基因组片段交换、重组的目的,之后再经多轮递归融合将正向突变表型聚集于高产菌株中。原生质体融合在多亲本的条件下其重组效率很低,多轮递归融合基因组重排具有高效性。原生质体递归融合过程,包括制备原生质体(主要参考因素有菌龄、酶解浓度、酶解温度和时间),融合和再生原生质体(主要参考因素有助融剂的选择、高渗溶液和再生培养基的设计等)。其过程主要包括:①获取一个含有各种不同正突变的基因库;②制备原生质体;③诱导原生质体递归融合;④设计特殊的选择性培养基。
本实验先经过60Coγ诱变得到基因型不同的多株出发菌株,再由此进行多轮原生质体融合,从而通过基因组重排以获得高产菌株。进化压力的选择是基于核糖体工程的育种思想而设计。
三、实验器材
(一)菌种
绿色产色链霉菌Streptomyces viridochromogenes 4.1119,60Coγ诱变高产菌株1-16、1-17、1-19。
藤黄微球菌(Microccus luteus10209)。
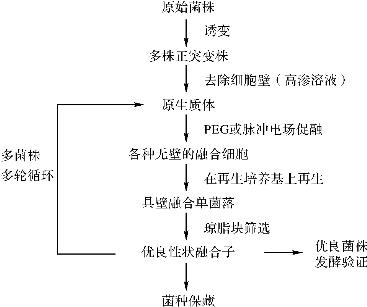
图24-1 育种路线图
(二)培养基
(1)链霉菌活化培养基:KNO31.0g/L,可溶性淀粉20.0g/L,K2HPO40.5g/L,MgSO4·6H2O 0.5g/L,FeSO4·7H2O 0.01g/L,NaCl 0.5g/L,Agar 20.0g/L,pH 7.2~7.4。
(2)再生培养基:KH2PO40.025%,蔗糖10.3%,MgC12·6H2O 1.12%,葡萄糖1.0%,蛋白胨0.01%,酵母浸出粉0.5%,微量元素溶液0.2mL/100mL,TES1.0mL/100mL,琼脂2.0%。分装250mL于500mL锥形瓶中,然后各加入单独灭菌的KH2PO4(0.5%),CaC12·2H2O(2.5M)和NaOH(1.0M)分别为2.5mL,2.0mL和1.75mL。
(3)链霉菌发酵基本培养基:可溶性淀粉20.0g/L,豆粕粉20.0g/L,大豆蛋白胨5.0g/L,D-木糖7.0g/L,L-缬氨酸2.0g/L,CaCO30.5g/L,MgSO40.5g/L,微量元素。pH 7.2~7.4。
(4)牛肉膏蛋白胨液体培养基:牛肉膏3.0g/L,蛋白胨10.0g/L,NaCl 5.0g/L,pH 7.0~7.2。
(5)牛肉膏蛋白胨半固体培养基:牛肉膏3.0g/L,蛋白胨10.0g/L,NaCl 5.0g/L,琼脂10.0g/L,pH 7.0~7.2。
(6)牛肉膏蛋白胨固体培养基:牛肉膏3.0g/L,蛋白胨10.0g/L,NaCl 5.0g/L,琼脂20.0g/L,pH 7.0~7.2。
(三)药品与试剂
可溶性淀粉、葡萄糖、硝酸钾、磷酸氢二钾、硫酸镁、硫酸亚铁、氯化钠、磷酸二氢钾、蔗糖、氯化镁、蛋白胨、酵母浸出粉、氯化钙、氢氧化钠、豆粕粉、大豆蛋白胨、D-木糖、牛肉膏、L-缬氨酸、碳酸钙、氯化锰、PEG6000、甲醇、乙腈、乙酸铵。
(四)溶液
(1)微量元素:ZnCl240mg,FeCl3·6H2O 200mg,CaCl2·2H2O 10mg,MnCl2· 4H2O 10mg,NaB4O7·10H2O 10mg,(NH4)6M7O24·4H2O 10mg,加入至1 000mL蒸馏水中。
(2)高渗溶液PB:蔗糖10.3g,K2SO40.025g,MgC12·6H2O 0.202g,微量元素溶液0.2mL,用去离子水定容到88mL,灭菌;再加入单独灭菌的KH2PO4 (0.5%),CaC12·2H2O(2.5M)和TES各10.0mL。
(3)TES缓冲液:Tris-HCl(pH 8.0)10mM,EDTA 1mM,SDS 0.1mM。
(4)酶溶液:称取0.2g溶菌酶溶解在100mL PB液中,配制成浓度为0.2%的酶溶液。
(五)主要仪器设备
SORVALL RC6型高速冷冻离心机、DYK-Ⅱ恒温调速回转式摇床、XDD型电热立式压力蒸汽消毒器、无菌操作台、DK-8D型电热恒温水槽(上海森信实验仪器有限公司)、移液枪、分析天平、pH计、高效液相色谱仪(惠普公司)。
四、实验步骤
(一)阿维拉霉素产生菌的诱变育种
(1)诱变及筛选流程:冻干管→液体活化培养基→平板稀释涂布→单孢子斜面→单孢子悬液→60Coγ诱变→稀释涂布于含阿维拉霉素的平板→单菌落→琼脂块初筛→转接斜面→摇瓶发酵复筛→正突变株→保藏。
(2)孢子悬液的制备:新鲜的正突变株孢子斜面中加入5mL的无菌生理盐水,用接种棒将孢子刮下,转入无菌离心管中,再用5mL无菌生理盐水洗斜面一次,并转入无菌离心管,用无菌脱脂棉过滤,得单孢子悬液。
(3)阿维拉霉素最小抑菌浓度实验:将制备的单孢子悬液用10倍稀释法,依次稀释10-1,10-2,10-3,10-4,10-5,10-6,10-7几个梯度,分别取200μL涂布于添加0.1%,0.2%,0.3%,0.4%,0.5%浓度链霉素的平板,对照组平板不添加,于28℃培养7d。
(二)融合前菌种培养
(1)将60Coγ诱变得到的高产正菌株单孢子悬液接种于装有100mL种子培养基的500mL三角瓶中(含有0.5g甘氨酸和少量玻璃碎片),28℃,120r/min振荡培养36~48h。
(2)用显微镜观察是否染菌。
(3)移取5mL上述种子液到10mL的无菌离心管中,6 000rpm,离心10min。去上清液,收集菌丝体。加入5mL无菌水,振荡均匀后倒入到装有一定量玻璃碎片和10mL蒸馏水的100mL灭菌三角瓶中,在150r/min,振荡30min,使成团的菌丝体打碎分散开。
(4)振荡结束后,吸取5mL菌液到10mL无菌离心管中,6 000rpm离心10min,弃去上清液。
(5)在上述10mL离心管中加入5mL PB液,用移液枪吹吸均匀,洗涤菌丝体,离心弃上清,重复一次,然后将菌丝体悬浮于5mL PB液中,按下述步骤进行原生质体的制备。
(三)原生质体制备
(1)将上述制备得到的菌丝体在6 000rpm离心10min,弃去上清液。
(2)在上述离心管中加入5mL 0.2%(g/mL)的溶菌酶,用移液枪吹均匀,于30℃的水浴振荡酶解2h,使菌体充分悬浮在酶液中。原生质体的形成情况可用显微镜跟踪观察。酶解结束后,再用移液枪吹吸几次,以使形成的原生质体从菌丝体中释放出来。
(3)用带有脱脂棉的一次性针筒过滤酶解液,收集滤液。在2 000rpm转速下离心15min,去除酶液,沉淀得原生质体。
(4)用5mL PB液洗涤原生质体一次,以洗净酶液。
(5)离心弃去上清液,然后用5mL PB液重新悬浮原生质体,用移液枪吹吸均匀;再用PB液稀释一定浓度,在血球计数板上计数原生质体。
(6)用PB液配制成约107个/mL的原生质体溶液。
(四)原生质体融合
(1)将不同菌株的原生质体悬液各取1mL于10mL的无菌离心管中,1 500rpm,离心15min,弃去上清液。
(2)加入40%的聚乙二醇(PEG6000),用移液枪吹吸均匀,悬浮原生质体,尽可能让促融剂PEG把原生质体包裹起来。25℃静置融合20min。
(3)2 500rpm,离心10min,沉淀原生质体,弃去上清液。再用PB液洗涤一次,1 500rpm离心15min,弃去上清液。
(4)加入5mL PB液悬浮原生质体融合液。
(五)原生质体再生
(1)取经过适当稀释后的原生质体融合悬液0.1mL加于含有一定浓度链霉素的再生平板上(再生平板使用前需在37℃培养箱中预培养1d,或是在65℃的烘箱中烘30min,以保证固体培养基表面水分充分蒸发,减少由于再生培养基表面的冷凝水引起的原生质体破裂)。
(2)将涂布好的培养皿倒置于28℃的培养箱中培养6~15d,观察再生结果。待再生双层平板上长出菌落,计再生菌落数(A)。
(3)取与上述相同量的原生质体用无菌水稀释相同的倍数,然后取0.1mL悬液涂布于再生平板上,待菌落长出后,计菌落数(B)。
(4)取与上述相同量的未酶解之前的菌丝体悬液,用PB液稀释相同的倍数后取0.1mL菌丝体悬液涂布于平板上,待菌落长出后,记菌落数(C)。
(5)原生质体制备率和再生率的计算:
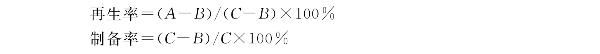
A:原生质体用PB液稀释后涂布再生双层平板存活的菌落数;
B:原生质体用无菌水稀释后涂布再生双层平板存活的菌落数;
C:酶解前菌丝体涂布平板长出的菌落数。
(六)基因组重排
按上述方法进行第一次原生质体融合再生后,挑取长出的单菌落进行初筛及摇瓶发酵实验,测其效价,并取效价高于原始菌株的菌株作为下一轮融合的对象,进行原生质体融合再生,所得菌株即为第二轮融合后的菌株。如此反复进行3~5轮重复的循环原生质体融合,链霉素抗性压力不断增大。融合子代标记依序为F1、F2、F3、F4、F5。
(七)重组菌株的稳定性
将发酵复筛得到的高产重组菌株按斜面传代的方法,连续传接五代,将每代的斜面按上述发酵复筛的方法进行复筛,测定发酵液中阿维拉霉素的效价,来确定重组菌株高产特性的遗传稳定性。
(八)阿维拉霉素效价测定
1.生测法检测阿维拉霉素产量
将灭菌后的牛肉膏蛋白胨固体培养基倒入已灭菌的平皿中(每个平皿15mL左右),室温下自然凝固,作为平板的下层。
指示菌Microccus luteus在液体培养基中摇瓶培养至OD600=0.3左右备用。将灭菌后的牛肉膏蛋白胨半固体培养基冷却到45℃左右,按2%的体积比向培养基中加入Microccus luteus的培养液,混匀,然后吸取5mL加到已凝固的下层培养基上,自然凝固,作为平板的上层。
用无菌镊子夹取内径6.0mm,外径为8.0mm,高为10.0mm的牛津杯放在上层培养基表面。加入150μL样品,常温下静置2h,使样品扩散(由于阿维拉霉素分子量较大,因此在培养基中的扩散速度较慢,如果加样后立即置于培养箱中培养,容易引起测定的结果偏低,因此根据经验,点样后必须先进行扩散),37℃培养20h,测量抑菌圈直径的大小。
此曲线公式为LgU=ad2+b
U:效价(mg/L)
d:直径(mm),a、b为方程系数
配制一定浓度梯度的阿维拉霉素标准品溶液。每个平板上放6个牛津杯,间隔加入150μL一定浓度的标准液和500mg/L的标准液。所有平板上由500mg/L标准液所得抑菌圈直径的平均值与每个梯度中500mg/L的标准液所得抑菌圈直径的平均值的差为各梯度的校正值。以标准液浓度的对数(mg/L)为纵坐标,各梯度抑菌圈直径校正值的平方(mm2)为横坐标制作标准曲线。标准液有5个梯度,每个梯度3个平行。将发酵液与甲醇等体积混匀,37℃放置2h。4 000rpm离心15min,取上清液做效价测定。每个平板上取一个牛津杯加入同一浓度的标准液,求出其抑菌圈直径的平均值。将每个平板上标准液的抑菌圈直径与平均值相比,会得到一个校正数。用各个平板的校正数对发酵液的抑菌圈直径进行校正,所得的校正值在标准曲线上查得对应标准品浓度即为所测定发酵液的效价。
2.高效液相色谱法检测阿维拉霉素
取发酵液30mL,离心弃上清,加入20mL乙腈,避光超声20min,取上清液,重复一次。将所得上清液旋蒸浓缩至10mL,用0.22μm微孔滤膜过滤,备用。
实验所用色谱条件为:分析柱C18,粒径5μm,4.6×250nm,流动相为乙腈0.01mol/L、乙酸铵溶液(体积比45∶55),流速1.0mL/min,检测波长295nm,进样量20μL,柱温30℃。
五、实验记录
(1)原生质体制备率和再生率

(2)生测法抑菌圈直径

六、思考题
(1)实验中为什么要使用链霉素抗性平板?
(2)在用生测法测量阿维拉霉素产量时为什么用双层板?加完样之后为什么要静置2h再放入培养箱?
(3)在原生质体制备与融合时需注意什么?
参考文献
[1]陈永辉,刘波,曾兆国,等.阿维拉霉素的研究进展[J].饲料工业,2007,28 (14):9—11.
[2]Weitnaucr G,Muhlenweg A,Trefzer A,et al.Biosynthesis of the orthosomycin
antibiotic avilamycin A:deductions from the molecular analysis of the avilamycin biosynthetic gene cluster of StreptomycesviridochromogenesTu57and production of new antibiotics[J].Chem biol,2001,8(6):569—581.
[3]Aarestrup F M,Seyfarth A M,Emborg H D,et al.Effect of abolishment of the use of antimicrobial agents for growth promotion on occurrence of antimicrobial resistance in fecal enterococci from food animals in Denmark[J].Antimicrob Agents Chemother,2001,45(7):2054—2059.
[4]Gong J X,Zhao X M,Xing Q R,et al.Femtosecond laser-induced cell fusion [J].Applied Physics Letters,2008,92(9):111—119.
[5]林赛珍.多杀菌素产生菌基因组重排育种[D].杭州:浙江大学,2007:1—63.
[6]Gong G L,Sun X,Liu X L,et al.Mutation and a high-throughput screening method for improving theproduction of epothilones of Sorangium[J].Journal ofIndustrial Microbiology and Biotechnology,2007,34(9):615—623.
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。













