【摘要】:实际气体不能完全遵守理想气体状态方程.在理想气体的模型中,我们将气体分子的大小和分子间的相互作用力忽略不计.范德瓦耳斯在考虑了气体分子本身的体积及分子间的相互作用力这两个因素后,修正了理想气体的状态方程,从而较近似地描述了实际气体.以上是考虑了气体分子本身的体积而对理想气体的状态方程做出的修正.同时范德瓦耳斯还考虑了分子间作用力的因素,做了另一修正.由于任何实际气体,分子间的相互作用力总是存在的.
实际气体不能完全遵守理想气体状态方程.在理想气体的模型中,我们将气体分子的大小和分子间的相互作用力忽略不计.范德瓦耳斯在考虑了气体分子本身的体积及分子间的相互作用力这两个因素后,修正了理想气体的状态方程,从而较近似地描述了实际气体.
考虑到分子本身的体积,1摩尔理想气体的状态方程可修改为
修正量b的数值可用实验测定.
图4.8 分子间引力而产生的内压强pi
pi是由于气体分子引力作用而产生的压强,叫做内压强.p为实验测定的压强,pi不能直接测定.但考虑到:一方面由于和器壁碰撞的分子数与容器内的分子总数成正比,另一方面由于与器壁碰撞的分子所受到的吸引力与容器内的总分子数成正比.可推断
或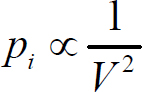 (对一定质量的气体而言,n反比于V),写成等式有
(对一定质量的气体而言,n反比于V),写成等式有
将pi代入方程有
上式叫做实际气体的范德瓦耳斯方程.a是另一个修正量.
应当指出,实际气体分子的运动还要复杂,因此,范德瓦耳斯方程也只是反映了实际气体的一些特性,它只是对理想气体方程做了一些简单的修正.
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。









