朊病毒蛋白(prion protein,Prp)是引起一组人和动物神经退行性病变的病原体,这类疾病具有传染性、遗传性或散在发病的特点。其在动物间的传播是由传染性颗粒——朊病毒(prion)完成的,该颗粒不含有核酸成分,仅是由修饰后的Prp同一蛋白PrpSc组成。因此,也称蛋白粒子病。
人类蛋白粒子病主要有四类:库鲁病(kuru disease)、纹状体脊髓变性病(creutzfeldt-Ja-kob disease,CJD)、脑软化症(Gerstmann-Straussler-Scheinker,GSS)和致死性家族性失眠症(fatal familial insomnia,FFI)。人库鲁病是第一个被发现能传染至实验动物,从而开始认识到人类此类疾病可能与羊瘙痒症一样由一种非同寻常的病毒引起。早年发现CJD有遗传倾向,其原因不清,但此病也能传染给实验动物。后来证实患者20号染色体短臂编码的基因Prp有基突变存在。
(一)朊病毒的概念
早期研究发现羊瘙痒症感染与核酸或寡核苷酸无关,说明传染源不是病毒或类病毒,提出新的传染源应用朊病毒一词用以区别病毒或类病毒,朊病毒具有不同于病毒复制方式的不依赖核酸的自身增殖能力。
(二)朊病毒蛋白的发现
研究发现朊病毒的传染性是由蛋白质介导的,人们开始寻找这种羊瘙痒症传染性蛋白,从感染朊病毒的仓鼠脑中提取得到了一种27~30ku的蛋白质,称为Prp27~30,对照鼠不存在此蛋白。经放射性碘标记证实羊瘙痒症提取物中仅有蛋白质成分,进一步纯化得到均一的代表提取液,应用Edman降解法测定N端序列,据此序列合成了对应的cDNA序列,最终从叙利亚仓鼠中获得了编码全部开放阅读框架的Prp克隆。
Prp是染色体基因编码的蛋白质。Prp基因是正常动物具有的基因,编码33~35ku的水溶性和对蛋白酶敏感的蛋白质,成为Prpc。而Prp27~30是Prpc的核心序列,具有对蛋白酶不敏感且水溶性差,称为PrpSc。
(三)Prp基因
迄今已知的动物Prp基因可有2个或3个外显子,但哺乳动物和鸟类的Prp基因的开放阅读框架均存在于一个外显子中。人20号染色体短臂和小鼠2号染色体的Prp基因定位结果提示Prp基因的存在应早于哺乳动物物种的形成。进一步研究还证明了在纯化的朊病毒颗粒中每ID50单位含有0.002Prp基因序列,提示传染性朊病毒颗粒不含有编码Prpsc的核酸。这是朊病毒区别于病毒(包括含有细胞癌基因的反转录病毒)和卫星病毒(此类病毒的外壳蛋白来自其他病毒)的最重要的特征。
(四)Prp蛋白结构与性质
仓鼠和小鼠的Prpc蛋白合成初始时为254个氨基酸,人的为253个氨基酸,MW为33ku。信号肽(SP)区编码N-端22个氨基酸;GP富集区为Gly-Pro5个8重复体和2个6重复体;STE区(称为终止子转移效应子,stop-transfer effector,96-112aa),编码控制Prp拓扑结构的功能域;TM区(113~135aa)编码一个跨膜的α-螺旋;AH区(157~177aa)编码一个亲水螺旋;SS区(232~254aa)编码一个疏水信号序列。经修饰加工,去除N-端的信号肽和C端的疏水序列,成熟后的Prpc为含208个氨基酸的糖蛋白,且在C端连有糖基磷脂酰肌醇而稳定于细胞膜,其GPI又被唾液酸化,这样Prpc易于在膜磷脂双层中运动,使蛋白质在细胞间转移成为可能(图7-12)。PrpSc的MW为27ku,其氨基酸序列与去除G-P重复序列的Prpc相同,剩余的141个氨基酸构成蛋白酶抗性中心。在Prpc的C端有2个N-糖基化位点,N-糖链较大,阻碍了Prp表面一定区域的蛋白质间相互作用和蛋白水解酶酶解,Prp的N-端糖链呈现显著的多样性,推测不同细胞分布的Prpc有不同糖型(表7-2)。
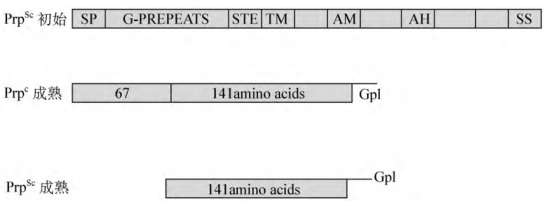
图7-12 Prp结构与性质比较
GP富集区:Gly-Pro5个8重复体,2个6重复体;STE区(96~112aa):编码控制Prp拓扑结构的功能域称终止效应子;TM区(113-135aa):编码一个跨膜α-螺旋;AH区(157~177aa):编码一个跨膜亲水螺旋;SS区(232~254aa):编码一段疏水信号序列,当加上糖基磷脂酰肌醇时被除去
表7-2 Prp性质比较

(五)Prp蛋白的分布和生理功能
在体内Prpc主要分布于神经元、神经胶质细胞、小胶质细胞、肌细胞和白细胞等。这可能与Prpc在神经系统和免疫系统发挥作用有关。Prpc在神经元中高度表达,且高度富集于突触处。在Prpc缺陷鼠脑片中发现有GABA-型抑制电流以及对外源性铜和过氧化氢等应激诱导应答方面的改变;Prpc缺陷鼠的神经元在培养时存活能力下降,对铜和阿糖胞苷等导致的氧化损伤和毒性敏感性增强,星形胶质细胞在摄取谷氨酸方面发生异常;小胶质细胞对兴奋物质的反应性下降;在突触形成中有结构改变。Prpc可能还可通过抗氧化途径而保护神经系统细胞免受氧化损伤。
Prpc还可在人T、B淋巴细胞、单核细胞及树突状细胞中高度表达;且随着人T细胞的活化,Prpc的表达上升及记忆T细胞的Prpc水平比天然T细胞为高,这可能与Prpc参与T淋巴细胞信号转导有关。
(六)人蛋白粒子病致病分子机制
已证明人类蛋白粒子病可以是传染性的、遗传性的或散在性的发生。根据临床和神经病理学的认定,人蛋白粒子病主要是指库鲁病、CJD、GSS和FFI等。
蛋白粒子病传染性主要来自朊病毒的水平播散,例如医源性的CJD和库鲁病。遗传性以GSS、家族性CJD和FFI为主,但只占总蛋白粒子病例的10%~25%。已发现亲缘关系患者均有Prp基因的突变。而绝大部分的CJD和GSS是散发性的。散发病人如何产生朊病毒,目前不清楚,有以下三种假说:人或动物水平传播、体细胞Prp基因开放阅读框架突变和自发性Prpc转变成Prpsc。
Prpsc导致蛋白粒子病的详细分子机制并不完全清楚。朊病毒本身不能繁殖,但目前普遍认为它是通过胁迫Prpc改变空间结构而达到自我复制的目的。即蛋白粒子病发病过程中,以α螺旋为主并对蛋白酶敏感的Prpc转变成以β片层为主的对蛋白酶抵抗的具有感染能力的不溶性Prpc;或1个分子Prpsc胁迫1个分子Prpc形成Prpsc二聚体,随后2个分子Prpsc胁迫2个分子Prpc形成4个分子Prpsc,如此倍增累积,导致神经元损伤。Prusiner研究发现Prpc呈α螺旋的部分肽链在Prpsc的类似区域为β片层结构。这种由α螺旋向β片层转变的方式。现已有具核结晶和模拟蛋白两种假说说明之。在模拟定向模型认为Prpc遭遇Prpsc分子,二者产生亚稳定型的寡聚复合物,最终Prpc被诱导形成类似于Prpsc的空间结构,在此过程中有未知蛋白参与,起到促使Prpc转化或维持Prpsc结构稳定的作用。在具核结晶模型中,Prpsc分子形成自我种植的核心寡聚复合物,同时Prpc空间结构发生转变,最终形成淀粉样纤维的β片层结构。近年也有证据认为Prpsc可能呈双α螺旋结构状态。
Prpc转变成Prpsc结构后,致使Prpc数量减少,进而使神经细胞SOD样活性下降,从而对超氧化物等造成的氧化损伤的明暗性增加。此外,也可使神经细胞对高谷氨酸和高铜毒性的敏感性增加,致使神经细胞变性死亡。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。















