质粒(plasmid)是一种共价闭合环状的双链DNA分子,存在于细菌、放线菌和真菌细胞中,大小为1~200kb。它们独立于细菌的染色体,能够自主复制和转录,并且能在子代细胞中保持恒定的拷贝数,表达所携带的遗传信息,所以常被用作基因工程的载体。
一、质粒提取原理
从细菌中分离质粒DNA时,首先采用溶菌酶破坏菌体细胞壁,十二烷基磺酸钠(sodium dodecyl sulfate,SDS)和Triton X-100可使细胞膜裂解。经溶菌酶和SDS或Triton X-100处理后,细菌染色体DNA会缠绕附着在细胞碎片上,同时由于细菌染色体DNA比质粒大得多,易受机械力和核酸酶等的作用而被切断成不同大小的线性片段。当用加热或强酸、碱处理时,细菌的线性染色体DNA变性,而质粒的两条闭合环状DNA链则不会相互分开。当外界条件恢复正常时,线状染色体DNA片段难以复性,与变性的蛋白质和细胞碎片缠绕在一起成为沉淀;而质粒DNA双链又恢复原状,重新形成天然的超螺旋分子,并以溶解状态存在于液相中。
质粒提取的主要步骤如下:
![]()
二、质粒DNA小量提取
(一)煮沸裂解法
【材料】
1.细菌 E. coli DH5α或JM系列菌株。
2.试剂
(1)LB液体培养基:称取蛋白胨10g,酵母提取物5g,NaCl 10g,溶于800ml去离子水中,用NaOH调pH至7.5,加去离子水至总体积1L,高压下蒸气灭菌20min。
(2)LB固体培养基:液体培养基中每升加12g琼脂粉,高压灭菌。
(3)氨苄西林(Amp,氨苄青霉素)母液:配成 50mg/ml水溶液,-20℃保存备用。
(4)溶菌酶溶液:用10mmol/L Tris-HCl(pH 8.0)溶液配制成10mg/ml,并分装成小份保存于-20℃(每一小份使用即丢弃)。
(5)STET:0.1mol/L NaCl,10mmol/L Tris-HCl(pH 8.0),10mmol/L EDTA (pH 8.0), 5% Triton X-100。
(6)3mol/L NaAc (pH 5.2):50ml水中溶解40.81g NaAc•3H2O,用冰醋酸调pH至5.2,加水定容至100ml,分装后高压灭菌,4℃储存。
(7)异丙醇。
(8)70%乙醇。
(9)TE缓冲液:10mmo/L Tris-HCl(pH 8.0),1mmol/L EDTA(pH 8.0),高压灭菌后储存于4℃冰箱中。
(10)胰RNA酶(10mg/ml):将RNA酶A(RNase A)溶于10mmol/L Tris-HCl(pH 7.5)、15mmol/L NaCl中,配成10mg/ml的溶液,于100℃加热15min,使混有的DNA酶(DNase)失活,冷却后分装成小份,-20℃保存。
3.设备 微量移液器(20μl、100μl、1000μl)、台式高速离心机、恒温振荡摇床、高压蒸汽消毒器(灭菌锅)、恒温水浴箱、涡旋振荡器、1.5ml Eppendorf管(EP管)。
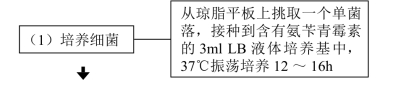
【操作步骤】
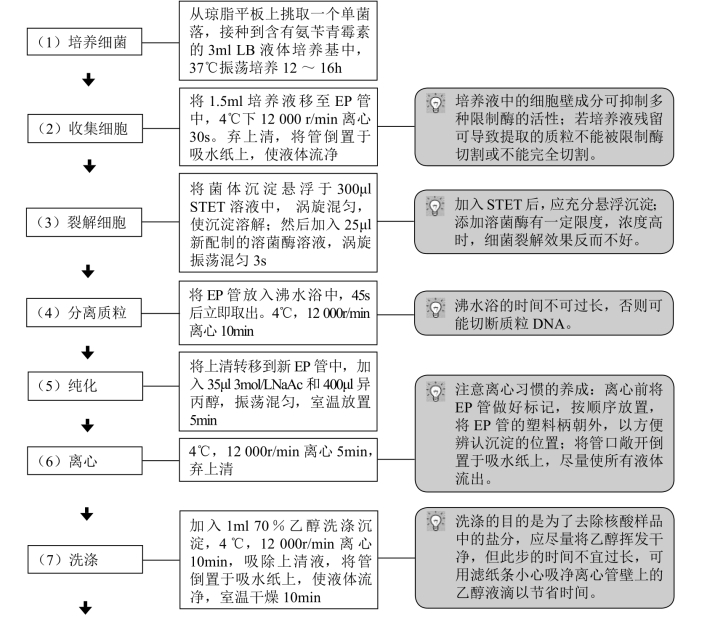
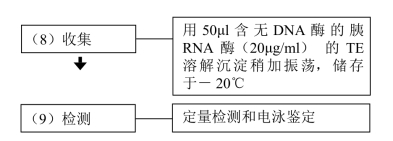
【注意事项】
(1)除去上清时,应尽可能去干净。
(2)当从表达内切核酸酶A的大肠杆菌株(endA+株,如HB101)中小量制备质粒DNA时,建议舍弃煮沸法。因为煮沸步骤不能完全灭活内切核酸酶A,以后在Mg2+存在下温育时(如用限制性内切酶进行酶切反应),质粒DNA可被降解。在上述方案的步骤(7)之前增加一步,即用酚∶氯仿进行抽提,可以避免这一问题。
(二)碱裂解法
【材料】
1.细菌 E. coli DH5α或JM系列菌株。
2.试剂
(1)LB液体培养基。
(2)LB固体培养基。
(3)氨苄青霉素(Amp)母液。
(4)溶液Ⅰ:50mmol/L 葡萄糖,25mmol/L Tris-HCl(pH 8.0),10mmol/L EDTA (pH 8.0)。溶液Ⅰ可成批配制,每瓶100ml,高压灭菌15min,储存于4℃冰箱。
(5)溶液Ⅱ:0.2mol/L NaOH(临用前用10mol/L储存液现用现稀释),1% SDS。
(6)溶液Ⅲ:5mol/L KAc 60ml,冰醋酸 11.5ml,H2O 28.5ml,定容至100ml,并高压灭菌,溶液终浓度为:[K+] 3mol/L,[Ac-] 5mol/L。
(7)Tris-饱和酚。
(8)氯仿:按氯仿∶异戊醇=24∶1体积比加入异戊醇,等体积混合上述饱和酚与氯仿即得(25∶24∶1)。
(9)无水乙醇和70%乙醇(放置于4℃冰箱,用后立即放回)。
(10)TE缓冲液。
3.设备 微量移液器(20μl、100μl、1 000μl),高速冷冻离心机,恒温振荡摇床,高压蒸汽消毒器(灭菌锅),涡旋振荡器,1.5ml EP管。
【操作步骤】
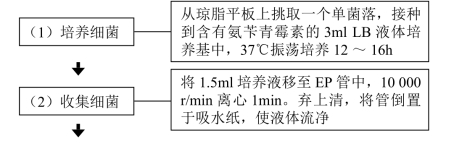
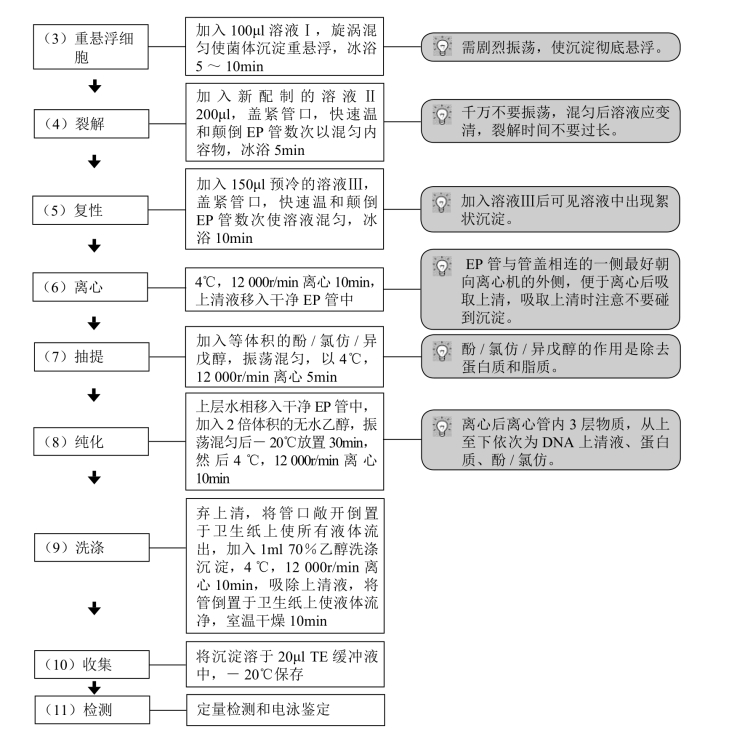
【注意事项】
(1)提取过程中应尽量保持低温。
(2)除去上清时,应尽可能去干净。
(3)溶液Ⅱ不可冷冻,现用现配。
(4)加入溶液Ⅱ注意不能过分用力振荡,是为了避免染色体DNA断裂成小片段,从而能与质粒DNA相分离,所以要温和混匀,冰上放置。加入溶液Ⅲ后应同样处理。
(5)加入溶液Ⅲ后复性时间不要太长,否则染色体DNA也会复性。
(6)提取质粒DNA过程中除去蛋白很重要,采用酚/氯仿去除蛋白效果较单独用酚或氯仿好,要将蛋白尽量除干净可多次抽提。
(7)加乙醇沉淀DNA时,要把离心管加盖倒置摇动4~5次,注意观察水相与乙醇之间没有分层现象之后,才可以放在冰箱中,以获得更多的DNA沉淀。
(8)在用70%乙醇洗涤质粒DNA沉淀时,应尽量将乙醇挥发干净,因为如残留较多乙醇,以后在做酶切鉴定时,乙醇会使限制性内切酶失活。
(9)酚和氯仿均有很强的腐蚀性,操作时应戴手套,注意不要溅到身上。
【结果与分析】
1.实验结果及分析 提取产物经琼脂糖凝胶电泳分离、EB染色后,在紫外线灯下可观察到3个条带,自前往后分别为:超螺旋、线性和开环状质粒DNA(图6-1)。
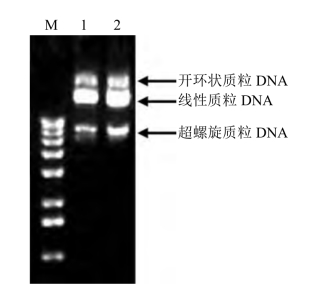
图6-1 质粒DNA琼脂糖凝胶电泳图
M:DNA分子量标准(DL15 000);1和2:提取的质粒DNA
超螺旋质粒DNA、线性质粒DNA和开环状质粒DNA这3种不同构型的分子有不同的迁移率,在一般情况下,超螺旋型迁移速度最快,其次为线性分子,最慢的为开环状分子。
2.常见问题及解析 见表6-1。
表6-1 碱裂解法常见问题及解析
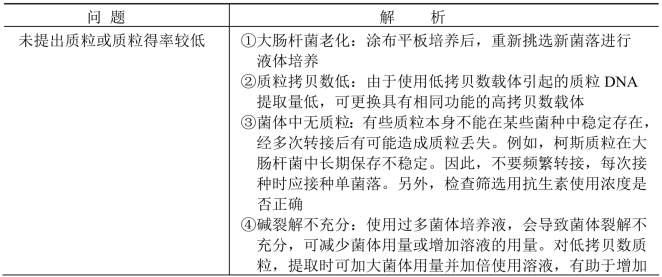
(续表)
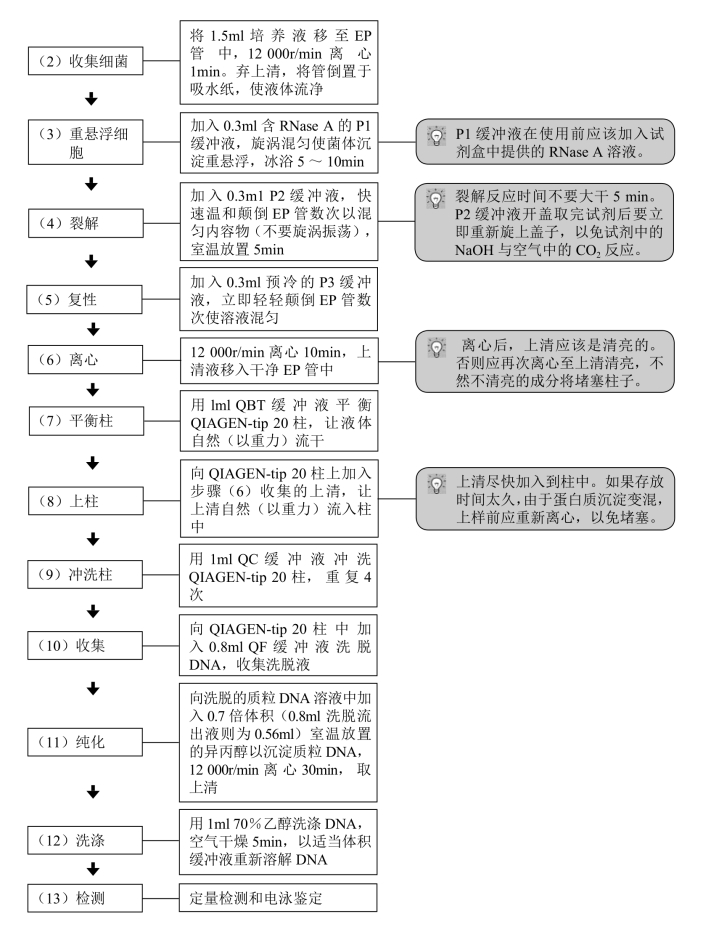
(三)试剂盒法(以Qiagan质粒DNA小量制备试剂盒P1asmid Mini Kit为例)
【试剂】
(1)纯化柱(QIAGEN-tip 20)。
(2)Pl缓冲液(Buffer P1):50mmol/L Tris-HCl(pH 8.0),10mmol/L EDTA,100μg/ml RNase A,4℃保存。
(3)P2缓冲液(Buffer P2):200mmol/L NaOH,1%SDS,室温保存。
(4)P3缓冲液(Buffer P3):3.0mmol/L乙酸钾(pH 5.5),室温或4℃保存。
(5)QBT缓冲液(平衡缓冲液):750mmol/L NaCl,50mmol/L MOPS(pH 7.0),15%异丙醇,0.15%Triton X-100,室温保存。
(6)QC缓冲液(冲洗缓冲液):1.0mmol/L NaCl,50mmol/L MOPS(pH 7.0),15%异丙醇,室温保存。
(7)QF缓冲液(洗脱缓冲液):1.25mol/L NaCl,50mmol/L Tris-HCl(pH 8.5),15%异丙醇,室温保存。
(8)RNase A(100mg/ml)。
(9)异丙醇。
(10)70%乙醇。
(11)TE缓冲液。
【操作步骤】
三、质粒DNA大量提取
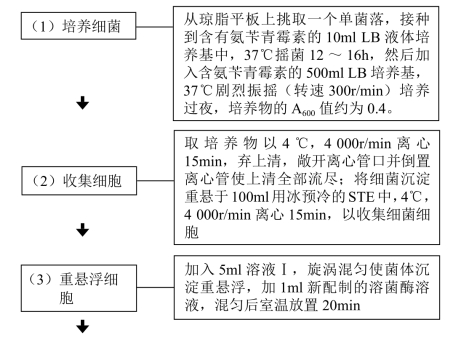
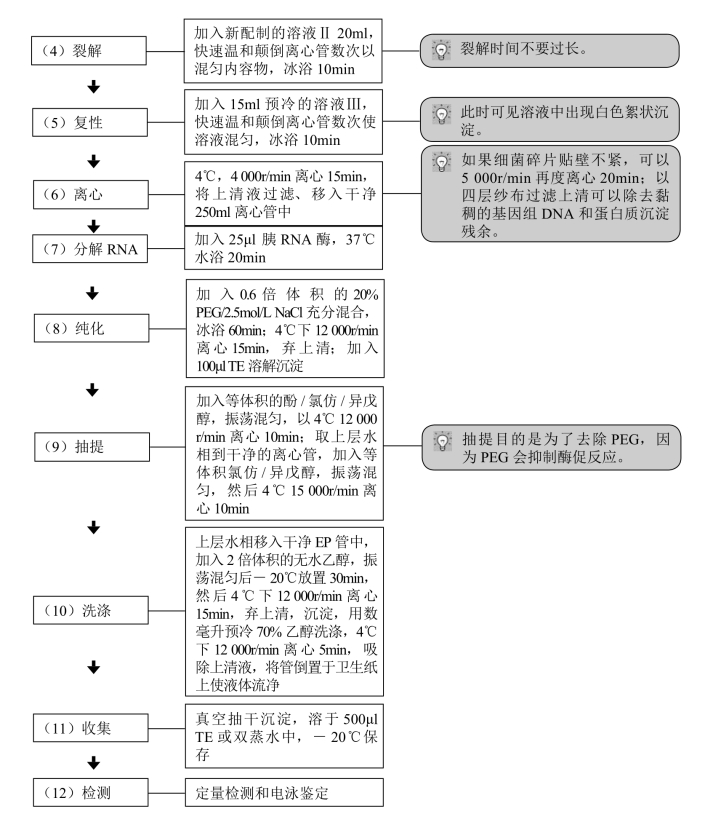
这里主要介绍用碱裂解法大量提取质粒DNA。
【材料】
1.细菌 E. coli DH5α或JM系列菌株。
2.试剂
(1)LB液体培养基。
(2)LB固体培养基。
(3)氨苄青霉素(Amp)母液。
(4)STE:0.1mol/L NaCl,10mmol/L Tris-HCl(pH 8.0),1mmol/L EDTA(pH 8.0)。
(5)溶菌酶溶液(10mg/ml)。
(6)胰RNA酶(10mg/ml)。
(7)溶液Ⅰ。
(8)溶液Ⅱ。
(9)溶液Ⅲ。
(10)20% 聚乙二醇(PEG,分子量6 000D)/2.5mol/L NaCl。
(11)Tris-饱和酚。
(12)氯仿/异戊醇=24∶1(体积比)。
(13)预冷无水乙醇和70%乙醇。
(14)TE缓冲液。
3.设备 微量移液器(100μl、1 000μl),高速冷冻离心机,恒温振荡摇床,高压蒸汽消毒器(灭菌锅),恒温水浴箱,涡旋振荡器,真空离心干燥机,500ml离心管,250ml离心管,50ml离心管。
【操作步骤】
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。















