近年来,海洋微藻的脂肪酸组成研究引起了各国科学家的兴趣,这不仅是由于海洋微藻是许多长链多元不饱和脂肪酸(PUFAs)的重要来源,研究发现这类脂肪酸对海洋动物和人类都具有营养学和医药学价值,而且脂肪酸组成和海藻系统分类之间存在着很大相关性。因此,可将脂肪酸组成作为海洋微藻化学分类的标记之一。
海洋微藻具有合成EPA和DHA等n-3-PUFAs的奇特能力,其他海洋生物,包括鱼类中的EPA和DHA大都通过食物链从微藻积蓄而来,而且藻油没有鱼腥味,很少含胆固醇,因此海洋微藻是EPA和DHA的另一种重要来源;海洋微藻又是海洋水产动物育苗中非常重要的生物饵料,其EPA和DHA的含量是衡量其营养价值的非常重要的指标,因此海洋微藻中高度不饱和脂肪酸的研究和开发受到了极大的重视,成为研究的热点。
林学政、李光友(2000)研究了11种微藻的脂类和EPA/DHA的组成,分析结果见表3-6。
表3-6 11种微藻的生物量、总脂和脂肪酸中EPA/DHA含量

注:*总脂含量系指占藻体干重的百分比;** EPA和DHA的含量系指占脂肪酸总量的百分比;NT 未检出
1. EPA、DHA的生物活性
具有4~5个双键的高不饱和脂肪酸及其代谢产物不仅是构成动植物细胞膜结构的重要成分,而且具有多种重要的生理功能,其中二十碳四烯酸(AA,又名花生四烯酸)、二十碳五烯酸(EPA)和二十二碳六烯酸(DHA)被认为是比较重要的多不饱和脂肪酸。
研究表明,AA和EPA是前列腺素及其衍生物前列环素、凝血烷、白三烯等激素类化合物的前体,这类化合物在广泛的生理过程中起着重要的调节作用。EPA和DHA能够降血脂、降血压、降胆固醇、抗血栓、防止血小板凝结、舒张血管,可用于预防和治疗心血管疾病,防止动脉粥样硬化;用于预防和治疗癌症、炎症、风湿性关节炎、糖尿病等疾病;提高人体的免疫调节机能;DHA能够促进脑细胞的生长发育,改善脑的机能,可用于中枢神经系统疾病的预防与治疗。
2. EPA、DHA在微藻中的分布
EPA和DHA在陆生生物中含量很少,而在海洋生物如藻类、鱼类、某些软体动物、棘皮动物中含量丰富。鱼类等海洋动物本身不能合成EPA和DHA,其体内的EPA和DHA是依靠食物链通过吞食藻类及浮游生物才得以积累,因此,微藻是海洋食物链中EPA和DHA的最初生产者。许多种类的微藻具有合成EPA和DHA的能力,而其他生物却不能直接合成这些多烯酸,且EPA和DHA在某些微藻中的含量较鱼油中更为丰富。表3-7列出了EPA和DHA含量较高、具有开发价值的某些微藻。
表3-7 某些微藻类脂中的高不饱和脂肪酸含量(/%)
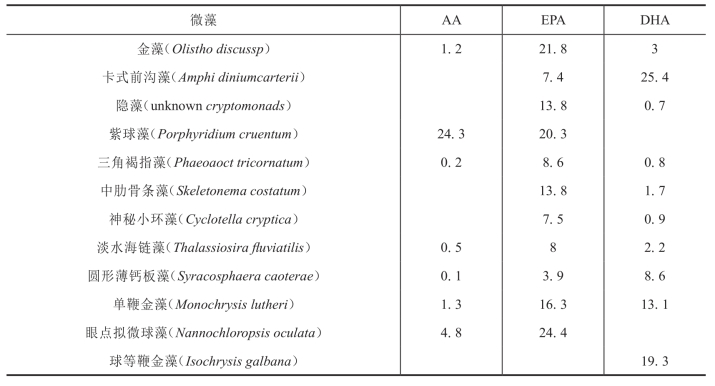
3.利用微藻开发EPA和DHA的优势
虽然某些种类的大型海洋藻类、海洋动物中也含有EPA和DHA,但是利用微藻生产EPA和DHA具有不可比拟的优点:① 微藻生长繁殖较快、EPA和DHA产量高,如某些微藻细胞中的多不饱和脂肪酸含量高达细胞干重的5%~6%,远高于大型藻类和鱼油中多不饱和脂肪酸的含量;② 微藻细胞结构简单,其生长和代谢易受外界条件的影响,因此可以通过改变培养条件,如温度、光强、培养基组成等促进EPA和DHA的合成,还可利用基因工程的方法筛选出高产EPA和DHA的藻株;③ 容易利用户外大型水池、光生物反应器等进行微藻的大规模人工培养,可人为控制培养条件,容易获得稳定的代谢产物;④ 从微藻中提取EPA和DHA比从大型藻类及鱼体中提取要简单得多,而且获得的EPA和DHA制品不含鱼油的腥臭味,不含胆固醇,并且不受杀虫剂和重金属的污染,而鱼油中却可能含有这些杂质。
4.海洋微藻EPA和DHA生产菌种的培养
目前市场上的EPA和DHA均从海鱼中提取,由于海洋渔业资源日趋紧张使原料不易获得,造成产品成本很高。与此相比,利用工厂化大规模培养微藻可以人为控制微藻的生产,原料来源稳定,因此开发微藻生产EPA和DHA具有很大的商业价值和前景。
微藻脂肪酸的合成除了受自身基因组调控外,培养条件也极大地影响微藻脂肪酸的合成与积累。这些条件包括温度、光照、营养盐浓度等。
(1)温度。
温度对微藻的影响主要体现在两个方面:一方面影响微藻的生长;另一方面影响藻细胞内生化组分的合成。大量实验表明,温度在PUFAs合成过程中起主导作用。Makoto等(1999)实验表明,低温能够诱导Marchantia polymorpha EPA的积累,在25℃时,EPA含量占总脂肪酸的3%,15℃时上升至9%。菱形藻(Nitzschia paleacea)的EPA含量与温度呈负相关,当温度从10℃上升到25℃时,EPA含量由28.4%下降至18.1%,DHA含量也呈相同的趋势。但是并非所有的微藻脂肪酸变化都遵循这个规律。Teshima等(1983)在测定海洋小球藻(Chlorella sp.)EPA含量对温度的响应时发现,当温度从14℃上升至24.7℃时,EPA含量占总脂肪酸的比例从28.2%上升至38.4%,随着温度升高而增加;当温度由24.7℃上升至28.5℃时,EPA含量急剧下降至16%。从以上可以看出嗜低温的微藻在其适宜的温度下较嗜热种合成的不饱和脂肪酸更多,微藻脂肪酸组成对温度的响应呈现出多样性,可能与微藻的生活环境与生态类型有关。
(2)光照。
对于自养微藻来说,光照不仅影响其生长,而且影响藻细胞内的代谢过程。光照对微藻脂肪酸组成的影响具有种间差异性。一般认为低光强更有利于微藻积累PUFAs。三角褐指藻(P.tricornutum)在光强为360μmol/(m2·s)时,EPA含量占总脂肪酸的12.37%,当光强下降至50μmol/(m2·s)时,EPA含量占总脂肪酸的22.15%。角刺藻(Chaetoceros simplex)在光强为6μmol/(m2·s)时,EPA含量占总脂肪酸的15.5%,当光强为225μmol/(m2·s)时仅为6.1%。
(3)盐度。
不同的微藻对盐胁迫的耐受能力和反应不同。大多数藻细胞生理和代谢过程需要Na+的参与。高NaCl浓度下生长的藻细胞需要更多的能量来维持其生长,作为细胞内储存物的脂肪含量相应增加。但是在高盐浓度下,微藻为了避免细胞内容物渗出和有害离子进入细胞,细胞膜流动性降低,渗透性下降,因而膜上脂肪酸不饱和度降低。Cohen等(1989)研究了盐度对紫球藻(P.cruentum)的影响。结果发现在NaCl浓度为0.25mol/L时生长较快,EPA含量占总脂肪酸的37.5%;当NaCl上升到2mol/L时,EPA含量仅占总脂肪酸的18.9%,几乎下降了一半,总脂肪酸的含量也随着NaCl浓度升高而下降,但亚麻酸和AA的含量随着NaCl浓度升高而升高。
(4)通气量和培养液pH。
微藻PUFAs的合成过程需要分子氧的参与,氧的有效性将决定脂肪酸的不饱和程度,培养液中氧浓度的提高能够促进PUFAs的合成。培养液pH的改变影响微藻细胞内外离子平衡、细胞渗透性、藻体内外相关酶的结构和状态、培养液中无机碳的存在形式以及微量金属的存在状态,从而间接影响微藻脂肪酸的组成及含量。
(5)培养期。
处于不同生长时期的微藻具有不同的生化组成。微藻PUFAs的积累与其生长并不一定同步。对于光合自养微藻,在不同的生长时期,其体内脂肪酸各组分的比例不同,而且随着培养时间的延长,不饱和脂肪酸含量通常随着培养时间的过度延长而下降。魏东等(2000)研究了后棘藻7-14(Ellipsoidion sp.7-14)和眼点拟微球藻(N.oculata)不同生长时期的脂肪酸组成。结果表明,两种微藻的总脂肪酸含量均在稳定期达到最大,分别占干重的54.5%和43.3%,但EPA和PUFAs含量在对数早期达到最大,此时总脂肪酸含量最低,仅占干重的22.9%和22.0%。隐甲藻(C.cohnii)在细胞培养初期,细胞生长旺盛,脂肪酸主要用于合成极性脂肪,形成生物膜;培养至稳定期,脂肪含量占干重的24.6%;整个培养过程中DHA含量基本不变,PUFAs含量随培养时间的延长而下降。
(6)培养液的化学组成。
培养液的化学组成(浓度、种类)的改变,不仅会影响微藻的生长,而且会影响微藻细胞内脂肪的积累。氮源是藻类生长最重要的营养元素之一,氮的种类和浓度均能明显影响微藻脂肪酸的组成和含量。Yongamanitchai & Ward(199l)研究了硝酸钠、氯化铵和尿素对三角褐指藻UTEX640(P.tricornutum UTEX640)EPA的影响。结果表明,以氯化铵为氮源时,EPA含量占总脂肪酸的比例最低,为10.1%;以尿素为氮源时,EPA含量占总脂肪酸的比例最高,为31.8%。一般认为,氮浓度较低时,EPA含量随氮浓度的升高而升高,当氮浓度达到一定的水平后,EPA含量随之下降。
碳是细胞的主要组成成分,其含量约占藻体干重的50%。自养微藻培养一般是向培养基中通入不同浓度的CO2或添加碳酸盐的方式补充碳源。CO2浓度对微藻的生长和PUFAs的合成有重要影响,天然海水中无机碳浓度大约为2.2mmol/L,经实验证实,海水中的无机碳无法满足微藻光合作用的需要,在培养液中充入一定浓度的CO2有利于提高微藻的光合作用,促进微藻的生长。
异养培养不仅可以增加微藻的生物量,也能显著提高微藻PUFAs的含量。作为异养培养的微藻,可利用简单的有机碳作为碳源,如甘油、葡萄糖及醋酸盐,其中葡萄糖是工业上常用的有机碳源,可有效地转化为脂肪。
磷源对微藻PUFAs的影响也十分明显,培养液中K2HPO4浓度从0.059 g/L上升至0.5g/L时,三角褐指藻EPA含量占总脂肪酸的比例由20.1%上升到28.4%。硅是硅藻生长、繁殖所必需的元素,培养液中硅的缺乏通常会导致硅藻细胞中脂肪的积累,但硅浓度过高硅藻则表现出一定的毒性。硅浓度为0~50mg/L时,三角褐指藻(P.tricornutum)生物量和EPA含量都较高;培养液中硅浓度超过100mg/L时,三角褐指藻表现出明显的毒性。
一般认为,微藻细胞可以将外源游离脂肪酸转化为细胞内的脂肪。在培养基中添加适量的游离脂肪酸,藻细胞可以直接利用合成其他长链脂肪酸,而不用从头合成。Yongmanitchai & Ward(1991)研究发现藻类吸收油酸后,C16:0和C16:1占总脂肪酸的比例明显提高。纤细裸藻(E.gracilis)利用外源油酸、亚油酸和亚麻酸后,明显促进细胞中的PUFAs的合成,尤其是AA和EPA。但是有报道指出,培养液中游离脂肪酸的存在会抑制其他脂肪酸的合成。培养液中添加油酸的浓度超过1.0g/L时,对微藻EPA的合成产生明显的抑制作用,但总脂肪酸含量增加。
培养液中微量元素存在与否不仅影响藻类的生长,对其脂肪酸组成也有一定的影响。向培养液中添加10~100mg/L的VB12,三角褐指藻总脂肪酸、EPA含量均有明显增加,而添加VB1则没有影响。重金属Cu2+、Zn2+、Cd2+能促进月芽藻(Selenastrum capricornutum)油酸的合成,改变亚油酸的相对比例。
5.发酵液中EPA和DHA的分离与纯化方法
微藻PUFAs的分离纯化技术是根据鱼油的方法演变而来的。下面就目前在PUFAs分离中最常用的方法作简单的介绍。
(1)低温冷冻结晶法。
低温冷冻结晶是利用不同的脂肪酸在低温的有机溶剂中溶解度不同而加以结晶分离。混合脂肪酸通过降温,其中大量的饱和脂肪酸和单不饱和脂肪酸结晶析出,剩下的PUFAs可进一步分离纯化。丙酮、甲醇和乙醇为常用的有机溶剂。低温结晶法工艺原理简单、操作方便,但需要回收大量的有机溶剂,需有极低温的冷却设备,成本费用昂贵,且分离效率不高,产品中EPA和DHA的浓度可达42%~58%,收率为2.8%~26%。
(2)尿素包合法。
其原理是尿素分子在结晶的过程中能与饱和脂肪酸形成稳定的晶体包合物,与单不饱和脂肪酸形成不稳定的包合物,而PUFAs不易被尿素包合。采用过滤的方法除去饱和脂肪酸和单价不饱和脂肪酸,可以获得纯度较高的PUFAs。尿素包合法成本较低,设备简单,试剂便宜,操作简便,尤其是不在高温下进行,能比较完全地保留其营养和生理活性。此法的另一优点是脲包物形成后即可保护双键不受空气氧化。
(3)吸附分离法。
利用选择性吸附剂,例如将Ag+固定在吸附剂载体上,Ag+与PUFAs络合形成稳定的络合物,不同饱和程度的脂肪酸在吸附剂上的分配系数不同而得以分离。此法的优点在于分离效果好,产品纯度高,缺点是分离规模较小,分离成本高,有些洗脱剂容易污染产品。近年来,人们开始采用大型高压液相色谱装置来制备高纯度的多烯不饱和脂肪酸,可适用于较大规模的生产,但一次性设备投资较大。
(4)分子蒸馏法。
该方法的原理是在高度真空下,根据混合物各组分挥发度不同而得以分离。在真空条件下,脂肪酸分子间引力减小,挥发度提高,因而蒸馏温度较低,可以防止PUFAs在蒸馏过程中被氧化。但是在蒸馏过程中需要维持高度真空,能耗较高。
(5)脂肪酶提取法
油脂是由3个脂肪酸与甘油形成的酯。例如DHA大部分键结于甘油的2-位,EPA大部分键结于甘油的2、3-位。故理论上可利用专一性的脂解酶,将甘油的1、3-位的饱和脂肪酸和单元不饱和脂肪酸解离,而使大多数的EPA和 DHA保留在单甘油酯及双甘油酯上。脂肪酶可以对含多种脂肪酸的甘油三酯进行选择性水解,利用脂肪酶这一性质,可以高度富集多不饱和脂肪酸甘油三酯。在具体富集PUFAs的应用中,单单用一种酶催化一步反应难以将PUFAs富集到所需要的含量。而水解、酯交换和酯化反应相结合的多步酶催化富集往往可以达到较好的浓缩效果。浓缩效果可使一种多不饱和脂肪酸的含量超过91%,收率超过88%。
(6)超临界流体萃取法。
超临界流体萃取(supercritical fluid extraction,SFE)技术是近年来迅速发展起来的一项分离技术。具有高效、节能、实用性强等优点,尤其适合热敏感性物质和易氧化物质的分离纯化。其原理是在超临界状态下,从原料中萃取溶质,然后升温和降低压力,溶质和溶剂分离,从而达到分离的目的。最常用的为超临界CO2萃取技术。以往的结果表明,超临界CO2萃取技术可有效地分离碳原子数差别较大的脂肪酸,但对碳原子数相近的长链脂肪酸的分离必须与其他分离技术结合。如单独采用超临界CO2萃取法时,EPA和DHA浓度为57.4%,而与尿素包合法结合使用,EPA和DHA的浓度可达90%以上。
由于PUFAs具有两个或两个以上的双键,很容易被氧化,所以在提取过程中保持PUFAs的稳定性是目前研究的重点。分离纯化的过程中除了考虑成本、分离效果外,反应条件应尽量温和,避免使用有毒的溶剂,如氯仿、甲醇等,要选择符合食品工业要求的溶剂,如乙醇、正己烷。因此一套简便有效,可以用于工业化大量制备的提纯方法有待进一步研究。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。


















