7.4.2 水稻圆锥花序Fe-SOD
7.4.2.1 (Os Fe-SOD)基因特征
编码Fe-SOD的基因是核基因,它们有的属于单拷贝基因,有的属于多基因家族。Leishmania chagasi中存在Fe-SODA和Fe-SODB。Fe-SODA是单拷贝基因,而Fe-SODB则是多拷贝基因,Legionella pneumophila的Fe-SOD也是多拷贝基因,并且该基因的拷贝数与该菌的抗百草枯(Paraquat)能力相关。
水稻圆锥花序Fe-SOD基因(Oryza sativa L Fe-SOD,Os Fe-SOD)的选择性剪接变体包括Os Fe-SODA和Os Fe-SODB,其基因序列已测得。Os Fe-SODB基因有8个外显子和7个内含子。两种Os Fe-SOD亚型mRNA中所有外显子-内含子接合处的序列都符合GT-AG法则。Os Fe-SODB内含子和外显子的平均长度分别为359bp和184bp,内含子和外显子中的GC平均含量分别为37.2%和43.4%。与植物内含子剪切的必要特性一致,Os Fe-SOD内含子富含U核苷酸残基。在限定内含子边界方面起重要作用的富含AU元件在Os Fe-SOD内含子中也有发现。
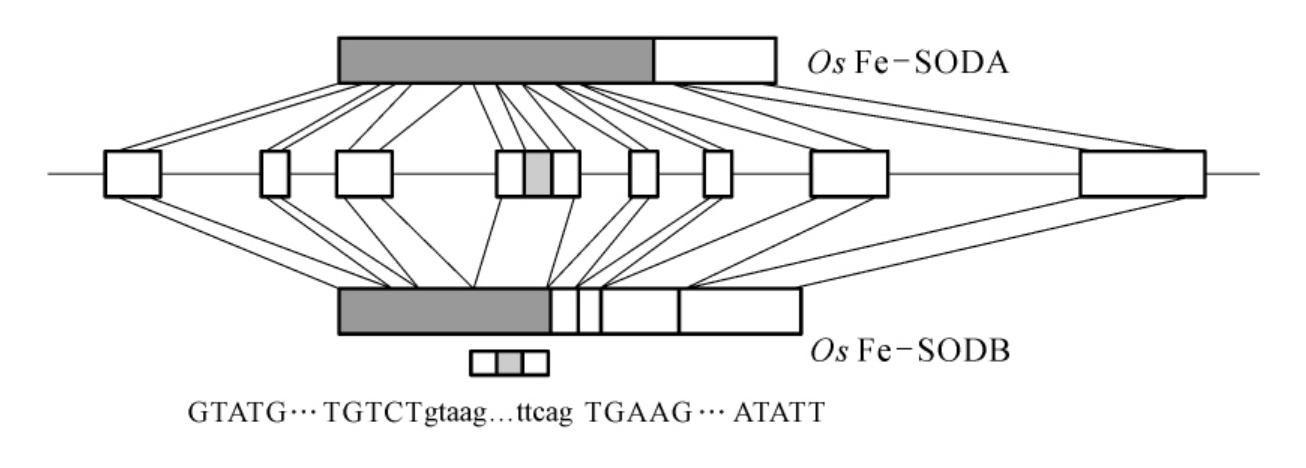
图7-21 水稻Fe-SOD基因的基因组结构
(摘自Wang Jinfa,et al.Plant Cell Rep.,2006)
框显示的是外显子,实框表示编码区,空框代表非编码区。底部显示的是Fe-SODA外显子-内含子(外显子4到5)接合处的核苷酸序列。
7.4.2.2 水稻圆锥花序Fe-SOD表达的调控
Os Fe-SOD的选择性剪接稳定地出现在两个水稻亚种indica和japonica中。两种Os Fe-SOD亚型的表达水平在七个基因型方面是不同的。树叶中Os Fe-SODB的表达水平比Os Fe-SODA的要高,在水稻营养组织中检测到大约1 500nt的单个Os Fe-SODa mRNA。然而,两种Os Fe-SOD转录物在Cpslo17的再生器官中也被检测到,如圆锥花序和种子。两种Os Fe-SOD亚型的表达水平在幼小组织和分生组织中也相当高。Os Fe-SODB在叶和幼花序中高水平表达,而Os Fe-SODA在开花阶段的圆锥花序中表达更加丰富。总之Os Fe-SOD的表达既无组织特异性又无品种特异性。
7.4.2.3 水稻圆锥花序Fe-SOD基因的表达受光和温度的影响
以前,Kaminaka考察过光诱导对水稻变白秧苗中Os Fe-SODa mRNA表达水平的影响。对水稻变白秧苗中两种选择性剪接Os Fe-SOD的表达的观察显示,两种Os Fe-SOD亚型在变白秧苗中都不表达,而两种亚型的mRNA水平在光诱导后稳步增加。而且,诱导Os Fe-SODA产生的转录物水平要高于诱导Os Fe-SODB所产生的。对Os Fe-SOD ORF上游1.3kb长的5′-端序列的仔细观察发现了各种推定的顺式调节元件的存在,如表7-5中所列。用PlantCARE程序对克隆的潜在启动子序列的分析表明,许多调控元件在Os Fe-SOD的启动子区域经常被发现,例如I-box和G-box,在许多光调节的植物启动子中具有重要功能。然而,与这些极丰富的光调节元件相比,ABA应答元件(ABREs)在水稻SODCc2(Cu/Zn-SOD)基因的5-flanking regions中被发现。为了阐明这些元件的功能,需要作进一步的研究,这些元件可能在光刺激Os Fe-SOD的表达中发挥重要作用。
表7-5 Os Fe-SOD 5′-旁侧区的推定顺式作用调控元件

(摘自Wang Jinfa,et al.Plant Cell Rep.,2006)
经过冷处理,发现Os Fe-SODA显著累积,经过2h后,转录物达到最高水平,随后逐渐减少。然而,在转移到4℃时,Os Fe-SODB的表达急剧减少。据推测,植物中经选择性剪切而实现的内含子的保留是由于内含子的较弱识别能力,而不是现时进程抑制剪接反应。在冷处理12h后,Os Fe-SODB转录物的产生被强烈抑制;而Os Fe-SODA的水平保持某种稳定,显示了内含子在低温下的良好识别能力。将秧苗转到28℃后,两种Os Fe-SOD转录物亚型的表达都恢复。上述结果清楚地表明Os Fe-SOD转录物的剪接对低温敏感。
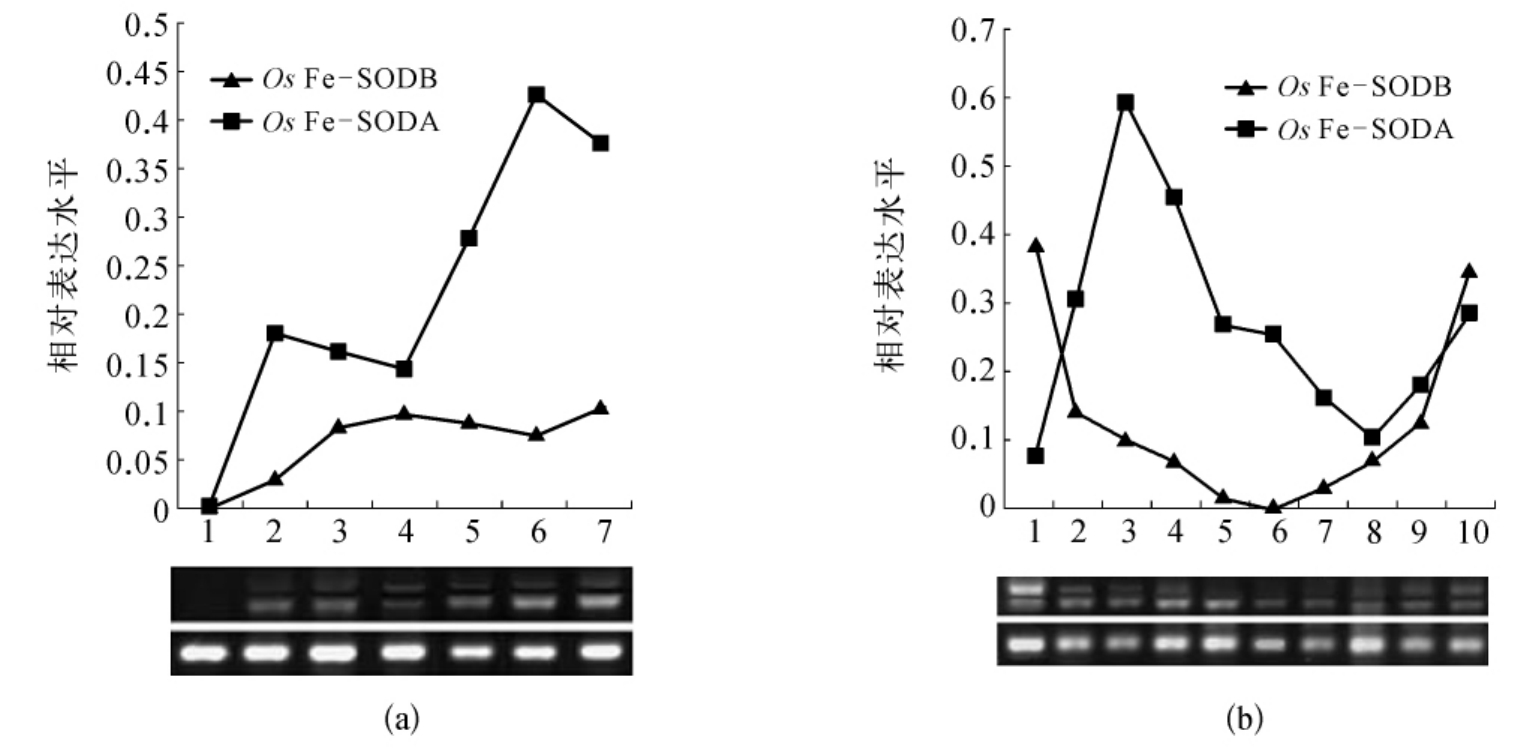
图7-22 选择性剪接Os Fe-SOD转录物的RT-PCR表达分析
(摘自Wang J,et al.Plant Cell Rep.,2006)
一个738bp的Os Fe-SODA片断和一个887bp的Os Fe-SODB片断经过27轮的PCR循环进行扩增。同时,一个335bp的Actin片断也被扩增。
(a)光诱导作用,泳道1,变白秧苗;泳道2,1h;泳道3,3h;泳道4,9h;泳道5,24h;泳道6,36h;泳道7,72h。
(b)冷处理作用,泳道1,处理前;泳道2,4℃处理1h;泳道3,4℃处理2h;泳道4,4℃处理3h;泳道5,4℃处理6h;泳道6,4℃处理12h;泳道7,4℃处理24h;泳道8,放回28℃处理6h;泳道9,放回28℃处理9h;泳道10,放回28℃处理12h。
Fe-SOD大多数为组成型表达,这种酶的量比较稳定。如微生物体内的Fe-SOD在整个生长阶段都比较稳定,只有当微生物处于氧化胁迫时Fe-SOD的表达量才升高。
不同来源的Fe-SOD的基因表达调控有不同的主导因子。原核生物Fe-SOD的基因的表达调控与生长的营养条件、所处环境有直接的关系。而真核来源的Fe-SOD基因的调控则与植物或动物的生长发育阶段、体内激素有关。但不论是原核生物还是真核生物基因的表达调控都是多个因素同时作用的结果。
微生物来源的Fe-SOD的表达与微生物的生长阶段和营养条件有直接的关系。Kim研究Pseudomonas putida发现,该菌存在两种SOD的基因,即Fe-SOD和Mn-SOD。在正常KB培养基上,Fe-SOD在对数期表达量最高,在静止期下降。但如果加入Fe,则Fe-SOD的表达量又升高。如果正常培养基上加入Fe,在整个生长期Fe-SOD都维持较高的水平。同样,Cortez发现Rhodobacter capsulatus的Fe-SOD在完全缺氧或半氧气时表达量很低,而当完全暴露在氧气环境时表达量提高了10倍。
植物来源的Fe-SOD的表达则与植物的生长发育阶段有关,也可能与植物激素的调节有关。当植物处于逆境胁迫时,内源激素和活性氧共同调节Fe-SOD的表达。Crowel和Amasino发现Fe-SOD的表达与叶片是否处于伸展期有关。他们发现在大豆叶片的伸展初期,若去除细胞因子或植物生长因子,则Fe-SOD mRNA迅速大量降低,而在已经伸展的叶片中不存在此现象。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。









![邓[需手动填充]:茶花百咏序](https://file.guayunfan.com/2020/zb_users/upload/2020/09/13.jpg)






