载体是能将目的基因转入宿主细胞内进行表达的DNA分子,往往需要同宿主细胞相互配套。理想载体的基本条件是:①能自主复制;②具有多个限制性内切酶的单一位点即多克隆位点(multiple cloning site,MCS),在这些位点中插入外源基因后不影响其复制功能;③具有1~2个筛选标记;④安全性好,不含对受体细胞有害的基因,不会任意转入其他生物的细胞;⑤易于操作,转化效率高。
目前可以满足上述条件的载体多为人工构建,研究者可以根据研究目的、载体的结构及性质,从种类繁多的商品化载体中进行选择。
根据功能和用途不同,载体又可分为克隆载体(cloning vector)和表达载体(expression vector)两类。
一、克隆载体
克隆载体用于在宿主细胞中克隆和扩增目的基因片段。这类载体含有复制信号序列,可以在宿主细胞中复制,得到高拷贝数的DNA分子,但由于不含有启动子序列或者启动子序列不被宿主细胞RNA聚合酶识别而不能表达。以大肠杆菌为宿主的克隆载体主要有质粒、噬菌体、黏粒。
例如,pBR322质粒是被研究得最多、使用最早且应用最广泛的大肠杆菌质粒载体之一(图8-1),其长度为4 363bp,有24种限制性核酸内切酶的单一识别位点,载体中包括两个标记基因:一个是氨苄青霉素抗性基因(Ampr);另一个是四环素抗性基因(Tetr)。该质粒具有以下4个特点:①相对分子质量较小;②带有一个复制起始位点,保证了该质粒只在大肠杆菌的细胞中行使复制的功能;③具有两种抗生素抗性基因,可供转化子的选择标记;④具有较高的拷贝数,经过氯霉素扩增以后,每个细胞中可累积1 000~3 000份拷贝。上述特性为制备重组体DNA提供了极大的方便。
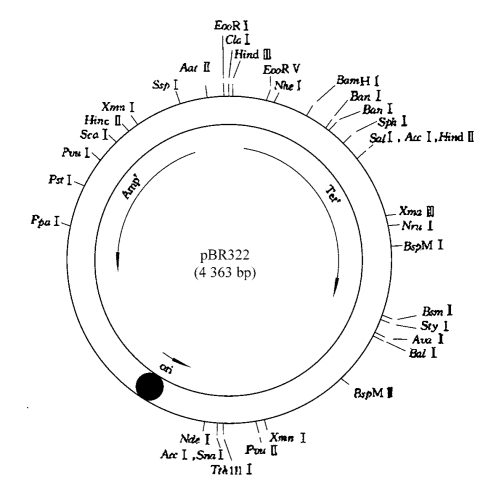
图8-1 质粒载体pBR322图谱
PCR产物克隆的一种常用策略是TA克隆:利用大部分耐热性DNA聚合酶进行PCR反应时都有在PCR产物的3'末端添加一个“A”的特性,将PCR产物与带有3' T黏性末端的载体(T载体)连接成重组子。TA克隆大大提高了PCR产物的连接、克隆效率。如图8-2所示,pMD® 18-T 载体(TakaRa公司)是一种高效克隆PCR产物的专用载体,它是在pUC18载体基础上改建而成的,在pUC18载体的多克隆位点处的Xba I和Sal I识别位点之间插入了EcoR V识别位点,用EcoR V进行酶切反应后,再在两侧的3'末端添加“T”而成。载体中含有一个氨苄青霉素抗性基因(Ampr),一段β-半乳糖苷酶基因(lacZ基因)可用于蓝白斑筛选。

图8-2 pMD® 18-T载体图谱
二、表达载体
表达载体用于在宿主细胞中获得外源基因的表达产物(蛋白质)。外源基因的表达涉及正确的基因转录、翻译及适当的转录后、翻译后加工修饰过程。在不同的表达系统中表达,过程亦不相同。通常将表达系统分为原核表达系统和真核表达系统两大类。原核表达系统中常用的载体包括经过改造的质粒、λ噬菌体衍生载体等。而真核表达系统中常用的载体包括SV40衍生载体、反转录病毒载体、腺病毒载体等。此类载体中通常含有病毒的启动子序列,可以被真核细胞的RNA聚合酶识别而表达。
例如,猿猴空泡病毒40(Simian vacuolating virus 40,SV40)是迄今为止研究得最为详尽的乳多空病毒(Papova viruses)之一。目前所用的SV40载体都是经过改造的,通常只保留SV40的复制起始区域和早期区域启动子以及多聚腺苷酸化位置和小t抗原的内含子。图8-3介绍的是一个典型的哺乳动物基因载体pSV2:a区包含SV40的复制起始区、72 bp的增强子序列、早期区域启动子和转录起始位置;b区包括原核生物的基因序列,即大肠杆菌pBR322质粒的复制起点区和氨苄青霉素抗性基因;c区包含SV40小t抗原基因的内含子(拼接信号)和多聚腺苷酸化位置,这种设计使质粒既能在大肠杆菌中扩增,又能直接用于转染哺乳动物细胞;d区专门容纳需要表达的编码序列,其中包括目的基因和标记基因。由于这类载体不通过包装过程,故可插入10kb以上的外源片段。这些序列可在SV40的早期区域启动子控制之下得到表达,且受侵染的动物细胞不会裂解,因而可建立稳定的细胞株,通过使用标记基因,可从低转染率的群体中,筛选出转化株。值得注意的是,由于pSV2不存在SV40的大T抗原编码区,故不能在猴细胞中复制。因此,pSV2载体在哺乳动物细胞中稳定增殖的唯一途径是整合到宿主染色体上。这种整合非常稳定,即使转化细胞在非选择条件下培养100代后,重组基因仍不会发生丢失或重排。
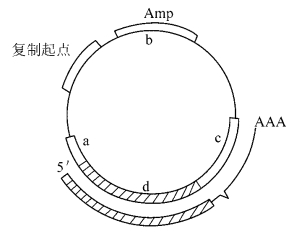
图8-3 pSV2载体
图8-4是两个从pSV2派生的系列载体,其中一个含有标记基因Ecogpt,另一个含有Econeo。
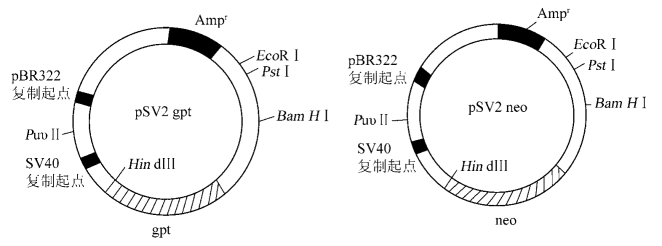
图8-4 两种常用的哺乳动物基因转移载体pSV2 gpt和pSV2 neo
gpt-Ecogpt基因;neo-Econeo基因
慢病毒(Lentivirus)属于反转录病毒科(Retrovidae),为RNA病毒。慢病毒如同其他反转录病毒,可以将前病毒基因组持久地整合到感染细胞的染色体上并且在感染的细胞和子代细胞中表达病毒基因,可以作为将目的基因引入细胞的载体(图8-5)。慢病毒载体(Lentivirus vectors)与简单的反转录病毒载体相比,具有可感染分裂细胞及非分裂细胞、转移基因片段容量较大、目的基因表达时间长、不易诱发宿主免疫反应等优点,因而备受关注。以HIV-1为基础的慢病毒基因转移载体是目前研究最为透彻的慢病毒载体。其构建原理就是将HIV-1基因组中的顺式作用元件(如包装信号、长末端重复序列)和编码反式作用蛋白的序列进行分离。大多数这类慢病毒载体是以HIV基因组为基础进行改造的,慢病毒中的顺式和反式作用元件可被分隔开并保留其功能。慢病毒包装系统能反式提供包装细胞内病毒颗粒组装所必需的蛋白。载体结构中包括了病毒顺式作用元件、包装序列、Rev反应元件(Rev response element,RRE)以及所需转移基因。长末端重复序列(long terminal repeat,LTR)的U3区域附近序列中包括了多嘌呤管道(polypurine tract,PPT)。慢病毒中包含的中心多嘌呤管道(central polypurine tract,cPPT)是下游正链合成起始位点。上游的cPPT元件可促进HIV-1改造载体的基因组进入核内,从而显著提高其在体内的转导效率。慢病毒载体的另外一个重要的改进是序列中包括了一些顺式作用转录调控元件(cis-acting transcriptional regulatory elements),如WPRE,该元件可以增强靶细胞中转基因的表达。此外,发展可调控的慢病毒载体使得所转移的目的基因可以被四环素诱导表达。

图8-5 慢病毒表达载体系统
(A)野生型HIV前病毒的结构示意图。(B)新一代的SIN-慢病毒载体结构中包括了中心多嘌呤管道(cPPT),可增强载体在靶细胞中的核转位能力。序列中还包括了WPRE。黑三角形代表SIN突变位点,RRE代表Rev反应元件。(C)第三代tat-缺失的非重叠分裂基因组包装系统。一个质粒编码gag和pol蛋白,而rev则在另一个质粒上反式表达,还有一个编码水泡性口炎病毒G蛋白(VSV-G)的包膜蛋白的质粒
慢病毒包装系统中用VSV-G代替HIV包装糖蛋白可使慢病毒载体的设计更符合基因转移和基因治疗的需求。除了扩大了载体转移的宿主范围之外,VSV-G假型慢病毒的主要优势在于病毒颗粒易于通过包装细胞中收集的细胞培养基的超速离心而浓缩。为了减少包装系统中HIV编码序列的数量,第二代包装系统仅仅保留了HIV-1病毒基因组中gag、pol、tat和rev基因,广泛去除了其他非主要的基因序列。所去除的基因(vpr、vpu、vif和nef)往往不是病毒颗粒合成所必需的。第三代包装载体则去除了HIV-1中的tat基因,并将剩余的HIV基因组分割为两个表达载体。而HIV-1基因组的5'端的LTR区域内的启动子/增强子序列则被CMV或RSV等的组成性启动子所替代,所形成的载体能够在缺少tat的情况下在包装细胞内进行有效转录。慢病毒载体可以通过瞬时转染进入293T包装细胞随后可以通过超速离心浓缩病毒颗粒。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。
















