观察和研究严重烧伤后多器官功能障碍综合征(MODS)的病理学变化,对于揭示烧伤后MODS的发病机制、损伤特点和病程规律,探索预防和治疗措施具有重要的理论与实际意义。解放军总医院第一附属医院收集了十余年来的20余例烧伤后严重脓毒症与MODS患者尸检各脏器标本和6种MODS动物模型材料,较全面、系统地对MODS分期进行了组织病理学与超微结构的观察与研究。由于人体标本所观察到的均为MODS终末衰竭期,即MOF期的脏器标本,不能全面和动态地分析烧伤后MODS的病理变化规律与特点,尤其缺乏早期的研究资料。所以,还采取了一些在多年研究工作中先后复制出的山羊、犬、兔、大鼠与小鼠MODS动物模型材料,来替代和补充说明烧伤后MODS的病理变化。参照动物实验和临床病程,将MODS病理变化分为两期来表述:早期,指伤后数小时至24h,均为实验动物标本;MODS期,指伤后7~12d。临床人体尸检标本均属MODS期病例。所述病理改变以人体尸检材料为主,实验动物材料为辅。
一、肺
(一)肉眼观察
1.早期 肺叶较饱满,肺体积增大,重量增加,表面可见深红色瘀斑。切面湿润、有水肿液体流出。
2. MODS期 双肺饱满,重量可增至正常肺的数倍,肺表面灰白色与灰红色区相间,可见斑片状暗红色出血斑。切面溢液,肺质地实变。
(二)光镜观察
1.早期 肺间质水肿,表现为支气管与小血管周围间隙加宽形成“水肿套”,以及肺泡隔疏松变宽。肺间质血管扩张、充血,间质小血管与肺泡隔毛细血管腔内见中性白细胞与单核细胞聚积,充塞管腔,形成所谓“中性粒细胞扣压现象”。肺间质小血管周围多见淋巴细胞浸润,浸润淋巴细胞可呈袖套状分布,形成所谓“淋巴细胞浸润套”。免疫荧光与免疫组化标记(S-100、CD11c、CD205、CD1a等)发现,在血管旁与肺泡隔中的间质树突状细胞数量也明显增加。肺泡隔轻度增厚,锇酸碘化钠(OSO4-NaI)染色见肺泡Ⅱ型上皮细胞增生。部分病例可见灶状肺泡水肿和局灶性肺泡出血。
2. MODS期 肺间质重度水肿,血管扩张淤血,部分小血管及肺泡隔毛细血管内多见微血栓形成。肺泡隔增厚,其中可见慢性炎细胞、大单核细胞及肺泡Ⅱ型上皮细胞浸润增生。CD11c+间质树突状细胞数量继续增加,而成熟、活化的CD205+与CD86+树突状细胞含量明显减少。多数病例见弥漫性肺泡水肿及肺泡出血,肺泡水肿表现为肺泡腔充满粉红色水肿液并伴有退变的肺泡巨噬细胞、白细胞及脱落的肺泡Ⅱ型上皮细胞,部分晚期病例肺泡水肿液消散固缩,在肺泡表面形成一层红染的薄膜状结构,即所谓“透明膜”(图3-2)。部分病例可见支气管肺炎病灶及灶性肺萎缩改变。较严重的病例表现为肺泡腔弥漫性大片出血和肺间质出血,后者可在小血管周围形成“出血套”。
(三)电镜观察
1.早期 肺泡隔毛细血管内皮细胞胞质基质水肿,吞饮泡增多。血管周与肺泡隔中树突状细胞体积增大、胞突延长。毛细血管腔内见较多中性粒细胞聚集并与管壁内皮细胞黏附。肺泡壁厚部间质纤维结构疏松,形成电子密度降低的水肿区。肺泡Ⅰ型上皮细胞基质水肿,线粒体肿胀;肺泡Ⅱ型上皮细胞明显增生及板层体增多。肺泡巨噬细胞数目增多,体积增大,溶酶体增生,表面微绒毛增多延长。肺泡腔内可见少量水肿蛋白颗粒及肺泡巨噬细胞(图3-3)。血管内皮与肺泡上皮细胞的连接结构损伤:冷冻蚀刻显示细胞连接条索断离及严重损毁,硝酸镧示踪可见细胞连接处充有大量高电子密度的镧颗粒,提示通透性增加。
2. MODS期 毛细血管内皮细胞明显水肿,线粒体肿胀、絮状变及空化变,胞质饮泡增多并形成大疱(图3-3),内皮间紧密连接松解形成裂隙。部分内皮细胞结构模糊,胞膜崩解。毛细血管腔内见粒细胞与血小板增多、聚集,局部与管壁内皮细胞黏附,并见一些细胞碎片和颗粒状物。基底膜水肿、不规则增宽,局部形成裂隙样空腔;肺泡壁厚部与肺间质纤维结缔组织疏松水肿,偶见淋巴细胞浸润。血管周与肺泡隔中的树突细胞(dendritic cell)体积明显减小,呈现退变和凋亡改变。部分病程较长病例伴有成纤维细胞与胶原纤维增生。肺泡Ⅰ型上皮细胞明显肿胀(图3-4),上皮表面胞质形成芽突样结构。部分病例Ⅰ型上皮胞质高度水肿形成大泡,局部上皮结构模糊或溶解脱落,基底膜裸露变形。在Ⅰ型上皮表面可形成一厚层由致密蛋白颗粒及板层体样物等构成的膜状物,即光镜“透明膜”的超微结构。肺泡Ⅱ型上皮细胞呈现较广泛的修复性增生,并见部分Ⅱ型上皮板层体排空现象。肺泡巨噬细胞退变萎缩,表面微绒毛短缩或脱落消失,溶酶体排空呈蜂窝状。肺泡腔水肿液成分混杂,含有纤维蛋白颗粒、纤维素样物质、细胞碎片、少量红细胞,以及一些凋亡退变的脱落的Ⅰ型上皮、Ⅱ型上皮、肺泡巨噬细胞及白细胞等。

图3-2 严重烧冲复合伤临床病例(肺组织学改变)
肺泡水肿,肺泡腔表面形成深染的半透明膜样结构(HE×200)

图3-3 兔MODS模型(肺组织)
A.致伤早期,肺泡隔略增厚,肺泡腔内见有少量纤维蛋白颗粒及肺泡巨噬细胞;B.病程晚期(MODS期),肺泡腔内填塞有大量红细胞、粒细胞、肺泡巨噬细胞及纤维蛋白性渗出颗粒(SM×750)

肺泡Ⅰ型上皮重度水肿、增宽,肺泡隔毛细血管内皮形成数个水肿空泡(EM×5000)
图3-4 大鼠30%烧伤脓毒症模型(肺泡改变)
二、肝
(一)光镜观察
1.早期 肝窦扩张、充血,可见炎细胞浸润。肝细胞胞质浑浊肿胀、疏松及嗜酸性变,少见脂肪变性。少数病例可见肝细胞点状坏死。酶学染色示肝细胞内ACP酶含量明显增高,而ATP酶减少。小叶中央区库普弗细胞显著增生、肿胀。过氧化物酶染色显示库普弗细胞数目增多、体积增大。肝细胞胞质PAS阳性反应明显减弱,而库普弗细胞PAS阳性反应明显增强。提示致伤早期库普弗细胞功能活跃。部分病例汇管区轻度水肿伴慢性炎细胞浸润。
2. MODS期 肝窦内多见浸润的中性粒细胞和一些退变萎缩的单个核细胞。肝细胞胞质疏松、嗜酸性变与脂肪变性(图3-5),多见肝细胞灶状坏死,坏死灶周围可见大量中性粒细胞等炎细胞浸润(图3-6)。严重病例可见肝细胞大片状坏死和肝出血改变。部分病例可见肝细胞出现核分裂象等肝细胞再生现象。酶学染色示肝细胞内ACP酶与ATP酶含量均呈明显减少。过氧化物酶染色可见小叶中央区库普弗细胞数目减少、体积萎缩。PAS染色示库普弗细胞反应明显减弱,提示库普弗细胞功能衰退。汇管区水肿增宽及慢性炎细胞浸润。
(二)电镜观察
1.早期 肝细胞内质网增生及扩张,部分线粒体肿胀呈絮状变性,胞质周围部溶酶体增多。部分病例可见肝细胞胞质内小灶性坏死。毛细胆管轻度扩张,微绒毛肿胀。硝酸镧示踪见毛细胆管内充满高电子密度的镧颗粒,肝细胞线粒体内及其膜上均有镧颗粒沉积。提示在致伤早期,肝细胞膜与肝细胞连接结构的通透性增加,呈现病理性损伤。肝窦内皮细胞水肿及线粒体肿胀。库普弗细胞体积增大、核糖体增生,溶酶体增多。
2. MODS期 肝细胞胞质线粒体肿胀、絮状变及髓鞘样变(图3-7),内质网增生、扩张及脱颗粒,溶酶体增多,可见大小不等的脂滴。肝细胞核仁浓缩,异染色质边移,部分肝细胞核固缩。坏死区肝细胞崩解:细胞膜消失,胞质电子密度降低,线粒体稀疏散在,伴有淋巴细胞等炎细胞浸润。肝细胞间毛细胆管明显扩张,微绒毛减少或脱落消失。肝窦内皮细胞基质水肿、线粒体肿胀及空泡化,次级溶酶体增多。狄氏隙略增宽,微绒毛肿胀(图3-8)。窦腔内可见退变的炎细胞、细胞碎片及泡状结构,并见血小板及粒细胞与肝窦内皮黏附现象。库普弗细胞萎缩,细胞器固缩或空泡变,溶酶体明显减少或排空,胞核固缩凋亡。狄氏隙增宽,微绒毛肿胀、脱落,其中可见坏死细胞碎片。

图3-5 大鼠30%烫伤脓毒症模型(肝)
肝小叶中央区重度脂肪变性,伴有点灶状坏死和肝窦淤血(HE×左100、右200)

图3-6 严重烧伤后MODS临床病例(肝)
肝细胞片状坏死伴大量以中性粒细胞为主的炎细胞浸润(HE×200)
三、心肌
(一)光镜观察
1.早期 心肌间质水肿,血管扩张充血,少数病例心内膜下与心肌间质中可见出血灶(图3-9)。心肌纤维浑浊肿胀,局部可见单个心肌纤维均质红染。苏木素-碱性复红-苦味酸(HBFP)染色可以看到更多的呈点状分布的心肌纤维变性红染病灶。
2. MODS期 心肌间质与心内膜下明显水肿,可见片灶状出血。小血管周围可见慢性炎细胞浸润。多见单个心肌纤维或小灶状心肌组织变性坏死改变,表现为肌纤维固缩红染、结构模糊或空泡样溶解变性。苏木素-碱性复红-苦味酸(HBFP)染色可见心肌组织中有较多的成片的变性坏死灶。部分病例可见大片状心肌纤维断裂、分离现象。
(二)电镜观察
1.早期 心肌间质与心肌纤维基质水肿,线粒体肿胀、嵴断裂。硝酸镧示踪可见心肌线粒体膜上及线粒体内有镧颗粒沉积,示膜性结构破坏。

图3-7 大鼠MODS模型(肝)
肝细胞线粒体肿胀、絮状变,并形成髓鞘样结构(左)和凝聚小体(右)(EM×22000)

图3-8 兔间甲酚烧伤脓毒症模型(肝)
肝窦内皮细胞核固缩、线粒体肿大及空泡变性,并形成数个次级溶酶体。狄氏隙增宽,微绒毛肿胀、脱落。邻近肝细胞线粒体肿胀及絮状变(EM×12000)

图3-9 严重烧伤后MODS临床病例(心脏)
心内膜表层结构模糊,内皮下大片状出血。心肌纤维固缩红染,间质水肿(HE×100)
2. MODS期 心肌间质弥漫水肿,间质小血管扩张,内皮细胞肿胀、细胞器变性、饮泡增多,胞质形成指状突起,内皮连接松解增宽。血管管腔内可见白细胞、单核细胞及血小板聚集附壁现象。心肌纤维细胞核异染色质浓染边集,核周胞质内溶酶体增多。心肌纤维基质电子密度降低呈重度水肿改变,肌原纤维排列疏松,Z带增粗、排列紊乱,呈颗粒状分解。肌原纤维呈凝聚变性,基质电子密度增高。或见肌丝分离、溶解,局部肌原纤维消失(图3-10)。线粒体肿胀、增生,伴脂性致密物沉积,或呈絮状变、髓鞘样变及空泡化。心肌闰盘扩张、松解,可见泡状颗粒。

图3-10 山羊MODS模型(心脏)
心肌纤维肌丝分离、溶解及灶状坏死崩解(EM×7500)
四、胃肠道
(一)肉眼观察
1.早期 胃肠黏膜局部呈深红色充血改变。
2. MODS期 小肠黏膜面呈节段性片状出血和糜烂,部分病例出现黏膜溃疡。
(二)光镜观察
1.早期 胃肠道壁各层血管扩张、充血,肠壁小血管腔内中性粒细胞聚集,周围淋巴细胞浸润伴间质水肿。肠壁水肿主要表现在黏膜上皮下形成一疏松的水肿区。
2. MODS期 小肠绒毛大部溶解消失,固有膜中大量淋巴细胞浸润,上皮下明显水肿。局部胃与小肠黏膜上皮坏死脱落伴灶性出血(图3-11)。
(三)电镜观察
1.早期 胃黏膜上皮表面微绒毛减少、变短,胞质线粒体肿胀、内质网扩张;胃底腺颈黏液细胞分泌颗粒增多;壁细胞基质水肿,线粒体肿胀;小肠黏膜上皮表面微绒毛变短及减少,上皮基质水肿,线粒体肿胀、嵴断裂,或见线粒体絮状变,以近上皮表面明显。上皮下间质水肿。硝酸镧示踪见小肠吸收上皮细胞连接结构中有镧颗粒通过,提示在损伤早期就存在上皮通透性增加的病变。
2. MODS期 胃与肠道黏膜上皮表面微绒毛倒伏、变短、稀疏及脱落,胞质分泌颗粒明显减少,线粒体髓鞘样变或空化变,内质网扩张脱颗粒。部分小肠黏膜上皮细胞腔面膜破坏,细胞器消失或结构模糊,胞质灶性溶解、溢出(图3-12);局部黏膜上皮崩解、脱落,伴炎细胞浸润。小肠吸收上皮细胞间紧密连接结构松解、增宽,或形成较大空泡。上皮下间质水肿伴淋巴细胞浸润。
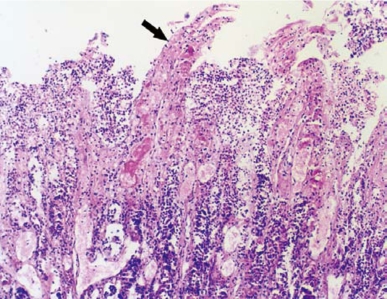
图3-11 犬MODS模型(小肠)
小肠绒毛(↑)溶解变性,上皮细胞脱落,固有层大量炎细胞浸润伴灶性出血(HE×100)
五、肾
(一)光镜观察
1.早期 肾小球毛细血管扩张充血,肾小球体积增大。部分肾小球可呈缺血改变。肾小球系膜区轻度增宽,系膜细胞略增生。肾小管(近曲小管为主)上皮细胞浑浊肿胀,部分病例有颗粒变性和空泡变性。酶学染色显示近曲小管上皮细胞内ACP酶含量显著增多,而ATP酶含量减少。肾间质轻度水肿,血管扩张充血。
2. MODS期 肾间质充血、水肿,伴淋巴细胞、单核细胞浸润。肾小球多呈缺血改变,毛细血管腔闭塞或扩张,球丛呈分叶状。肾小球毛细血管内有微血栓(透明血栓)形成(图3-13)。PAS染色显示肾小球系膜区明显增宽及系膜细胞增生。肾小管上皮细胞多呈颗粒变性与空泡变性,可见胞核深染固缩,TUNEL标记见胞核呈深棕色,提示细胞凋亡改变。部分病例可见肾小管上皮坏死脱落,管腔内可见透明管型和细胞管型。酶学染色显示近曲小管上皮细胞内ACP酶与ATP酶含量均显著减少。较严重病例可见肾组织片灶状出血、坏死。

图3-12 大鼠MODS模型(小肠)
小肠黏膜上皮表面微绒毛短缩、倒伏及脱落,吸收上皮细胞腔面膜破坏,细胞器消失或结构模糊,胞质灶性溶解坏死(EM×8000)
(二)电镜观察
1.早期 肾小球毛细血管内皮胞质局部基质水肿,部分内皮细胞膜失去小窗状结构。细胞核向管腔突起。肾小球足细胞基质水肿,局部足突融合。系膜区电子致密物增多,并见系膜细胞增生。近曲小管上皮细胞线粒体肿胀、嵴断裂或消失,胞质基质灶性水肿,管腔面胞质溶酶体增多,胞核异染色质边集。远曲小管上皮表面微绒毛肿胀、变短或倒伏,胞质基质灶性水肿,细胞器稀疏,线粒体肿胀或呈空泡状。硝酸镧示踪见肾小管上皮细胞间隙与上皮细胞胞浆基质及线粒体膜上均有大量高电子密度的镧颗粒沉积(图3-14),提示在损伤早期肾小管上皮细胞连接结构破坏。
2. MODS期 肾小球毛细血管内皮增生、肿胀及空泡变性,内皮窗孔消失,胞膜腔面形成小突起,呈现内皮芽生现象。管腔内血小板附壁。基底膜厚薄不均及灶性疏松,或见空泡样结构。肾小球脏层上皮(足细胞)胞质基质水肿,线粒体肿胀,内质网扩张,大片足突融合(图3-15)。肾小球系膜区高电子致密物质显著增多,系膜细胞明显增生。肾小管上皮微绒毛稀疏或脱落,胞质基质水肿,线粒体肿胀、嵴断裂,多呈空泡变性,近管腔面溶酶体空化及含量减少。尚见肾小管上皮细胞坏死崩解改变。

图3-13 严重烧伤后MODS临床病例(肾小球)
肾小球毛细血管内微血栓形成(↑)(HE×400)

图3-14 大鼠MODS模型(肾小管)
肾小管上皮细胞间隙与上皮细胞基质及线粒体膜上均有大量高电子密度的镧颗粒(↑)沉积,提示膜通透性增加(EM-硝酸镧示踪×4000)

图3-15 兔MODS模型(肾小球)
正常肾小球(左图)脏层上皮(足细胞)足突结构清晰、排列密集;MODS期(右图)肾小球足细胞胞体肿胀,足突明显增粗及融合(SM×8000)
六、脑
(一)光镜观察
1.早期 软脑膜及脑实质内血管扩张充血,部分病例可见微血管周围水肿套。
2. MODS期 脑实质小血管周围明显水肿,可见小灶状出血。多见神经细胞变性,表现为两种形态:①水肿变性,神经细胞体积增大,胞核固缩偏位;②细胞凋亡,神经细胞胞体瘦长、萎缩,体积变小,胞质稀少,核质固缩深染,细胞周围形成空隙。这类神经细胞对TUNEL标记呈胞核深棕色阳性表达。凋亡的神经细胞周围常围绕一些浸润的小胶质细胞。构成所谓“噬节现象”(图3-16)。部分病例小胶质细胞灶性增生。
(二)电镜观察
1.早期 毛细血管内皮细胞局灶性基质水肿,线粒体肿胀,其基底膜外相邻胶质细胞终足扩张、水肿。
2. MODS期 毛细血管内皮细胞弥漫性基质水肿,线粒体肿胀及空化变性,毛细血管基膜外的神经胶质细胞终足高度扩张、水肿及空泡样变,在血管周围形成低电子密度水肿区(图3-17)。变性神经细胞呈两种形态:①明细胞:胞体肿大,基质电子密度降低,细胞器稀疏,胞核变小,异染色质边聚;②暗细胞,即凋亡细胞:胞体缩小,呈三角形或锥形,染色质凝集深染。胞质浓缩稀少,细胞器萎缩且模糊不清。胞质与胞核呈现较均一的高电子密度。且多见小胶质细胞包绕和吞噬凋亡萎缩的神经细胞现象(噬节现象)。胶质细胞胞质基质水肿,线粒体肿胀及空泡变性。易见小胶质细胞凋亡现象。

图3-16 犬严重烧伤后MODS模型(大脑皮质)
大脑皮质神经细胞核质深染,周围见一些小胶质细胞浸润,形成“噬节现象”(HE×400)

图3-17 严重烧伤后MODS临床病例(大脑皮质)
大脑皮质区间质毛细血管内皮细胞基质水肿,线粒体肿胀,基膜外神经胶质细胞终足(E)高度扩张、水肿,在血管周围形成较宽的低电子密度水肿区(EM×2500)
七、脾
(一)光镜观察
1.早期 伤后数小时,脾窦扩张、充血。脾的白髓面积增大,淋巴细胞密集丰富,脾小体增生,滤泡生发中心扩大。边缘带增宽,淋巴细胞数目增多。在白髓边缘区和红髓脾索内树突细胞数目大量增生且体积增大,高表达S-100、CD1a、CD11c、CD205、CD86、CD80和HLADR,同时伴有巨噬细胞增生。伤后24h以上,进入首次打击期,脾病变表现为:红髓内中性粒细胞浸润增多。白髓面积缩小,淋巴细胞稀少,边缘区缩窄,脾小体萎缩及数目减少。一些动脉周围淋巴鞘的淋巴细胞消散,红、白髓界限不清。白髓、动脉周围淋巴鞘和脾索内出现大片凋亡的淋巴细胞,TUNEL标记阳性。动脉周围淋巴鞘和脾索内树突细胞和巨噬细胞数量仍然较多。
2. MODS期 脾白髓萎缩,脾小体数目减少体积缩小或消失。动脉周围淋巴鞘细胞明显减少,小淋巴细胞呈片灶性凋亡分解。一些病例白髓淋巴细胞严重减少,动脉周围仅余少许稀疏分布的淋巴细胞(图3-18)。白髓动脉周围淋巴鞘与红髓交织融合,白与红髓分界不清。在白髓边缘区或动脉周围稀疏分布的淋巴组织中仍见较多S-100、CD11c、CD205及CD1a表达阳性的树突状细胞(图3-19),但此期树突细胞对CD86、CD80和HLA-DR表达明显减少,而PD-L1表达增高,提示树突细胞出现免疫耐受。部分临床病例脾窦与脾索中有较多巨噬细胞和大量中性粒细胞浸润,并见梁索溶解坏死及噬红细胞现象。少数病例可见脾组织片灶状出血,或见动脉周围淋巴鞘大部消散,形成袖套状出血带。

图3-18 严重烧伤后MODS临床病例(脾)
脾白髓动脉周围淋巴鞘消散,淋巴细胞明显减少,脾小体消失(HE×200)

图3-19 严重烧伤后MODS临床病例(脾)
脾白髓中央动脉周围树突细胞数目(B)较正常对照组(A)显著增多(免疫组化双标记:CD1a膜红染/S-100浆黑染×400)
(二)电镜观察
1.早期 多见白髓淋巴细胞退变及凋亡早期改变,凋亡细胞表现为:细胞核固缩或异染色质凝集成块、沿核膜分布成花环状,胞质浓缩、细胞器萎缩。少数淋巴细胞核崩解、破碎,核碎片和胞质成分形成凋亡小体。部分淋巴细胞线粒体肿胀肥大,局部空泡化,嵴排列紊乱,内质网扩张。红、白髓交界区树突细胞数目明显增加,胞体增大,形状不规则,细胞表面的指状突起较长且增多,胞核异染色质增粗,胞质细胞器增多,部分细胞线粒体明显增生,伴空泡变性(图3-20)。树突细胞周围凋亡淋巴细胞增多。红髓及脾索内巨噬细胞体积增大,溶酶体增多,吞噬变性淋巴细胞与凋亡小体。多伴有中性粒细胞浸润。脾窦内皮细胞肿胀,线粒体退变。

图3-20 小鼠MODS模型(脾)
脾白髓边缘区树突细胞(↑)胞体增大,形状不规则,细胞表面的指状突起较长且增多,胞核异染色质增粗,胞质细胞器增多。周围见一些凋亡及凋亡早期淋巴细胞围绕(EM×4000)
2. MODS期 白髓小淋巴细胞分布松散,散在的淋巴细胞胞核均质深染,胞质浓缩凝聚,呈现凋亡改变(图3-21)。一些淋巴细胞胞质空化松解,表现为溶解变性。树突细胞数目虽较正常情况明显增多,但大部分树突细胞胞体萎缩、结构模糊、突起变短,呈现破碎溶解及凋亡改变,其周围可见一些凋亡淋巴细胞及凋亡小体。脾窦与脾索内巨噬细胞增生伴有中性粒细胞浸润。巨噬细胞数目增多,体积增大,基质水肿,线粒体肿胀空化,内质网扩张,溶酶体明显减少,可见其吞噬大量凋亡小体、细胞碎片及红细胞(图3-21)。部分巨噬细胞退变呈现核浆固缩或大空泡状变性。脾脏间质血管内皮与脾窦内皮肿胀增生,线粒体肿胀及空化变性。脾窦内可见较多纤维蛋白颗粒、泡状结构、细胞碎片、凋亡小体及退变的粒细胞。
(陆江阳 刘 茜)

图3-21 大鼠MODS模型(脾)
脾白髓淋巴细胞呈凋亡与凋亡早期改变,淋巴细胞核固缩、异染色质凝集成块,沿核膜分布成环状(↑)。一巨噬细胞体积明显增大,胞质内充有大量淋巴细胞凋亡小体(EM×3000)
参考文献
[1] 柴家科,盛志勇,陆江阳,等.成批烧冲复合伤患者的临床救治.中华创伤杂志,2007,23(1):57-61.
[2] 陆江阳,王晓虹,刘茜,等.52例多器官功能障碍综合征尸检脾脏及其树突状细胞的病理学观察.诊断病理学杂志,2007,14(1):12-16.
[3] 陈意生,史景泉,程天民,等.现代烧伤病理学.北京:化学工业出版社,2008.
[4] 刘茜,陆江阳,王晓虹,等.MODS小鼠脾脏树突状细胞对 PD-L1、PD-1表达变化与意义.解放军医学杂志,2010,35(1):15-17.
[5] 陆江阳,梁延杰,胡森,等.山羊多器官衰竭病理形态学观察.中华外科杂志,1996,34(2):117-119.
[6] 王宏伟,陆江阳,王晓虹,等.多器官功能障碍综合征小鼠肺间质树突状细胞的病理学观察.中华病理学杂志,2007,36(5):307-312.
[7] 陆江阳,李志宏,王晓虹,等.脾脏树突状细胞在MODS中的变化与意义.中国危重病急救医学,2006,18(1):24-28.
[8] 孙宇,陆江阳,王晓虹,等.小鼠迟发型多脏器功能障碍综合征模型复制及病理学观察.中国危重病急救医学,2003,15(1):15-18.
[9] 陆江阳,梁延杰,李玲,等.电镜硝酸镧示踪技术用于脏器早期损伤的观察.中华病理学杂志,1995,24(2):99.
[10] 周萍,黄宏,陈林.烧伤后大鼠肝脏的病理形态学变化与肝功能的关系.中国危重病急救医学,2002,14(4):201-205.
[11] 孙永华.烧伤脓毒症与多器官功能障碍综合征.中华烧伤杂志,2001,17(2):189-190.
[12] 贾晓明,朱兆明,梁延杰,等.烧伤大鼠早期脏器通透性变化与病理改变的联系.军医进修学院学报,1998,19(2):93-96.
[13] 陆江阳,梁延杰,李玲,等.多器官衰竭早期免疫器官细胞凋亡的检测及意义.解放军医学杂志,1996,21(5):415-417.
[14] 郑怀恩,程天民,林远,等.烧伤、冲击伤和烧冲复合伤大鼠肺微血管超微结构病变.中华整形外科杂志,1995,11(6):425-428.
[15] 胡森,盛志勇,薛丽波,等.创伤后多系统器官衰竭动物模型的实验研究.中华整形烧伤外科杂志,1992,8(1):2-7.
[16] Yang HM,Sheng ZY,Guo ZR,et al.Oxygen free radical injury and its relation to bacterial and endotoxin translocation after delayed fluid resuscitation:clinical and experimental study.Chin Med J,1997,110(2):118-124.
[17] Faries PL,Simon RJ,Martella AT,et al.Intestinal permeabilty eorrelates with severity of injuin trauma patients.J Trauma,1998,44(6):1031-1035.
[18] Eiseman B,Beart R,Norton L.Multiple organ failure.Surg Gyencol Obst,1997,144(3):323-326.
[19] Mishima S,Yukioka T,Matsuda H,et al.Mild hypotension and body burns synergistically increase bacterial translocation in rats consistent with a “two-hit phenomenon”.J Burn Care Rehab,1997,18(1pt1):22-26.
[20] Bone RC:Immunologic dissonance.A continuing evolution in our understanding of the systemic inflammatory response syndrome(SIRS)and the multiple organ dysfunction syndrome(MODS).Ann Int Med,1996,125(8):680-687.
[21] Bone RC.Sir Isaac Newton,sepsis,SIRS,and CARS.Crit Care Med,1996,24(7):1125-1128.
[22] Beal AL,Cerra FB.Multiple organ failure syndrome in the 1990-systemic inflammatory response and organ dysfunction.JAMA,1994,271(3):226-233.
[23] Sauaia A,Moore FA,Moore EI,et al.Early predictors of postinjury multiple organ failure.Arch Surg,1994,129(1):39-45.
[24] Sheng ZY,Yang HM.The concept and diagnosis of multiple system organ failure.Chin Med J,1994,107(8):563-569.
[25] Bennett NT,Schultz Gs.Growth factors and wound healing:biochemical properties of growth factors and their receptors.Am J Surg,1993,165(6):728-737.
[26] Deitch EA.Multiple organ failure:pathophysiology and potential future therapy.Ann Surg,1992,216(2):117-134.
[27] Fry DE.Multiple system organ failure.St Louis:Mosby Year Book,1992.
[28] Carrico CJ,Meakins JL,Fry D,Maier RV.Multiple organ failure syndrome.Arch Surg,1986,121(2):196-208.
[29] Goris RJ.Multiple organ failure and sepsis without bacteria.Arch Surg,1986,121(8):897-901.
[30] Goris JA,de Boekhorst TP,Nuytinck JK,et al.Multiple organ failure:generalized autodestructive inflammation.Arch Surg,1985,102(10):1109-1115.
[31] Tilney NL,Bailey GL,Morgan AP.Sequential system failure after rupture of abdominal aortic aneurysms:an unsolved probIem in postoperative care.Ann Surg,1973,178(2):117-122.
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。
















