狂犬病(rabies)是由狂犬病病毒所致的一种人兽共患急性中枢神经系统感染性传染病,临床上表现为急性、进行性、几乎不可逆转的脑脊髓炎,常有恐水怕风、咽肌痉挛、进行性瘫痪等典型临床症状,因恐水症状比较突出,又称恐水症(hydrophobia)。至今尚无有效的治疗办法,病死率极高,近100%。狂犬病多见于犬、狼、猫等肉食动物,人多因病兽咬伤而感染。在世界大部分地区流行。
【病原学】
1.病原的发现 狂犬病是一种古老的传染病,在我国古代医书中很早就有对狂犬病的记载,古称“疯狗病”。18世纪,狂犬病曾一度在欧洲流行。由于没有有效防治办法,病死率极高。1881年法国巴斯德认为狂犬病的病原体是极小的生物,1888年Roux首次分离出狂犬病毒。1903年,Negri在狂犬病人尸体的脑部发现了具有诊断价值的包涵体,并在试验接种动物的神经细胞胞浆内观察到包涵体。1962年应用感染鼠肾细胞培养粗制品及负染技术,首次在电镜下发现狂犬病毒,1年后,对狂犬病毒的形态与结构特征进行了描述。随后,在鸡胚组织、神经组织中成功增殖了狂犬病毒,从而促进了对狂犬病毒及其生物学、免疫学和病理学特征的进一步认识。
2.病原结构 狂犬病毒在病毒分类学上属单股负链病毒目、弹状病毒科,狂犬病毒属,是单股不分节片负链核糖核酸(RNA)病毒。弹状病毒科病毒分两个属,水疱性口炎病毒属和狂犬病毒属,此外还有未定属的植物弹状病毒。本科病毒中能感染人类、构成对人类威胁的只有狂犬病毒,狂犬病毒是狂犬病毒属的典型种。从感染动物或病人中发现的狂犬病毒称野毒或街毒,街毒经过系列传代适应特定宿主后称固定毒。
狂犬病毒典型形态酷似子弹,一端圆凸,一端平直或凹进,直径65~80µm,长130~240µm。病毒粒子由感染细胞浆膜表面芽生形成,病毒颗粒的外壳由一个双层脂膜构成,表面嵌有10nm长的由病毒糖蛋白构成的包膜突起如钉状覆盖了除平端外的整个病毒表面。来自宿主细胞浆膜的脂质外壳的内侧是膜蛋白,亦称基质蛋白。膜蛋白内侧为病毒的核心,即核衣壳,由核酸和紧密包围在外面的核蛋白所构成。
狂犬病毒RNA基因组长12 kb,编码5种病毒蛋白质,核蛋白(N蛋白)、磷蛋白(P蛋白,原名M1)、基质蛋白(M蛋白,原名M2)、包膜糖蛋白(G蛋白)及转录酶大蛋白(L蛋白)。RNA与核蛋白结合成核糖核蛋白,结构紧密的RNP与转录酶大蛋白、磷蛋白共同组成毒粒核心,构成完整的狂犬病毒核衣壳,控制RNA的转录与复制。基质蛋白是狂犬病毒最小的结构蛋白质,连接病毒外膜及膜上糖蛋白和核衣壳。糖蛋白是一种典型跨膜蛋白质,能诱导产生中和抗体和刺激细胞免疫,是有效的保护性抗原;也可识别易感细胞膜上特定的病毒受体,是狂犬病毒与细胞受体结合的结构,与病毒毒力直接有关。核蛋白抗原,可使体内产生补体结合抗体和沉淀素,无保护作用。
狂犬病毒对神经组织有较强亲嗜性。在易感动物或人的中枢神经细胞(主要是大脑海马回的锥体细胞)中增殖时,可在胞质内形成嗜酸性、圆形或椭圆形的包涵体,称内基小体,有诊断价值。
狂犬病毒对外界的抵抗力不强。易被强酸、强碱、甲醛、碘、乙醇等灭活。肥皂水、离子型或非离子型去垢剂等对病毒亦有灭活作用。
3.理化特性 狂犬病毒由24%类脂、30%糖类、10%RNA、72%蛋白质组成。对外界抵抗力不强,一般的消毒药、加热和日光照射都可以使它失去活力,其悬液经56℃30~60min或100℃ 2min即灭活,对肥皂水等脂溶剂、酸、碱、45%~70%乙醇、甲醛、碘制剂、苯扎溴铵等敏感,但不易被来苏水灭活,磺胺药和抗生素对狂犬病毒无效。在PH 3.0~11.0稳定,-70℃或冻干0~4℃存活多年。冬天野外病死的狗脑组织中的病毒在4℃下可保存几个月,对干燥、反复冻融有一定的抵抗力。
4.分型 狂犬病毒的分类不断变化,按照与血清和单克隆抗体的抗原交叉反应情况,该属最初分为4个(1-4)血清型。以后在欧洲和澳大利亚进一步分离出新的蝙蝠狂犬病毒,在几种基因(N、P和G)遗传定性研究方面也获得进展,支持分为7种基因型(表26-1)。
表26-1 狂犬病毒的分类

(续 表)
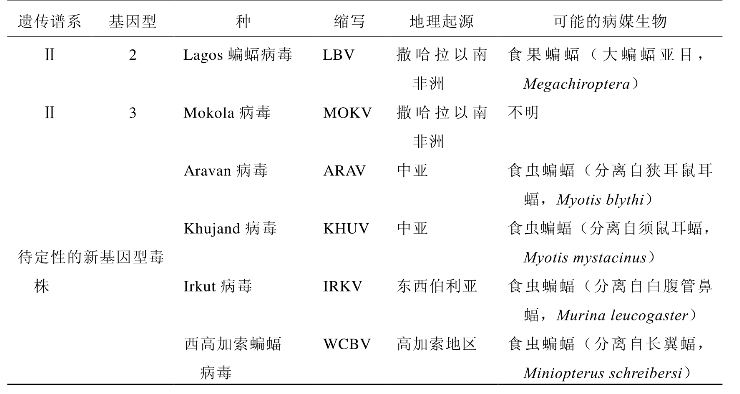
基因型1是传统的狂犬病毒,广泛分布于全世界的家养或野生动物中。基因型2-7的地理分布和宿主范围相对较窄,到目前为止,大多数仅分布于欧洲和澳大利亚。蝙蝠是目前已经定性的7种基因型中6个基因型的宿主和病媒生物(基因型3的准确宿主尚待确定)。5种基因型以蝙蝠为唯一的病媒生物;只有基因型1的病媒生物尚包括陆地病媒生物(主要是食肉动物)。
每个基因型包括不同亚型,亚型是指在特定地域和(或)动物宿主中流行的变异株。所有基因型归并为2个遗传谱系,遗传谱系Ⅰ(基因型1、4、5、6和7)和遗传谱系Ⅱ(基因型2和3)。每个遗传谱系中的病毒,在致病性、诱导细胞凋亡、细胞受体识别等生物特性上有所不同。同一遗传谱系内的狂犬病毒之间能够交叉中和(G蛋白胞外段的氨基酸一致性>74%),但不同遗传谱系之间无交叉中和反应(胞外段的氨基酸一致性<62%)。目前所获得的实验证据表明,疫苗株(都属于遗传谱系Ⅰ中的基因型1型)不能保护免于遗传谱系Ⅱ中的狂犬病病毒的感染。
【流行病学】
1.地理分布 狂犬病是一种古老的自然疫源性疾病,公元前2300年即有疯犬咬伤引起人狂犬病的记述。广泛地存在于世界各地,所有温血动物都能感染,欧洲、亚洲、非洲、美洲、大洋洲均有病例报道。
(1)亚洲和非洲:近年,全球狂犬病引起的人类死亡几乎都发生在亚洲和非洲。估计每年犬狂犬病造成55 000人的死亡,其中56%发生在亚洲,44%发生在非洲;大多数死亡(84%)都发生在农村地区。如果不采取预防措施(即暴露后预防),预计亚洲和非洲死于狂犬病的总人数将达330 304人。印度是世界上狂犬病流行最严重的国家,每年约有20 165人死于狂犬病,每年接受暴露后治疗的人约2.3百万,更多被动物咬伤的人没有接受暴露后治疗;暴露后治疗人群中30%~50%为5~14岁儿童。菲律宾在过去10年中,平均每年发生人狂犬病258~591例,其中405例为儿童。越南每年有3百万人接种狂犬病疫苗,其中99%是神经组织疫苗,1%是细胞培养疫苗,人狂犬病例数已经从10年前的每年数百例下降到近几年的每年数十例。
我国是世界上狂犬病高发区之一,公元前556年《左转》已有狂犬病的记载。1949年后我国把狂犬病列为乙类传染病管理,建国初期狂犬病报告发病率较低,4个省份有狂犬病报告,每年发病40~463例。到20世纪60年代中期狂犬病发病人数有所增多,每年为103~1 062例,仍呈散发状态。之后由于全国各地养犬数量增多,对犬的管理和免疫措施不到位,狂犬病流行范围逐年扩大。1971年全国14个省份有狂犬病病例,1988年发展到25个省份,每年报告病例4 110~7 028例。到1991年几乎全国各省、自治区、直辖市均有病例报告。由于1981年起开始用原代地鼠肾细胞狂犬病疫苗,使用量逐年增大,人狂犬病疫情急剧下降,由1990年3 520例降至1993年的500例,1994年为302例,1995年进而降至200例,发病率降至最低。之后因宠物增多等原因,病例开始上升,如1997-1999年分别222、229、343例。2002年全国发病总数1 122例,比1996年增加7.06倍,2003年发病2 009例,死1 827例,病死率近100%,死亡人数为法定传染病的首位。
非洲于1772年由英国输入首例狂犬病。动物和人狂犬病的传染源以犬为主,其次是豺、狐等野生动物。非洲的病原型复杂。
(2)欧洲:赤狐是狂犬病毒的最主要宿主。人狂犬病主要来源于野生动物,1993-2002年,欧洲报道人狂犬病117例,病人主要分布在东欧。政府通过对狐狸大范围口服疫苗免疫措施,近10年来,动物狂犬病已经下降,西欧国家已控制和消灭陆生动物狂犬病。
最近,证实貉也是当地野生动物狂犬病的独立宿主。欧洲大部分国家都存在蝙蝠狂犬病。感染狂犬病毒的蝙蝠,可在无任何异常情况下长期携带狂犬病毒,并从唾液中排出。新出现和狂犬病毒的变异株可能会对公众健康带来不可预知的危害。
(3)美洲:南美1803年在秘鲁发现狂犬病。20世纪初,美洲地区阿根廷、玻利维亚、墨西哥、巴西、委内瑞拉、巴拉圭和圭亚那等国发生蝙蝠狂犬病的流行。2002年拉丁美洲报告35例人狂犬病,比2001年报告发病数60例下降42%,拉美地区人狂犬病发病率保持下降趋势。35例中巴西报告10例,与其10年前的年发病50例相比大幅度下降。位于北美洲的美国和加拿大只有少数病例发生,2002年美国仅在加利福尼亚、得克萨斯、内阿华州报告3例,有几个州正努力消灭浣熊狂犬病。但美洲动物间狂犬病流行仍然非常严峻,据SIRVERA记录,拉丁美洲农村诊断的带狂犬病病毒蝙蝠从1996年的92只上升到2002年的205只,2002年还诊断了其他94只野生动物,包括臭鼬、浣熊、狐狸等,2004年,由动物传播的人狂犬病达47例。
一些国家与地区通过实行严格的动物检疫等措施,消灭了狂犬病,如挪威自1815年、瑞典自1879年先后消灭了狂犬病,随后英国、日本、中国台湾、新加坡、莱索托、马尔他、牙买加和塞浦路斯等消灭了本地狂犬病。根据1999年世界狂犬病调查报告,145个国家和地区中有45个没有狂犬病报告。没有狂犬病报告的国家与地区为发达地区的岛屿如日本、新西兰,一些发展中国家如巴贝多、斐济、马尔代夫和塞舍尔,欧洲大陆的北部和南部地区,包括希腊、葡萄牙、挪威、瑞典、丹麦、冰岛和芬兰,拉丁美洲的智利和乌拉圭。在北美和欧洲,人狂犬病多为异地感染后入境的输入性病例。
2.流行特征 狂犬病农村多于城市,病例中有3/4发生在农村,死亡病例中绝大多数是儿童和青少年。全年发生,晚春到初秋多见,男多于女。与接触动物机会多有关。
3.传染源 人狂犬病传染源主要是犬、猫等家畜以及狐狸、狼、吸血蝙蝠、獴、浣熊、臭鼬等野生动物。在发展中国家,以家畜为主,在发达国家,以野生动物为主。
狂犬病的自然宿主,开始为狼、狐豺、山狗、臭鼬、浣熊和蝙蝠等野生动物。在欧洲、亚洲早有狼、狐狂犬病发生,北美有蝙蝠狂犬病的流行,美国1990-2005年的39起人类感染狂犬病事件中,31起与蝙蝠有关。目前作为狂犬病宿主与媒介的野生动物种类繁多,如在美洲达30种以上,特别是具有抓咬袭击性强的动物或吸血蝙蝠为主要储存宿主,广泛分布于各地区或特定地区,如西欧的狐、狼、獾、豺与欧洲的蝙蝠等动物及美洲的臭鼬、蝙蝠、浣熊、狐、猫鼬等。在西班牙与泰国也发现蝙蝠狂犬病。
犬狂犬病原系由野生动物中传来,但在许多国家犬密度很高,与人接触机会多,已成为长期的储存宿主与主要传染源。
一切温血动物都可感染狂犬病,但敏感程度不一,哺乳类动物最为敏感。在自然界中狂犬病曾见于家犬、野犬、猫,狼、狐狸、豺,獾、猪、牛、羊、马、骆驼、熊、鹿、象、野兔、松鼠、鼬鼠等动物。禽类则不敏感。鸡、鸭、鹅、孔雀等也可以发生狂犬病,但疾病的发展过程较慢,通常呈麻痹型。鸭对狂犬病毒有较强的抵抗力,只有29%可以出现神经症状,其中许多鸭子仍能存活。一切冷血动物如鱼、蛙、龟等可以抵抗狂犬病毒的感染。许多种类动物对狂犬病易感,但并不进一步传播狂犬病,它们是狂犬病的受害者并常常为流行的终端。
国内人狂犬病的主要传染源是犬,由犬传播者占92%左右,其次为猫,偶尔为牛、猪、马、骡和驴等家养动物。一般于狂犬病症状出现前3~7d,少数14d,其唾液内即含有病毒。除感染发病的“疯狗”等动物外,表面正常的犬等也可作为传染源,近年国内报道外观健康家犬带毒率为3%~17%。印度报道1例为家犬所伤死去的儿童狂犬病者,该家犬健在4年之久,并13次从其唾液中分离到狂犬病毒。我国云南、贵州、安徽、湖南等相继有无症状病毒携带犬伤人的报道,致病比例为17.82%~52.38%。
4.传播途径 狂犬病病毒主要通过皮肤伤口和无损伤的正常黏膜感染人体。患狂犬病动物的唾液中含有大量狂犬病毒,唾液中狂犬病毒通过动物咬抓伤口,或污染新鲜伤口创面或黏膜而进入机体,未经觉察的小伤口亦可成为狂犬病毒侵入的门户。少数通过宰杀病畜、剥皮、切割等过程感染。
狂犬病病毒可以通过呼吸道传染。已有实验室工作人员因气雾感染狂犬病的报道。将狼、狐置于带毒蝙蝠岩洞中或带毒封闭实验室内可发生狂犬病。
狂犬病病毒可经口感染。动物实验表明,小啮齿类、狐和蝙蝠均可经口感染。动物群间的互相吞食狂犬病动物尸体,可能成为狂犬病传播的途径之一。
患狂犬病动物的血、尿和乳、汗中有时亦含有较大量的病毒,蝙蝠的乳、汗中,发现过狂犬病病毒,有因哺乳而患狂犬病的报道。
人与人的一般接触不会传染狂犬病。理论上被狂犬病人咬伤,有得狂犬病的可能。器官移植可传播狂犬病。2004年在美国1个未诊断为狂犬病的病人过世之后捐献内脏,获得捐献的3个人因狂犬病身亡。
5.人群易感性 不同性别、年龄、职业人群对狂犬病普遍易感,狩猎者、兽医及饲养动物者、狂犬病毒实验室工作人员有更多的感染机会。全年均可发生,在我国夏秋季报道的病例数明显高于其他季节,这一现象的产生,与夏秋季人们穿衣单薄、人畜外出活动多,人与发病动物的接触机会多有关。农村青少年与病兽接触机会多,故发病者也多。
人被病犬咬伤后的平均发病率为15%~20%,被病狼咬后为50%~60%(均指未做预防注射者)。发病与否与下列因素有关:①咬伤部位,头、面颈、手指等处的发病机会较多;②创伤程度,创口深而大者发病率高,头面部深伤者的发病率可达80%左右;③局部处理情况,咬伤后迅速彻底清洗者的发病机会较少;④衣着厚薄,冬季衣着厚,受染机会少;⑤注意疫苗情况,及时、全程、足量注射狂犬疫苗者的发病率低。国内报道全程注射后的发病率为0.15%(国外为0.016%~0.48%),未注完全程者为13.93%。咬伤后若及时、足量、全程接种疫苗者,发病率可低于1%。
【临床表现与相关疾病鉴别】
1.致病机制 狂犬病毒大量存在于狂犬的唾液中,当人被狂犬咬伤以后,病毒自破损的皮肤或黏膜侵入人体,病毒先在伤口附近的骨骼肌细胞少量增殖,经肌肉神经接头进入周围神经组织,以每天8~22mm的速度沿外周神经轴索向中枢神经扩展,在脊髓的背根神经节大量繁殖并很快进入脑,出现典型症状。同时病毒沿传出神经离心性扩散,到达各器官、组织,特别是唾液腺。严格嗜神经毒,不侵入血流,不形成病毒血症。
病理变化主要为弥漫性脑脊髓膜炎,以大脑海马回及脑干部位(中脑、脑桥及延髓)及小脑损伤为主。外观有水肿、充血、微小出血等。特异性变化是神经细胞浆内嗜酸性包涵体,称内基小体,常见于海马回,直径3~20µm,呈梭形、圆形、椭圆形,嗜酸性着色(樱桃红色)其中常可见嗜碱性小颗粒,发现内基小体可作为诊断狂犬病的依据。
2.临床表现 狂犬病的潜伏期短则3d,长至数年或10年以上,多数1~3个月,文献记载最长19年。国内报道平均66.9d,超过1年者不足1%。4%~10%的潜伏期超过半年。潜伏期的长短取决于机体的抵抗力强弱(儿童较短)、进入人体内病毒的数量多少和病毒的毒力大小(毒力强者潜伏期短),以及咬伤部位(头面部咬伤的发病较早,平均39d,下肢咬伤潜伏期平均90d)、伤口深浅(深者潜伏期短)等因素,其他如扩创不彻底、外伤、受寒、过度劳累等,均可能使疾病提前发生。
根据狂犬病临床表现特点,结合病程演变和病理改变,将狂犬病分为狂躁型(脑炎型)、麻痹型(静型,亦称哑型狂犬病)两型。
(1)狂躁型:病理损伤主要在脑干、颈神经或更高部位的中枢神经系统、病程进展迅速而凶险。具有恐水、恐风等狂犬病的典型表现,临床经过分为前驱期、兴奋期和瘫痪期。
①前驱期。在潜伏期终了,兴奋状态出现前,症状复杂多样。大部分病人有全身不适,倦怠无力、食欲缺乏、和(或)发热、咳嗽等上呼吸道感染为主的早期临床表现。继之对疼痛、声音、光亮和风开始敏感,而有咽部紧缩感等具有狂犬病重要诊断意义的早期症状。由于病毒繁殖刺激神经元,特别是感觉神经元,有40%~80%的病人在已愈合的伤口及伤口附近或神经通路上出现烧灼感,麻木感,间歇性或持续性针刺样疼痛、瘙痒或似小虫爬行等感觉,并可从肢体远端呈向心性波及躯体各部位,甚至全身。此时尚能吞咽,症状可持续数小时至数天。本期持续1~3d,很少超过4d。
②兴奋期(痉挛期)。病人逐渐进入高度兴奋状态,表情极其恐怖、烦躁不安。由于迷走神经核、舌咽神经核和舌下神经核受损,引起呼吸肌、吞咽肌痉挛,出现恐水、怕风、吞咽困难、呼吸困难等。恐水是绝大多数狂躁型狂犬病特有症状之一,因咽肌痉挛引起,不一定每例均有,也不一定在早期出现。典型病人见水、闻流水声、饮水或仅提及饮水时,均可引起严重咽喉肌痉挛。病人虽渴而不敢饮,即使饮后也无法下咽。常伴声嘶及脱水。怕风亦是狂躁型狂犬病病人特异性症状,即使是微风,也能激惹病人咽肌痉挛。病人对声音、光亮、触动等任何刺激均特别敏感,均可导致同样发作,严重发作时,尚可出现全身疼痛性抽搐。由于常有呼吸肌痉挛,故可导致呼吸困难及发绀。常见交感神经功能亢进,表现为唾液分泌增多、大汗淋漓、心率增快、血压及体温升高等。因括约肌功能障碍而出现排尿排便困难者也相当多见。
病人的神志大多清楚,虽极度恐惧和烦躁不安,但绝少有侵犯人行为。随着兴奋状态的增长,部分病人可出现精神失常、谵妄、幻视幻听、冲撞、号叫等。病人可能在发作中死于以中枢性呼吸衰竭为主的混合型呼吸衰竭或循环衰竭。本期持续1~3d。
③瘫痪期。兴奋期持续1~3d后,痉挛抽搐逐渐停止,病人似乎逐渐趋于安静,少数病人有短暂的一过性理智状态表现。但很快出现各种弛缓性瘫痪症状,尤以肢体软瘫较多见。病人迅速由安静进入昏迷状态,呼吸逐渐减弱,血压逐步下降,迅速死于呼吸、循环和全身衰竭。本期仅持续6~18h。
狂犬病的整个病程一般不超过6d,偶见超过10d。
(2)麻痹型:除上述典型病例外,尚有以瘫痪为主要表现的“麻痹型”或“静型”,也称“哑狂犬病”,约占20%。病理损害主要在脊髓和延髓,而不累及脑干或更高部位的中枢神经系统。该型病人无兴奋期及恐水现象,而以高热、头痛、呕吐、咬伤处疼痛开始,继而出现肢体软弱、腹胀、共济失调、肌肉瘫痪、大小便失禁等,呈现横断性脊髓炎或上升性脊髓麻痹等症状。咽喉肌、声带麻痹而失音讲不出话,故称“哑狂犬病”。病程可达10~20d或更长,由于病程相对延长,可争取更多抢救时机,病死率相对低于狂躁型,直接致死原因多由于严重呼吸肌麻痹和呼吸衰竭。吸血蝙蝠啮咬所致的狂犬病常属此型。
3.诊断标准 狂犬病诊断标准来自于国家技术监督局、卫生部颁布《狂犬病诊断标准及处理原则》(GB17014-1997),适用于各级、各类医疗、保健卫生防疫机构人员对狂犬病的诊断报告和处理。诊断原则主要依据本病的流行病学史及典型独特的临床表现。
(1)流行病学史:有被犬、猫或其他宿主动物舔、咬史。病前有被犬、猫、狼或其他可疑动物咬伤、抓伤、舔伤或上述动物的分泌物、排泄物沾染创伤和黏膜史。
(2)临床症状:①愈合的咬伤伤口或周围感觉异常、麻木发痒、刺痛或蚁走感,出现兴奋、烦躁,对外界刺激如风、水、光、声等异常敏感;②“恐水”症状,伴交感神经兴奋性亢进(流涎、多汗、心率快,血压增高),继而肌肉瘫痪或脑神经瘫痪(失音、失语、心律失常)。
(3)实验室诊断:①免疫荧光抗体检测抗原,发病第1周内取唾液、鼻咽洗液、角膜印片、皮肤切片,用荧光抗体染色,狂犬病病毒抗原阳性;②存活1周以上者做血清中和试验或补体结合试验检测抗体,效价上升者,若曾接种过疫苗,效价需超过1∶5 000;③病人死亡后的脑组织标本分离病毒阳性或印片荧光抗体染色阳性或脑组织内检测到内基小体。
(4)病例分类:临床诊断病例具备流行病史+临床症状①或②。确诊病例为临床诊断病例+实验室诊断的任何一条。
4.鉴别诊断 病人有被狂犬病动物咬伤史,如出现恐水、怕风等典型临床表现,容易诊断。但对于儿童及咬伤史不明确者及处于前驱期的病人,症状不典型,容易误诊,应注意鉴别。
(1)破伤风:有外伤史或旧法接生史,潜伏期较短,大多1~2周,全身肌肉阵发性痉挛,表现牙关紧闭,苦笑面容,腹肌紧张、角弓反张等特点。无高度兴奋、畏风、恐水、流涎现象。及时治疗预后较好。
(2)脊髓灰质炎:无恐水症状,肌痛较著,瘫痪时其他症状大多消退。
(3)病毒性脑膜脑炎:其他脑炎常表现为高热、肌肉痉挛、不同意识障碍,剧烈头痛,喷射性呕吐,但无恐水、流涎表现,早期鉴别不易。必要时可进行血清学、病毒学、病理学及脑脊液检查,予以确诊。有严重神志改变及脑膜刺激征,脑脊液发现,免疫学试验及病毒分离等均有助于鉴别。
(4)类狂犬病性癔症病人:癔症病人在被动物咬伤后几小时或1~2d出现咽喉紧缩感,兴奋、恐惧、甚至出现恐水表现,但病人无发热、畏风、流涎,经暗示、说服、对症治疗后,常可迅速恢复。
(5)狂犬疫苗接种后脑炎:多在首剂狂犬疫苗注射后2周发生,主要表现为发热、关节酸痛、肢体麻木以及各种瘫痪,无恐水和高度兴奋,与麻痹型狂犬病不易鉴别。在使用疫苗过程中逐渐加重,停止接种后,采用糖皮质激素治疗,多数病人可恢复。死亡病例需经免疫荧光试验或脑组织内基氏小体检查方能确诊。
【实验室诊断】
只有实验室检查才能确诊狂犬病。狂犬病是目前已知传染病中病死率最高的,因此,应重视狂犬病实验室安全防护工作,狂犬病实验室设施要符合基本设计,工作人员应穿戴好防护设备(如服装),并进行暴露前接种。开展诊断和动物处理等常规的实验室放松作,需要在生物安全Ⅱ级实验室进行,在某些情况下,如生产大量浓缩病毒、进行会产生气溶胶的操作等,可考虑采用生物安全Ⅲ级的措施。
1.检测标本的采集 活体诊断可利用分泌物、生物体液(唾液、脊髓液、泪液等)和组织进行狂犬病的活体诊断。样本应在-20℃或以下保存。死后诊断最好采集脑组织样本。
2.血、尿常规及脑脊液 周围血白细胞总数为(12~30)×109/L,中性粒细胞一般占80%以上。尿常规检查可发现轻度蛋白尿,偶有透明管型。脑脊液压力可稍增高,细胞数稍增多,一般不超过2×108/L、主要为淋巴细胞,蛋白质增高,糖及氯化物正常。
3.免疫学试验 包括狂犬病抗体与抗原的检测。
(1)检测组织或培养细胞中的狂犬病毒抗原:荧光抗体(FA)技术是一种诊断动物和人狂犬病的快速而敏感的方法,它是狂犬病诊断的金标准。病人的脑脊液或唾液直接涂片、病人角膜印片或咬伤部位皮肤组织或脑组织印片或冷冻切片,丙酮固定,抗狂犬病毒特异性荧光抗体直接染色。其原理是直接把荧光色素标记在已知的特异性抗体上,与玻片上的未知抗原起反应,以鉴定未知抗原。
(2)快速酶联免疫吸附诊断法检测狂犬病毒抗原:用pH=9.6的碳酸盐缓冲液稀释的抗狂犬病毒核衣壳IgG包被96孔酶标板,4℃过夜;用含0.3%牛血清白蛋白和5%蔗糖的pH=9.6的碳酸盐缓冲液封闭30min;将采集到的标本研磨,用pH=7.4 PBS制成30%的悬液,离心取上清液加入酶标板孔内,同时设阴性、阳性对照,每孔200 µl,37℃孵育1h;洗板4次后每孔加入纯化的酶标记抗狂犬病毒核衣壳抗体200 µl,37℃ 1h后洗板,加入酶底物,室温作用30min,2mol/L H2SO4终止反应,肉眼观察或酶标仪测定结果。该法速度快,可用于流行病学调查。
(3)狂犬病毒特异性抗体检测:WHO推荐使用快速荧光灶抑制试验(rapid fluorescent focus inhibition test,RFFIT)或荧光抗体病毒中和试验检测血清或脑脊液中的中和抗体。当不能使用RFFIT方法时,可应用纯化狂犬病糖蛋白的酶联免疫吸附试验,来确定人和某些动物血清中的抗糖蛋白抗体水平。
自然感染早期,狂犬病毒不侵入血液,不能形成病毒血症,许多狂犬病人在发病早期血清中查不到抗体或抗体滴度很低。血清中和抗体通常于病后第6日测得,病后第8日,50%血清为阳性,第15日时全部阳性。疫苗注射后,中和抗体大多高于10U,临床病人可达640U。脑脊液中很少发现狂犬病抗体。WHO狂犬病专家委员会认为,狂犬病疫苗免疫后血清中和抗体水平≥0.5U/ml,表示能得到有效的保护。
快速荧光灶抑制试验时倍比稀释已经灭活的血清样品,同时设阴、阳性血清对照。病毒用标准固定毒CVS株,细胞用BHK21细胞系。比较实验组和阴性血清组的荧光灶,实验组中能使荧光灶抑制50%以上的血清最高稀释倍数,即为被检血清的中和抗体滴度。
4.狂犬病毒核酸的检测(RT-PCR) 以特异性扩增核蛋白(N)基因最保守区域为目的基因,设计1对引物,N1(+)为5'-587TTTGAGACTGCTCCT TTTG605-3';N2(-)为5'-1029CCCATATAGCATCCTAC1013-3'。唾液、脑脊液、皮肤或脑组织标本以及感染病毒后的细胞培养物或鼠脑均可用于病毒核酸的检测。基本步骤为待检标本用细胞总RNA分离试剂提取病毒RNA,再通过反转录反应合成与目的基因RNA序列互补的cDNA,PCR循环特异性扩增目的基因cDNA,电泳检测PCR扩增产物,判断检测结果。
5.病毒分离 有活检与尸检两个途径,前者从唾液腺、脑活检、脑脊液及尿沉渣等均可分离出病毒,以脑组织阳性率最高。尸检时,咬伤局部、心包、肾上腺、胰、肝等均可获阳性培养。病毒抗原检测及鉴定阳性的标本,可以采用组织分离法和乳小白鼠分离法进一步进行病毒的检测和分离。
(1)细胞培养法分离病毒:将唾液、脑脊液、皮肤或脑组织标本研磨后,用PBS或MEM制成30%悬液,4℃ 2 000 r/min离心20min,取上清接种在已形成单层的敏感细胞(鼠神经传代细胞、Vero细胞或BHK21细胞上),吸附2小时后补加含2%血清的维持液,37℃ 5% CO2孵育4~5d,用抗狂犬病毒单克隆抗体观察特异性荧光包涵体判断结果。阳性时吸取上清至一无菌容器内-70℃保存备用或继续传代。病毒通过细胞的多次传代可以适应细胞培养并得到扩增。
(2)乳小白鼠接种法分离病毒:30%的待检标本组织悬液,离心取上清,接种1~2d龄乳鼠脑内,注射后的乳鼠应在具有高效滤过装置的负压饲养柜内饲养。症状不典型时可接种第1代后取脑继续传代,连续传代后潜伏期逐渐规律,一般为5d左右。发病乳鼠若确定为狂犬病毒感染,无菌取脑,-70℃或用含50%甘油的PBS -20℃保存,也可研磨后加灭菌脱脂牛奶制成205悬液,真空冷冻干燥,长期保存。未发病存活的鼠保留至21d后处死做免疫荧光检测。
6.动物接种和内基小体检查 均于死后进行,将10%脑组织悬液接种于2~3周龄乳鼠脑内,阳性者小鼠于6~8d出现震颤、竖毛、尾强直、麻痹等现象,10~15d因衰竭而死亡。以死者脑组织或咬人动物脑组织做病理切片或压片,用Seller染色法及直接免疫荧光法检查内基小体,阳性率70%~80%。
【疫苗的应用】
1.人用疫苗与免疫球蛋白 早在病毒分离出前的1885年,法国巴斯德成功地应用连续传代减弱病毒毒力的方法,成功制造了狂犬病减毒活疫苗。他将从自然界病兽中直接分离到的街毒稀释后在兔脑内传代,把感染的兔脑脊髓干燥,以氢氧化钾处理减毒,成为生产疫苗用的固定毒。
100多年来,全世界应用固定毒种发展了多种人用疫苗,由最初的神经组织疫苗、鸭胚疫苗到现代的细胞培养疫苗。神经组织疫苗接种反应大,有些疫苗免疫源性很低,多在经济不发达地区使用。现代疫苗接种剂量及针次减少,接种反应发生率下降,免疫效果不断提高。2004年世界卫生组织狂犬病专家磋商会强烈建议应“停止使用神经组织疫苗,人用疫苗应仅使用细胞培养和纯化鸡胚疫苗”。
根据疫苗生产所使用培养病毒的基质不同,将狂犬疫苗分为三大类。
(1)神经组织疫苗:巴斯德于1885年7月6日第1次将神经组织疫苗腹部皮下接种于1名被狂犬咬伤的9岁男孩身上,免疫成功无发病。之后巴斯德疫苗在法国及世界上其他国家广泛应用,在巴黎使用至1952年。在此期间许多国家对疫苗制备方法进行了改进,主要有以下几种。
①减毒活疫苗。Hoegyes稀释疫苗,1887年由匈牙利Hoegyes研制,即将固定毒脊髓用稀释法降低毒力。开始免疫时,病毒以1/10 000稀释,最后以1/100稀释,持续免疫2~3周。这一方法曾经在一些国家广泛使用,并证明其效果良好。
②灭活疫苗。Semple疫苗为1911年英国人Semple将感染固定毒的脑组织研制成10%悬液,用1%酚于37℃灭活24~40h,将灭活后悬液加等量生理盐水稀释成5%脑悬液,疫苗内无感染性病毒。以后用家兔、山羊或绵羊脑组织制备疫苗,用酚、紫外线以及b-丙内脂灭活。该疫苗主要在非洲和亚洲使用,常用于咬伤后免疫,注射针次一般为14-21针。我国自1949年起,一直使用由羊脑制备的Semple疫苗,1980年停止使用,由原代地鼠肾细胞疫苗取代。
为降低动物脑组织髓磷脂引起的神经系统接种反应,1955年Fuenjalida和Falaeios,以3~5日龄新生小白鼠脑组织悬液,经紫外线照射和1∶1 000酚灭活,制备乳鼠脑疫苗。新生动物脑组织髓磷脂含量低于成年动物,神经麻痹反应减少。乳鼠脑疫苗主要用于咬伤后注射,免疫方案为每天注射1针,连续14针,以后再加强2针。该疫苗效力要达到每剂1.3U以上,主要在南美洲使用。
(2)鸭胚疫苗(DVE):1956年Peck等用固定毒株接种7日龄鸭胚卵黄囊,制备DEV疫苗。1982年美国已停止使用这种疫苗。1985年瑞士Gluck制成高效安全的纯化鸭胚疫苗(PDEV),在欧洲使用。
(3)细胞培养疫苗:从20世纪50年代起,开始研究并已成功制造出各种细胞培养疫苗,其中大量应用的有人二倍体细胞疫苗、原代鸡胚细胞疫苗、绿猴肾细胞疫苗与原代地鼠肾细胞疫苗,其效力要求均为每剂2.5U以上。
①HDCV是最先广为应用的一种标准细胞疫苗。1964年由Wiktor等在美国Wiston研究所研制成功。将狂犬病固定毒PM-1903 3M株病毒在HCD WI38株上适应52代,用磷酸三丁酯灭活病毒。以后在法国和原联邦德国用MRC5细胞生产疫苗,用b-丙内脂灭活。该疫苗于1974年首次获准生产,于1978年开始商品化。HDCV不含任何神经毒因子,不含任何外源动物杂质,重复注射后耐受较好,疫苗稳定性高。
②PCECV为1974年日本Kondo用鸡胚细胞培养Flury HEP株病毒,b-丙内脂灭活,浓缩纯化制成的灭活疫苗。免疫方案采用6针法。本疫苗在世界其他国家用量较少。
1984年原联邦德国将狂犬病病毒Flury LEP株适应于PCEC培养,用b-丙内脂灭活以连续区带离心法浓缩纯化制成。该生产方法工艺较为简单,生产过程短和病毒繁殖滴度高,疫苗价格较HDCV便宜,受到WHO重视。
③Vero细胞疫苗为1984年由法国Merieux研究所研制成功。用微载体悬浮培养大量细胞进行工业化大罐培养,所用病毒种为PM1503-3M株,经过超滤浓缩、区带超离心纯化,b-丙内酯灭活制成冻干疫苗,每剂量为0.5ml。1986年开始批准应用。于4℃至少可保存5年,37℃至少30个月,45℃ 12个月。PVRV用于咬伤后免疫保护效果好,可进行大批量生产,价格较HDCV便宜,是WHO提倡的高质量疫苗。我国1995年开始人用Vero细胞疫苗的研制,使用CTN-1病毒株,适应到Vero细胞。目前已有多家生物制品研究所研制成功,并获得生产文号,以逐步取代我国现行的PHKCV。
④原代地鼠肾细胞疫苗为1960年,Fenje用狂犬病病毒SAD株在PHKC上培养,用甲醛灭活,制成疫苗。1971年,Selimov等用Vnukovo-32株适应于PHKC,制备冻干疫苗,为未经提纯的原制PHKCV,广泛应用于苏联与东欧一些国家。一般接种10~25针,每剂为1.5~5ml。此种原制疫苗抗原量低,接种次数多,剂量大,多数国家已不再使用。我国的PHKCV由卫生部武汉生物制品研究所林放涛领导的小组,经过15年研制成功。1980年卫生部批准使用,取代Semple疫苗。试验开始所用毒株为北京株兔脑固定毒,多次适应传代后的毒株称为aG株,经PHKC培养,收获病毒液,甲醛灭活,加入Al(OH)3作佐剂,疫苗效力用NIH法测定每剂量≥1.3U/ml,浓缩后效价≥2.5U。单纯浓缩后未提纯的疫苗,异性蛋白质含量高,有较严重的不良反应,2001年国家药品监督管理局已责令停止生产和使用。
目前有3类用于被动免疫的狂犬病生物制品,人狂犬病免疫球蛋白(HRIG)、马狂犬病免疫球蛋白(ERIG)和从ERIG制成的高纯度F(ab´)2产品。
2.免疫策略 用于预防人类狂犬病的疫苗,包括暴露前和暴露后预防的疫苗,应符合WHO关于生产和管理的建议,其效力、免疫源性、无害性和安全性标准等方面应达到相关标准,免疫后血清中和抗体应效价≥0.5U/ml。鉴于各地现有的疫苗质量及研究结果,WHO推荐及我国卫生部规定的暴露前、后接种策略如下。
(1)WHO推荐的免疫策略
①暴露前接种。高暴露风险者应接受暴露前接种,如狂犬病诊断或研究实验室的工作人员、兽医、动物管理人员(包括接触蝙蝠的人员)、野生动物官员以及其他生活或旅行到高风险地区的人(尤其是15岁以下的儿童)。持续暴露风险的对象必须接种,如狂犬病诊断、研究和生产者,以及实验室工作人员;频繁暴露风险的对象应当接种,如护士、医务工作者、宠物主人、动物管理员、旅行者和兽医;15岁以下儿童应该考虑接种。进行过暴露前免疫者,如以后发生暴露,接种疫苗后,可迅速产生抗体,并且不需要进行狂犬病免疫球蛋白的接种。
暴露前接种方法,推荐使用细胞培养或鸡胚生产的疫苗用于人的暴露前接种。在第0、7天和第21天或第28天肌内注射1个剂量或皮内注射0.1ml。可以容许有几天的差异。疫苗应接种于成人上臂(三角肌区)和小儿大腿的前外侧部位。禁止接种于臀部,因为皮下脂肪影响疫苗的吸收。每一剂量至少含2.5U的狂犬病疫苗(NIH试验)。暴露前接种后,可产生记忆细胞,加强免疫1次,可提高免疫应答水平。正在预防性服用抗疟药或在开始预防性服用抗疟药前不能完成整个暴露前3剂量接种者,应通过肌内注射途径接受暴露前免疫。如果接种时病人的免疫状况可疑,应该在完成暴露前3剂次接种后,评估其免疫效果。对有持续狂犬病暴露风险者,建议定期进行加强免疫。狂犬病研究人员、诊断实验室工作人员(病毒持续存在而且浓度较高的场所以及可能在难以发现的情况下发生暴露的场所)等有持续风险的人,应该每6个月进行1次血清检测。如果效价<0.5U/ml,则建议进行加强免疫。所有在诊断或研究实验室工作或从事疫苗生产而接触活狂犬病毒的人,都应该定期检测抗体水平,以避免不必要的加强接种。
②暴露后免疫。
WHO暴露类型及暴露后预防方法。
暴露分级与处理原则。发生狂犬病暴露的所有人应该迅速、彻底地清洗伤口,并正确的使用消毒药。在进行伤口处理的基础上,根据WHO暴露分级(表26-2),给以狂犬病疫苗和(或)狂犬病免疫球蛋白的注射。暴露后接种疫苗要求中和抗体出现早,抗体滴度高(≥0.5U/ml),维持时间长。
表26-2 WHO狂犬病接触和暴露的类型以及推荐采用的暴露后预防

a.暴露于啮齿动物、兔和野兔后很少需要专门的抗狂犬病暴露后预防;b.如果来自于低风险地区的表面健康的犬或猫被置于观察之下,则可推迟开始治疗的时间;c.此观察期仅适用于犬和猫,除非是濒临灭绝的物种,否则对任何其他怀疑有狂犬病的家畜和野生动物,都应进行人道主义处死,并采用正确的实验室技术检查其组织是否存在狂犬病抗原;d.人与蝙蝠接触后,应考虑进行暴露后预防,除非暴露者能除外曾被咬伤或抓伤、或曾暴露于黏膜
决定是否需要开始暴露后预防时应综合考虑各方面的因素,包括接触或损伤的性质;发生接触的地区或该动物的来源地区是否存在狂犬病;能否取得该动物进行实验室检查或观察;动物的种类;该动物的临床状况;该动物的接种史、所用疫苗的种类和接种时间。
因各地狂犬病控制水平不同,各地感染动物种类及带毒率不同,暴露后是否接种应由当地合格的医学专业人员进行风险评估后而定。在狂犬病流行区,貌似健康的动物有一定带毒率,而这些地区常缺乏实验室快速检测能力,暴露后应尽早接种疫苗,绝不能等实验室检查结果出来后再开始暴露后预防接种。如果动物不太可能感染了狂犬病,只要能在48h内得到实验室结果,则可在实验室检查结果出来之前暂缓治疗。咬人动物有狂犬病疫苗接种史并不能确保该动物没有狂犬病。孕妇、婴儿、老年人和患有其他疾病的人,应接受暴露后免疫。人狂犬病可有较长的潜伏期,即使对狂犬病暴露后8个月才来就医治疗的人,也应该像新近发生暴露的人一样,如果医学诊断认为需要的话,随后应进行全套的疫苗接种。
(2)WHO推荐暴露后接种方法有肌内注射法、皮内注射法。
肌内注射法,包括五剂量肌内注射法和简化多部位肌内注射法。五剂量肌内注射法为第0、3、7、14和28天肌内注射1个剂量的疫苗;注射部位为上臂三角肌区;或幼儿大腿肌肉的前外侧部。简化多部位肌内注射法为第0天,分别在左和右上臂肌肉三角肌区各注射1个剂量的疫苗;此后于第7和21天,将1个剂量的疫苗注射至上臂(三角肌区);此种程序可免去2次就诊和1剂疫苗。
皮内注射法,所需疫苗总量低于肌内注射法,WHO建议在现代狂犬病疫苗供应不足或虽有供应却因为价格高而不能完全使用的国家或地区,最好用皮内注射狂犬病疫苗的方法取代用脑组织疫苗进行暴露后预防。皮内注射必须由经过此项技术培训的工作人员进行,适合于在暴露人群集中的狂犬病门诊接种。配制后,疫苗小瓶应存放于2~8℃,并应在8h内尽快用完所有的内容物。加有佐剂的狂犬病疫苗不应进行皮内注射。皮内注射法包括“2-2-2-0-2”法和“8-0-4-0-1-1”法。
更新的泰国红十字会皮内注射法(“2-2-2-0-2”法)。专家磋商会有足够的临床证据表明,原泰国红十字会法(“2-2-2-0-1-1”法)第90天所接种的单剂量疫苗,可以被第28天注射2个剂量的疫苗(“2-2-2-0-2”法)所替代。更新的泰国红十字会皮内注射法为第0、3、7和28天,在2个不同的淋巴引流区(通常为左、右上臂),皮内注射1个剂量(0.1ml)的疫苗。皮内注射的疫苗必须要在皮肤上形成1个可见且触摸得到的“鼓包”。如果不小心将1个剂量的疫苗注射到皮下或肌肉内,则应该在皮内再注射1个剂量的疫苗。目前安万特巴斯德(Aventis Pasteur)公司生产的纯化Vero细胞狂犬病疫苗和凯龙疫苗公司生产的纯化鸡胚细胞狂犬病疫苗能有效地用于泰国红十字会法。
八部位皮内注射法(“8-0-4-0-1-1”法)。第0天,在8个不同部位(臂、股外侧、肩胛上区和耻区)皮内注射1个剂量(0.1ml)。第7天,在每侧臂三角肌区和每侧股外侧皮内注射4个0.1ml疫苗。此后,第28和90天各注射0.1ml疫苗。同肌内注射法相比,此法降低了疫苗的成本,而且,通常到第14天时,能比推荐的其他方法产生更强的抗体反应。该法不能产生明显的早期抗体反应,为确保最佳治疗效果,对有严重暴露的病人,必须还要使用被动免疫制剂。目前安万特巴斯德(Aventis Pasteur)公司生产的人二倍体细胞疫苗和凯龙疫苗公司生产的纯化鸡胚细胞狂犬病疫苗可用于此法接种。
曾经接种者的暴露后预防。无免疫受损且曾经接种过符合WHO疫苗产品标准有效狂犬病疫苗的人,应接受2次加强免疫,包括分别在第0天和第3天进行肌内或皮内注射,不需要进行被动免疫。曾接受过暴露前或暴露后接种、但疫苗效价不确定的人,应接受全部的暴露后接种,包括被动免疫。
艾滋病病毒感染者和病人的暴露后预防。CD4计数极低的人针对狂犬病的中和抗体反应相当低或无法测出。对于此类病人以及那些因其他原因而不能确定是否仍存在免疫记忆的人,在对伤口进行彻底的治疗、消毒的同时,应局部浸润注射狂犬病免疫球蛋白。
发生Ⅱ类暴露的免疫受损病人,除接受上述全部的暴露后接种外,还应接受狂犬病免疫球蛋白治疗。还应向具有狂犬病预防专业知识的传染病专家咨询。
(3)卫生部规定暴露后的免疫策略
①我国暴露类型及暴露后免疫方法。2006年卫生部《狂犬病暴露后处置工作规范(试行)》中将狂犬病暴露分为三级,暴露分级与WHO基本一致,在处理原则上,更适合中国国情,暴露后不论动物如何,对Ⅱ级、Ⅲ级暴露均应开展狂犬病疫苗的全程接种(表26-3)。
表26-3 2006年卫生部狂犬病暴露分级与处理原则

②暴露后免疫。
首次暴露后狂犬病疫苗接种程序,一般咬伤者于0(注射当天)、3、7、14、28天各肌内注射狂犬病疫苗1个剂量(儿童用量相同)。
再次暴露后疫苗接种,全程接种符合效价标准的疫苗后1年内再次被动物致伤者,应于0和3天各接种1剂疫苗;在1~3年内再次被动物致伤,且已进行过上述处置者,应于0、3、7天各接种1剂疫苗;超过3年者应接种全程疫苗。
对暴露前后所用的疫苗效价无法证实者及免疫回忆应答无法确认者仍应进行全程免疫。
被动免疫制剂使用。对于Ⅲ类暴露及免疫功能低下者Ⅱ类以上的暴露,接种疫苗的同时要在伤口周围浸润注射动物源性抗血清或人源免疫球蛋白。人源免疫球蛋白剂量为20U/kg体重,或动物源性抗血清40U/kg体重。注射动物源性抗血清前必须严格进行过敏试验。方法是使用抗血清1/10~1/100稀释血清0.1ml做皮内注射,30min后皮丘红晕小于1cm为阴性,可全量注射。若为阳性,可逐步加量脱敏注射,用完全量或改用人源免疫球蛋白。注射动物源性抗血清或人源免疫球蛋白应与首针疫苗接种同时进行(暴露后尽早实施)。7d内注射血清仍有效。尽量避免在接种疫苗前1天以上注射抗血清。实施动物源性抗血清注射的医疗卫生机构必须具备对变态反应的抢救能力。注意不要把动物源性抗血清或人源免疫球蛋白和狂犬病疫苗注射在同一部位;禁止将动物源性抗血清或人源免疫球蛋白与狂犬病疫苗混合在1个注射器内使用。如解剖学结构可行,应按推荐剂量将被动免疫制剂全部浸润注射到伤口周围,同时应避免多次重复针刺进伤口。假如手指或足趾需要浸润注射,必须小心进行以防止引起间隔综合征。当全部伤口进行浸润注射后尚有剩余免疫制剂时,应将其注射到远离疫苗注射部位的深部肌肉。伤口严重或有多处伤口(特别是幼儿),按常规剂量不足以浸润注射伤口周围的,可用生理盐水将被动免疫制剂适当稀释到足够体积再进行浸润注射。疫苗注射应当在清洗伤口和使用被动免疫制剂后进行。对于黏膜暴露者,应将被动免疫制剂涂抹到黏膜上。
【疫苗接种后的免疫效果】
狂犬疫苗的使用,为狂犬病的控制做出了重大贡献,使曾肆虐人类、无法可治的狂犬病,得到有效控制。通过人暴露前后的免疫预防及伤口处理,使狂犬病发病率大幅度下降。被病犬咬伤后,未经处理者的狂犬病发病率为15%~30%,若及时进行伤口处理和接种疫苗,发病率可降为0.15%左右。通过对家畜及野生动物狂犬病的预防免疫工作,一些国家达到了无狂犬病国家或地区标准。狂犬疫苗的保护效果为大量实践所证实。
神经组织疫苗与现代细胞培养疫苗,其生产工艺、免疫效果不同,在不同的时代,发挥着各自的作用。曾经广为使用的Semple神经组织疫苗,在全球百余万例的统计资料中,动物咬伤者使用疫苗有效率为99.5%,未使用疫苗者发病率为5%~17%,保护效果明显。美国1980-1982年证实,被狂犬病动物咬伤的511人经HDCV合用HRIG治疗,未发生1例狂犬病。1985年,64名健康自愿者,注射2针或3针PVRV后抗体全部阳转,GMT达28.2U/ml和32.4U/ml。1987年用PVRV对1 626名接触者(其中309名为疯动物咬伤)用PVRV 5针法免疫,47名严重咬伤者在0d合用HRIG,所有人均得到保护。用我国生产的含佐剂PHKCV,对301名被疯动物咬伤者接种3-5针,对21名严重咬伤者合用抗狂犬病马血清,经7个月至3年观察,获得完全保护。
没有接受过狂犬疫苗接种者,血清抗体一般为阴性,1999年邵预峰等对1 077名暴露者进行免前狂犬病抗体检测,均为阴性。我国既往使用的浓缩而未纯化的地鼠肾细胞狂犬疫苗,接种后抗体阳性率一般为82.97%~87.20%。经纯化后的地鼠肾细胞疫苗及Vero细胞疫苗抗体阳性率可达97.68%~100%。2002年中国药品生物制品检定所董关木等对我国11家企业研制成功的9批纯化地鼠肾细胞狂犬病疫苗和5批纯化Vero细胞狂犬病疫苗免疫效果观察显示,纯化地鼠肾细胞疫苗3针免疫程序(暴露前免疫)中和抗体GMT为9.8~24.2U/ml,5针(暴露后免疫)5.7~39.8U/ml。无论是3针还是5针免疫程序,全程免疫后的中和抗体阳转率均为100%。无佐剂疫苗的效果大大优于佐剂疫苗,在第1针免疫后的第7天中和抗体GMT水平已达0.4U/ml,阳转率已达到45.2%,而佐剂疫苗同期GMT水平和阳转率仅为0.1U/ml和8.1%。第14天,该两项指标分别为2.3U/ml和1.2U/ml以及100%和59.5%。全程免疫后14d两者差异无显著意义。纯化Vero细胞疫苗3针免疫程序中和抗体GMT为2.9U/ml,5针为3.1~17.48U/ml,3针及5针全程免疫后的中和抗体阳转率均为100%。
细胞培养疫苗为WHO推荐使用的疫苗,接种后产生抗体早,抗体水平高,抗体阳转率高,用于暴露前及暴露后注射,抗体水平均能维持相当长时间,一般1~2年或更长,加强1针后,抗体迅速增长,并维持较高水平2~5年。目前我国使用的Vero细胞疫苗,已达到国际同类产品水平,接种后抗体阳转率可达100%,不良反应轻微,可大罐培养,适于工业化生产,正推广使用。
受疫苗质量(免疫源性、保存温度)、受种者个体差异、接种人员的操作技术、检测方法的敏感性等多方面的影响,狂犬疫苗接种后大约有5%的人,不会产生抗体或抗体水平很低,为提高免疫成功率,建议5针接种完成后15d左右进行中和抗体检测,对阴性者加强免疫2针。邵预峰等研究显示,阴性25人,补种后,抗体全部阳转。
【疫苗接种的禁忌证与不良反应】
1.禁忌证
(1)暴露后接种:因狂犬病是致死性疾病,暴露后治疗性接种无任何禁忌证。对是否立即进行接种,应具体分析暴露的风险及受种人员身体状况,综合分析,权衡利弊。对高度危险的暴露者应立即接种疫苗。在发生狂犬病危险性较小的情况下,如果正在感冒而有发热者,可等体温下降后立即接种。有严重变态反应病史的人,在接种疫苗时应备有肾上腺素等应急药物,在监护条件下接种。
(2)暴露前接种:发热、急性疾病、严重慢性疾病、神经系统疾病、过敏性疾病、对抗生素和生物制品有过敏史者禁用。哺乳期、妊娠期妇女建议推迟接种。
2.不良反应 不同种类的狂犬病疫苗接种后,发生不良反应类型与发生率不同。神经组织疫苗的局部与全身反应比较严重,接种后容易引起神经性麻痹病例,严重者可致死亡。Semple脑组织疫苗各地报告不良反应的剂量比例为1∶150~1∶2 000。
未经浓缩和纯化的地鼠肾细胞疫苗,病毒含量低,抗原量少,与神经组织疫苗相比,接种反应大大降低,不再出现变态反应性脑脊髓炎,但浓缩后的狂犬病疫苗,在疫苗效价达到WHO规定的每剂2.5U标准后,杂质浓度增高,大面积应用后不良反应增大,主要表现为注射部位剧烈疼痛,大面积肿胀,全身不适,发热,全身性荨麻疹,瘙痒,过敏性紫癜,血管神经性水肿,个别出现休克、神志不清、并有危及生命者。严重不良反应发生率为5%~10%。这些不良反应均需临床药物处理才能缓解,有的需要住院治疗。
现代精制细胞培养狂犬病疫苗,不仅免疫效果大大优于神经组织疫苗,而且经纯化后,杂质极少,异常反应及中重度不良反应罕见,反应轻微。可见的局部反应为少数人注射部位疼痛、红肿、硬结、瘙痒、水肿、淋巴结肿大;全身反应有轻度发热、寒战、晕厥、乏力、头痛、眩晕、关节痛、肌肉痛、胃肠道功能紊乱、过敏性反应等。
2002年董关木等研究,国产纯化地鼠肾细胞狂犬病疫苗轻度反应的发生率为0%~31.5%,佐剂疫苗发生率为35%,无佐剂疫苗发生率为0%~8.3%,氢氧化铝是发生不良反应的重要因素之一。纯化Vero细胞狂犬病疫苗的反应发生率为0%~39.4%。均未见中重度反应。2004-2006年3 563人接种人用纯化Vero细胞狂犬病疫苗后,接种总反应率为20.46%;以一般反应为主,共689例,占反应总例数的94.51%,低热伴轻微头痛、头晕占61.54%、注射部位轻度红肿占7.26%,轻微的皮疹占2.03%,关节和肌肉疼痛占29.17%,均不经治疗,1~2d自愈。出现异常反应40例,占反应总例数的5.49%,分别为体温≥38.5℃、注射部位红肿直径≥5cm,血管神经性水肿等,经过对症治疗后全部痊愈。
各种疫苗的一般反应及严重反应见表26-4。
表26-4 各种狂犬疫苗的不良反应

【相关疫苗接种不良反应处理】
轻微局部及全身反应,一般不需要处理,可自行缓解。若出现较严重不良反应,应对症治疗。
1.局部反应处理 较重的局部反应,可用干净的毛巾热敷,每日数次,每次10~15min。对个别严重的红肿、疼痛反应,给小剂量解热镇痛药,一般每日2或3次,连续1~2d。
2.全身反应处理 加强观察,注意休息,多喝开水,防止继发感染。发热可以物理降温,也可适当使用退热药。恶心、呕吐应用止吐剂,或给予维生素B6;胃痛、腹痛者服颠茄片或颠茄合剂;腹泻一般不使用抗生素,可服用吸附或收敛药。阿托品对呕吐、腹痛、腹泻有效,但慎用。个别严重者,需要补液,为防止感染可使用抗生素。
变态反应,用抗过敏治疗方法。
【问题与展望】
自20世纪70年代出现了细胞培养疫苗后,从商业化的角度,在新的人狂犬病生物制品方面尚无大的进展。在几种未来可供选择的方法中,反向遗传学技术为将负链RNA病毒作为克隆和表达的载体提供了宽广的发展空间,单克隆抗体有望用于狂犬病的预防与治疗。新的更安全有效的重组病毒,如腺病毒、DNA和植物为基础的疫苗,得到关注与发展。基因重组技术为制备多价疫苗带来了前景。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。















