首先,根据剂型特点,结合药物理化性质和稳定性情况,确定制剂的制备方法,并进行预试验。再在预试验的基础上,采用比较法、正交设计、均匀设计或其他方法进行的制剂工艺研究及优化,初步确定实验室规模样品的生产工艺。并根据不同的剂型,选择合理的评价指标进行制剂的基本性能评价和稳定性等评价。
目前,生物药剂学研究已经证实,同一原料制成不同剂型,其作用起始时间、作用强度和持续时间均有显著差异;同一剂型,当辅料成分、工艺方法改变时会影响到药物作用强度与稳定性。为此,制剂的处方、制备工艺和辅料规格、来源及其质量对药效影响很大,必须进行深入细致的研究。
(一)基本性能评价
根据制剂的类型和剂型的特点,对不同的剂型进行不同的基本性能评价。表6-1给出了常见剂型的基本性能评价项目,对于特殊制剂如特定的给药体系、缓释和速释制剂,还需要制定特殊的性能评价项目。
表6-1 常见剂型的基本性能评价项目
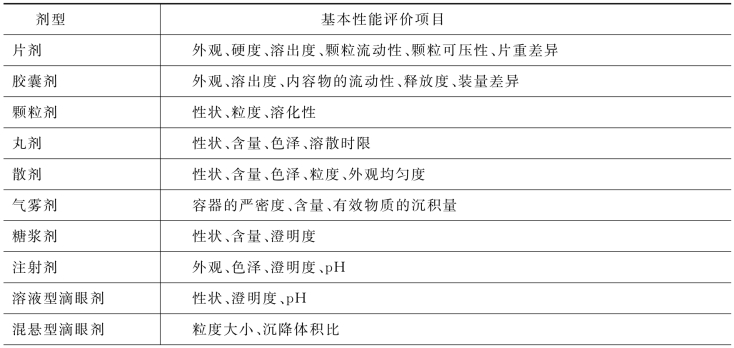
(续 表)

(二)制剂稳定性评价
对经过制剂基本性能评价合格的药物制剂样品进行稳定性评价,一般要求选用两种以上的制剂进行制剂影响因素的考察,考察项目有含量测定、有关物质检查、外观变化检查,选择出稳定的制剂处方。并根据稳定性试验要求进行制剂的稳定性研究,如在不同条件下,进行对光、热、湿的稳定性研究和对降解产物的分析研究。原料药物制成制剂后,稳定性常不如原料好。因此对制剂必须进行稳定性研究试验。包括自然存放和化学动力学试验结果。化学动力学试验是加速试验的理论依据。该试验是在较高的温度条件下进行,用较短的时间获得结果,推算出在室温条件下制剂能保持原有浓度(或含量)的90%所需的时间(t0.9)。
1.液体制剂 包括注射剂,可用加速试验法求室温的有效期。例如40℃加速试验3个月,大致可相当于室温25℃储存2年;也可从实验数据估算出最适pH,决定是否需要抗氧剂或是需要避光保存。
2.固体制剂 药物降解规律比较复杂,但仍有若干方法可以采用。固体制剂中的辅料有时可影响药物的稳定性。例如硬脂酸镁可加速阿司匹林的水解,蔗糖等易吸湿性成分可严重影响某些药物的质量。因此,用什么辅料组成处方最好,应进行一些初步实验。通常可在不同温度(40℃、60℃),不同RH%(如75%、90%),强光照射(如2 000~4 000lx)进行加速试验,定期取样,观察结果。
(三)工艺、包装和储存要求
根据稳定性考察研究结果,对不同的制剂提出不同的工艺要求、包装要求和储存条件的要求。如对光敏感的药物,应采用避光的工艺过程,采用避光的包装材料进行制剂的包装处理;对湿度敏感的易吸湿和吸湿易分解的药物应采用防潮的包装材料;对温度敏感的制剂除严密包装外应规定低温或阴凉处储存的温度条件。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。
















